低温弱光对黄瓜若干物质代谢指标的影响
2015-10-13阎世江张继宁张建军
阎世江,刘 洁,张继宁,张建军
(1.山西省农业科学院 蔬菜研究所,山西 太原 030031;2.山西省农业科学院 科技情报研究所,山西 太原 030031;3. 辽宁鞍山市园艺科学研究所,辽宁 鞍山 114011)
试验研究
低温弱光对黄瓜若干物质代谢指标的影响
阎世江1,刘洁2,张继宁1,张建军3
(1.山西省农业科学院蔬菜研究所,山西 太原 030031;2.山西省农业科学院科技情报研究所,山西 太原 030031;3. 辽宁鞍山市园艺科学研究所,辽宁 鞍山 114011)
选取耐低温性不同的6份材料给予低温弱光逆境,白天温度设定为12 ℃,晚上设定为8 ℃,光照时间为8 h,强度为30 µmol·m-2·s-1,共处理14 d。调查其耐低温性及根系总吸收面积、活跃吸收面积、比表面积、可溶性糖含量,结果表明总吸收面积、活跃吸收面积、比表面积、可溶性糖含量在常温下差异不显著,低温处理以后各品种间差异均极显著,根系活力下降,可溶性糖含量上升。耐低温性与根系总吸收面积、可溶性糖含量呈正相关。
低温;黄瓜;物质代谢
黄瓜(Cucumis sativus L.)属蔓生攀缘植物,喜温,起源于国外,目前是国内广泛种植的蔬菜,尤其在我国北方寒冷地区保护地中栽培面积很大。低温对黄瓜生长有严重危害,因此其耐低温机理的研究日益成为研究的热点。已有的研究主要有低温对黄瓜形态的影响[1-2]、维持细胞膜稳定的保护酶活性[3-4]、相关性状的遗传[5]等方面。黄瓜在低温下的生长发育状况可通过物质代谢表达,代表性指标是根系活力和糖的含量,有关的研究少见报道。本研究利用6份黄瓜高代自交系,给予其低温弱光条件,测定根系活力及可溶性糖含量,从物质代谢的角度揭示黄瓜耐低温性的生理机制,为黄瓜抗逆生理研究奠定基础。
1 材料和方法
1.1材料
选取不同遗传来源的6份黄瓜高代自交系,代号分别为1号~6号,均属密刺类型,其中1号、2号耐低温性较强,3号、4号耐低温性居中,5号、6号耐低温性较弱。
1.2方法
2014年3月将6份黄瓜种子在鞍山市园艺科学研究所科研基地1号温室播种,播入50孔穴盘,每份材料播种50粒,30 d后分苗至直径为10 cm的营养钵,20 d后每份材料取15株,放入SPX-250IC型人工气候箱(上海博迅使用公司产)进行低温弱光处理,白天温度设定为12 ℃,晚上设定为8 ℃,光照时间为8 h,强度为30 µmol·m-2·s-1,共处理14 d。设3次重复,然后调查耐低温性,分级标准参考查丁石[5]的方法,具体如下:0级,全株受冻死亡或接近死亡;1级,秧苗各叶片普遍受冻,其中3~4叶受冻面积>50%;2级,秧苗3~5叶受冻,其中2 ~3叶受冻面积>50%;3级,秧苗2~4叶受冻,其中1~2叶受冻面积>50%;4级,秧苗1~2叶受冻,面积约20%~30%;5级,秧苗生长正常,无任何受冻症状。耐低温性赋值按如下公式计算:

式中S表示受低温伤害后,相应级别的黄瓜株数。
另取5株在正常温度光照下培养。处理结束后同时测定对照与处理的根系活力,即总吸收面积、活跃吸收面积、比表面积(甲烯蓝法)、可溶性糖含量(蒽酮法)[6]。采用DPS软件进行数据分析,Excel统计并制图。
2 结果与分析
2.1供试材料的耐低温性
由图1可知,黄瓜的耐低温性在材料间差异极显著,1号、2号的耐低温性最高,达4.5以上,3号、4号的耐低温性居中,为3.4,3.5,5号、6号的耐低温性最低,在2.1以下。

图1 不同材料的耐低温性比较
2.2总吸收面积、活跃吸收面积、比表面
在常温下,各材料的总吸收面积、活跃吸收面积的差异未达显著水平,处理后2个指标均下降,差异显著(图2),其中1号、2号表现较高,2个指标分别为1.596,1.593,0.791,0.78 1 m2,而耐低温性较差的5号、6号的这2个指标较低,分别为1.53,1.516,0.752,0.745 m2,3号、4号的这2个性状居中,分别为1.525,1.530,0.753,0.755 m2。
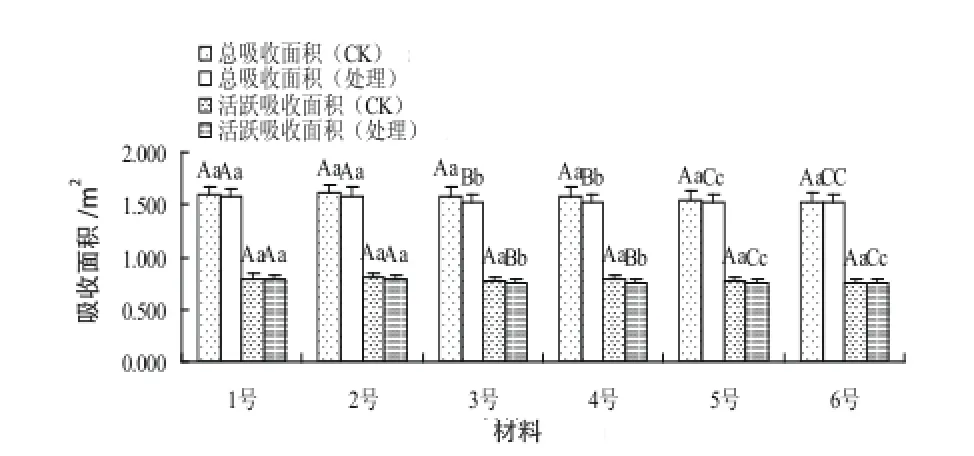
图2 材料的吸收面积
根系比表面积见图3,常温下差异不显著,低温处理后比表面积均下降,差异达显著水平,1号、2号较高,为2.688,2.693 m-1,其余的材料为1.407,1.236,0.911,0.845 m-1。
黄瓜幼苗根系的总吸收面积、活跃吸收面积、比表面在常温下材料间的F值分别为1.375,0.006,0.088,未达显著水平,低温处理以后F值分别为8.666,12.8645,203.208,差异均达到极显著的水平。

图3 材料的比表面积
2.3可溶性糖
可溶性糖含量见图4,由此图可知,在常温下材料间的差异不显著,经过低温处理后,可溶性糖含量均升高,差异达显著水平。1号、2号升至4.942,5.417 µg·g-1,而5号、6号升至2.801,2.501 µg·g-1,3号、4号升至3.48 ,3.882 µg·g-1,含量居中。

图4 不同材料可溶性糖含量
2.4物质代谢与耐低温性的相关分析
由表1可知,在偏相关分析中耐低温性与总吸收面积、可溶性糖含量达显著相关,相关系数为0.801,0.900。在单相关中,耐低温性与所有指标呈显著正相关,相关系数为0.874,0.825,0.975,0.960。

表1 各指标与耐低温性的相关分析
3 讨 论
根系是植物体重要组成部分,其与耐低温的关系报道较多,王瑞云等[7]报道,苜蓿幼苗经低温处理,根系活力较对照提高,耐低温性强的品种根系活力更高。本试验的结论与之相同,说明当低温胁迫来临时,对于耐低温性强的材料,低温对其代谢及其他生理活动影响小,所以根部总吸收面积、活跃吸收面积、比表面积降低幅度较小。耐低温性较弱的材料影响较大。
可溶性糖含量能反映植物体耐低温弱光的能力。研究表明耐低温性较强的材料在低温下可溶性糖等渗透调节物质含量上升,以维持正常代谢[8-11],本试验的结论与之相同。杨晓玲等[12]认为可溶性糖增强渗透调节能力,可维持细胞膜的稳定性。另一方面低温下使淀粉转化为可溶性糖,增加了细胞液的浓度,提高了细胞防脱水能力,也能维持细胞膜的稳定性[12]。
[1]侯锋,沈文云,吕淑珍.黄瓜幼苗耐寒性鉴定方法研究[C].中国主要蔬菜抗病育种进展.北京:科学出版社,1995:474-477.
[2]王永健,姜亦巍,曹宛虹.低温对不同品种黄瓜种子萌发、过氧化物酶及同功酶的影响[J].华北农学报,1995,10(2):72-76.
[3]沈文云,侯锋,吕淑珍.低温对杂交一代黄瓜幼苗生理特性的影响[J].华北农学报,1995,10(1):56-59.
[4]Staub JE, kupper RS,Schuman D,et al. Electrophoretic variation and enzyme storage stability in cucumber[J]. J Amer. Soc Hort Sci,1985,110(3):426-431.
[4]闫世江,司龙亭,马志国,等.黄瓜苗期耐低温性及相关形态学性状的遗传分析[J].沈阳农业大学学报,2008,39(1):11-14
[5]查丁石,陈建林,丁海东. 茄子耐低温弱光鉴定方法初探[J].上海农业学报,2005,21(2):100-103.
[6]张宪政,陈凤玉,王荣富,等.植物生理学[M].沈阳:辽宁科学技术出版社,1994.
[7]王瑞云,任有蛇,岳文斌,等.低温胁迫对苜蓿幼苗存活及生理生化指标的影响[J].激光生物学报,2006,15(4):342-348.
[8]高桂花,王瑞兵,刘艳芳,等.低温胁迫下玉米幼苗生理变化的研究[J].河北农业科学,2006,10(4):16-19.
[9]朱进.低温胁迫下不同西葫芦品种抗寒性生理指标的比较[J].湖北农学院学报,2004,24(2):106-108.
[10]王磊,李建勇,张振贤,等.冻害低温下越冬甘蓝渗透调节物质的变化和作用[J].山东农业大学学报,2001,32(4):487-490.
[11]杨晓玲,杨晴,刘艳芳,等.水杨酸对黄瓜种子萌发及幼苗抗低温的影响[J].种子,2007,26(1):78-80.
[12]王合理.黄瓜低温冷害及耐冷性研究进展[J].塔里木农垦大学学报, 1999,11(4):58-60.
S642.2
A
1002-0659(2015)05-0001-02
2015-08-21
主要作者简介:阎世江(1975-),男,山西太原人,助理研究员,博士,主要从事蔬菜遗传育种研究。E-mail:syauyan@163. com
