子宫内膜异位症中子宫内膜间质细胞血管生成能力的研究
2015-10-12苏晓华宋殿荣张英张崴郭洁王雅楠赵琳
苏晓华,宋殿荣,张英,张崴,郭洁,王雅楠,赵琳
子宫内膜异位症中子宫内膜间质细胞血管生成能力的研究
苏晓华,宋殿荣,张英,张崴,郭洁,王雅楠,赵琳
目的:研究子宫内膜异位症(EMs)患者子宫内膜间质细胞环氧化酶2(COX-2)、前列腺素E2(PGE2)、血管内皮生长因子(VEGF)的蛋白分泌及mRNA表达。方法:收集EMs患者的在位及异位病灶子宫内膜组织和子宫肌瘤患者在位内膜组织,原代消化培养子宫内膜细胞,取纯化的子宫内膜间质细胞进行研究,酶联免疫吸附测定法(ELISA)检测细胞COX-2、PGE2、VEGF蛋白的分泌,逆转录聚合酶链反应(RT-PCR)法检测COX-2、PGE2和VEGF的mRNA的表达。结果:EMs和子宫肌瘤患者分泌期在位子宫内膜间质细胞COX-2、PGE2、VEGF蛋白分泌及mRNA表达与增殖期比较差异均无统计学意义(P>0.05);EMs患者在位及异位的子宫内膜间质细胞COX-2、PGE2、VEGF蛋白分泌及mRNA表达比子宫肌瘤患者在位细胞均升高,差异有统计学意义(P<0.05或P<0.01);EMs患者异位的子宫内膜间质细胞COX-2、PGE2、VEGF蛋白分泌及mRNA表达比其在位细胞均升高,差异有统计学意义(P<0.05或P<0.01)。结论:EMs患者在位及异位子宫内膜间质细胞COX-2、PGE2、VEGF的蛋白分泌及mRNA表达均升高,且异位病灶间质细胞升高更明显,提示在EMs发病中异位病灶子宫内膜间质细胞血管生成能力更强。
子宫内膜异位症;间质细胞;环氧化酶2;前列腺素E2;血管内皮生长因子
(J Int Obstet Gynecol,2015,42:49-53)
子宫内膜异位症(EMs)是妇科常见疾病,可影响5%~10%的育龄期妇女,在不孕症患者中患病率高达20%~50%[1],其虽为良性疾病,却具有无限生长、生成新生血管、浸润并破坏周围组织、局部或远处转移等恶性肿瘤的一些特性。月经期剥脱内膜的异位种植是目前公认的腹腔EMs形成的主要原因,这些内膜组织存活和生长的核心是形成新生血管,建立有效的血液供应,从而使其能够黏附和种植到间皮表面,可见血管生成是EMs形成的关键因素[2]。子宫内膜细胞具有产生激素、持续增殖、抗凋亡、促进血管生成、侵袭、转移和调节局部免疫系统的特点。血管内皮生长因子(VEGF)是血管生成中重要的因子,可以通过影响内皮细胞的增殖、迁移、组成管腔和增加毛细血管渗透性而参与血管生成[3]。在癌组织中高表达的环氧化酶2(COX-2)诱导产生的前列腺素E2(PGE2)能刺激肿瘤血管的生成[4],COX-2、PGE2和VEGF与EMs血管形成的关系已受到国内外学者的关注。本研究利用子宫内膜细胞体外培养技术,采用酶联免疫吸附测定法(ELISA)和逆转录聚合酶链反应(RT-PCR)法研究体外培养EMs患者在位及异位子宫内膜间质细胞COX-2、PGE2、VEGF的分泌及其mRNA的表达,探讨EMs中不同部位子宫内膜间质细胞血管生成的能力。
1 材料与方法
1.1标本采集标本取自2012年10月—2013年12月在天津中医药大学第二附属医院妇科因子宫肌瘤、卵巢巧克力囊肿行手术治疗的已婚妇女,患者年龄23~49岁,平均年龄(32.56±7.42)岁,既往均月经规律,未放置宫内节育器,术前6个月内未服用抗炎、激素类等药物治疗。在位子宫内膜组织取自术前行诊断性刮宫术的内膜,病理证实子宫内膜无病理性改变,异位内膜组织取自手术切除的卵巢异位病灶,术后病理证实符合EMs。本研究共收集子宫肌瘤患者在位子宫内膜组织30例,其中分泌期内膜12例,增殖期18例;EMs患者在位内膜组织35例,其中分泌期内膜10例,增殖期25例;卵巢异位病灶35例。所有标本的采集均得到患者本人或家属知情授权,并经医院伦理委员会批准。
取材后将标本迅速放入装有冰的细胞全培养基的离心管中,30 min内移入实验室于紫外线消毒后的超净台中进行操作。
1.2实验方法
1.2.1子宫内膜细胞原代培养参考文献[5]的方法消化培养子宫内膜细胞,以1×105/mL密度接种于25 cm2培养瓶中,置37℃、5%CO2的培养箱内培养,24 h后观察细胞贴壁情况并换液,隔48 h换液1次。
1.2.2子宫内膜细胞传代培养原代细胞长满瓶壁约80%时进行传代,以1∶2或1∶3比例传代。
1.2.3子宫内膜间质细胞分离纯化参考文献[6]用差速沉降法结合筛网过滤法将子宫内膜间质细胞与腺上皮细胞分离、纯化,收集、培养间质细胞。
1.2.4子宫内膜细胞免疫荧光鉴定将纯化后的子宫内膜间质细胞接种到6孔板内,待细胞长满40%时进行免疫荧光鉴定,一抗(鼠抗人波形蛋白和鼠抗人角蛋白,Abcam)稀释浓度为1∶200,二抗(驴抗鼠蛋白,Abcam)稀释浓度为1∶300。
1.2.5子宫内膜间质细胞COX-2、PGE2、VEGF浓度检测
将子宫内膜间质细胞以1×105/mL的密度接种于96孔板,每孔100 μL,每组设6个复孔,待细胞长满后取上清液,ELISA法测定COX-2、PGE2、VEGF水平,严格按照试剂盒操作规程测定。
1.2.6子宫内膜间质细胞COX-2、PGE2、VEGF的mRNA表达检测将子宫内膜间质细胞接种到75 cm2培养瓶,待细胞长满后消化,采用RT-PCR法检测COX-2、PGE2、VEGF的mRNA表达。
1.2.6.1子宫内膜间质细胞总RNA提取严格按试剂盒说明操作,测定波长260 nm的光密度(OD)及波长280 nm的OD以估算总RNA的浓度及纯度,并用1%琼脂糖凝胶电泳鉴定总RNA完整性,提取的总RNA于-80℃保存。
1.2.6.2引物序列见表1。
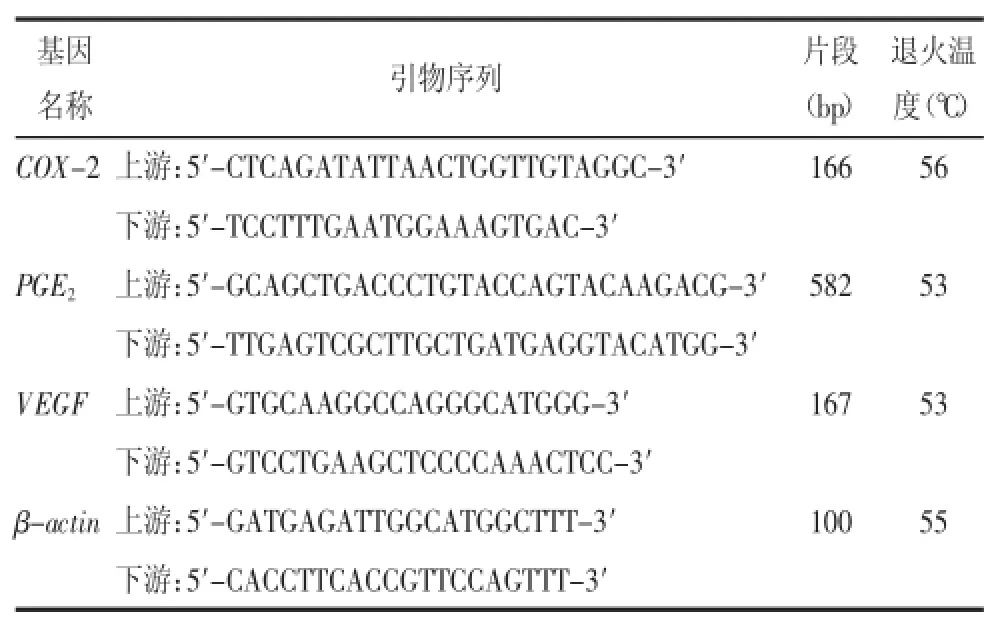
表1 COX-2、PGE2、VEGF、β-actin RT-PCR引物序列
1.2.6.3RT-PCR扩增反应取1 μg总 RNA,分别扩增COX-2、PGE2、VEGF及β-actin基因,PCR反应体系为25 μL,反应条件:逆转录反应50℃30 min,94℃预变性2 min;94℃变性45 s,53~56℃退火45 s(根据不同目的基因选择相应的退火温度),65℃延伸1 min,共35次循环;65℃终延伸10 min,4℃保存。取各组PCR产物7 μL行1.5%琼脂糖凝胶电泳,在200 mA电流下电泳30 min,紫外灯下观察电泳条带。
1.2.6.4PCR产物半定量分析PCR产物电泳后经Gel-PRO ANALYZER凝胶定量分析软件对电泳条带进行灰度分析,目的基因相对表达强度=目的基因电泳条带灰度值/β-actin内参照条带灰度值。
1.3统计学方法采用SPSS11.5统计软件进行分析,数据以均数±标准差(±s)表示,2组间经方差齐性检验方差齐后,用两独立样本t检验;3组间比较经方差齐性检验方差齐后,用单因素方差分析,若组间差异有统计学意义,多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1细胞培养情况及鉴定30例子宫肌瘤患者在位子宫内膜中29例成功培养出子宫内膜细胞,1例染菌;35例EMs患者在位内膜中33例成功培养出子宫内膜细胞,2例染菌;35例异位病灶中25例成功培养出子宫内膜细胞,10例因病灶过小未培养出细胞,无染菌标本。经差速沉降法结合筛网过滤法获得的子宫内膜间质细胞纯度可达95%,第4代间质细胞经免疫荧光鉴定,鼠抗人角蛋白(Cytokeratin)染色阴性,而鼠抗人波形蛋白(Vimentin)染色阳性,见图1(见后插一),证实研究的子宫内膜细胞中以间质细胞为主。
2.2子宫内膜间质细胞COX-2、PGE2、VEGF浓度比较
2.2.1增殖期、分泌期在位子宫内膜间质细胞子宫肌瘤患者分泌期子宫内膜间质细胞COX-2、PGE2、VEGF浓度与增殖期比较差异均无统计学意义(P>0.05);EMs患者分泌期子宫内膜间质细胞COX-2、PGE2、VEGF浓度与增殖期间质细胞比较差异也均无统计学意义(P>0.05),见表2。
表2 增殖期、分泌期在位子宫内膜间质细胞COX-2、PGE2、VEGF浓度比较(±s)
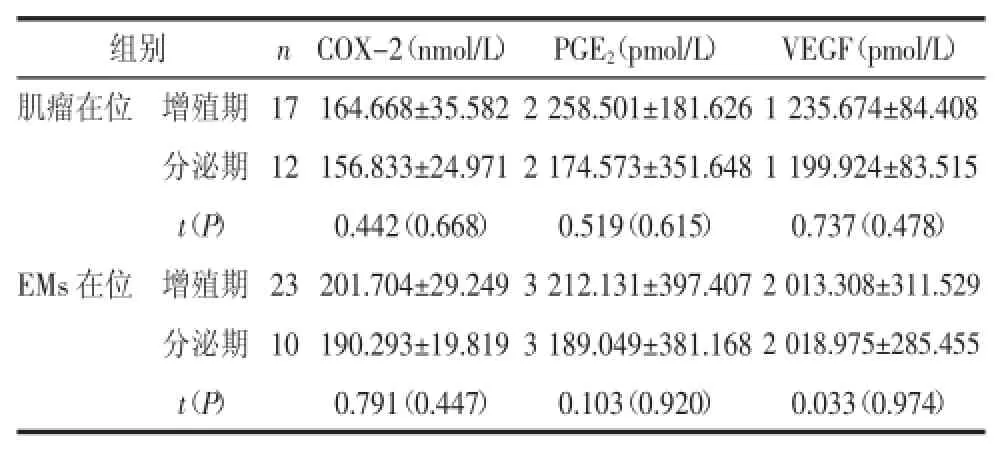
表2 增殖期、分泌期在位子宫内膜间质细胞COX-2、PGE2、VEGF浓度比较(±s)
组别 nCOX-2(nmol/L) PGE2(pmol/L) VEGF(pmol/L)肌瘤在位 增殖期 17 164.668±35.582 2 258.501±181.626 1 235.674±84.408分泌期 12 156.833±24.971 2 174.573±351.648 1 199.924±83.515 t(P) 0.442(0.668) 0.519(0.615) 0.737(0.478)EMs在位 增殖期 23 201.704±29.249 3 212.131±397.4072 013.308±311.529分泌期 10 190.293±19.819 3 189.049±381.1682 018.975±285.455 t(P) 0.791(0.447) 0.103(0.920) 0.033(0.974)
2.2.2在位及异位子宫内膜间质细胞EMs患者在位子宫内膜间质细胞COX-2、PGE2、VEGF浓度比肌瘤患者在位间质细胞高,差异有统计学意义(P<0.05);EMs患者异位子宫内膜间质细胞COX-2、PGE2、VEGF浓度高于肌瘤患者在位间质细胞,差异有统计学意义(P<0.01);EMs患者异位子宫内膜间质细胞COX-2、PGE2、VEGF浓度比EMs在位间质细胞高,差异有统计学意义(P<0.05)。见表3。
表3 在位及异位子宫内膜间质细胞COX-2、PGE2、VEGF浓度比较(±s)
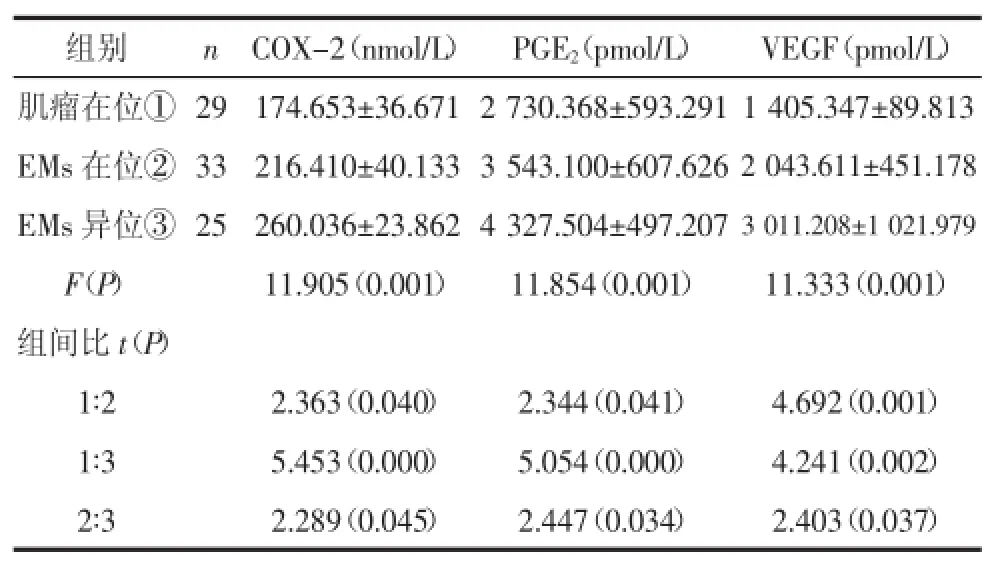
表3 在位及异位子宫内膜间质细胞COX-2、PGE2、VEGF浓度比较(±s)
组别 n COX-2(nmol/L) PGE2(pmol/L) VEGF(pmol/L)肌瘤在位① 29174.653±36.671 2 730.368±593.291 1 405.347±89.813 EMs在位② 33 216.410±40.133 3 543.100±607.6262 043.611±451.178 EMs异位③ 25 260.036±23.862 4 327.504±497.2073 011.208±1 021.979 F(P) 11.905(0.001) 11.854(0.001) 11.333(0.001)组间比t(P)1∶2 2.363(0.040) 2.344(0.041) 4.692(0.001)1∶3 5.453(0.000) 5.054(0.000) 4.241(0.002)2∶3 2.289(0.045) 2.447(0.034) 2.403(0.037)
2.3子宫内膜间质细胞COX-2、PGE2、VEGF的mRNA表达水平
2.3.1子宫内膜细胞总RNA提取结果所提取的细胞总RNA经紫外分光光度计测定:OD260/OD280介于1.8~2.0之间,1%琼脂糖凝胶电泳可见清晰的18 S和28 S两个条带,且2个条带的OD比值为28S/ 18S>2,所提取的总RNA纯度较高且较完整,无DNA、酚、蛋白的污染。见图2。
图2 RNA完整性琼脂糖凝胶电泳结果图
2.3.2半定量RT-PCR结果
2.3.2.1增殖期、分泌期在位子宫内膜间质细胞半定量RT-PCR电泳灰度值比较肌瘤患者的分泌期子宫内膜间质细胞COX-2、PGE2、VEGF的mRNA表达与其增殖期间质细胞比较差异均无统计学意义(P>0.05);EMs患者分泌期在位子宫内膜间质细胞COX-2、PGE2、VEGF mRNA表达与其增殖期间质细胞比较差异也均无统计学意义(P>0.05)。见图3、图4和表4。
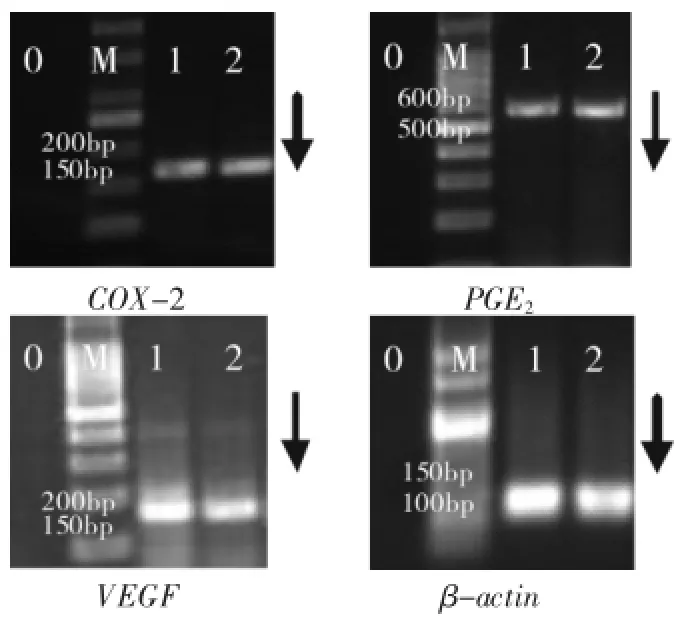
图3 子宫肌瘤在位子宫内膜间质细胞目的基因扩增产物电泳图

图4 EMs在位子宫内膜间质细胞目的基因扩增产物电泳图
表4 增殖期、分泌期在位子宫内膜间质细胞COX-2、PEG2、VEGF mRNA表达量比较(±s)
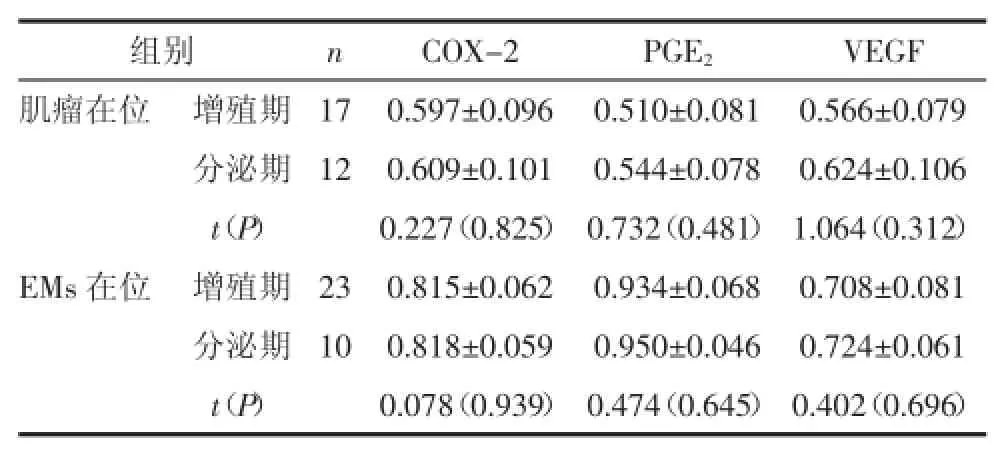
表4 增殖期、分泌期在位子宫内膜间质细胞COX-2、PEG2、VEGF mRNA表达量比较(±s)
组别 n COX-2 PGE2 VEGF肌瘤在位 增殖期 17 0.597±0.096 0.510±0.081 0.566±0.079分泌期 12 0.609±0.101 0.544±0.078 0.624±0.106 t(P) 0.227(0.825) 0.732(0.481) 1.064(0.312)EMs在位 增殖期 23 0.815±0.062 0.934±0.068 0.708±0.081分泌期 10 0.818±0.059 0.950±0.046 0.724±0.061 t(P) 0.078(0.939) 0.474(0.645) 0.402(0.696)
2.3.2.2在位及异位子宫内膜间质细胞半定量RTPCR电泳灰度值比较EMs患者在位子宫内膜间质细胞COX-2、PGE2、VEGF mRNA表达比肌瘤患者在位间质细胞高,差异有统计学意义(P<0.05或P<0.01);EMs患者异位子宫内膜间质细胞COX-2、PGE2、VEGF mRNA表达比肌瘤患者在位间质细胞高,差异有统计学意义(P<0.01);EMs患者异位子宫内膜间质细胞COX-2、PGE2、VEGF mRNA表达比在位间质细胞高,差异有统计学意义(P<0.05或P<0.01)。见图5和表5。
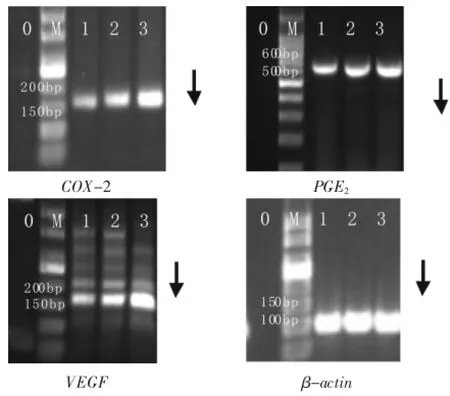
图5 各组子宫内膜间质细胞目的基因扩增产物电泳图
表5 各组子宫内膜间质细胞COX-2、PGE2、VEGF mRNA表达量比较(±s)
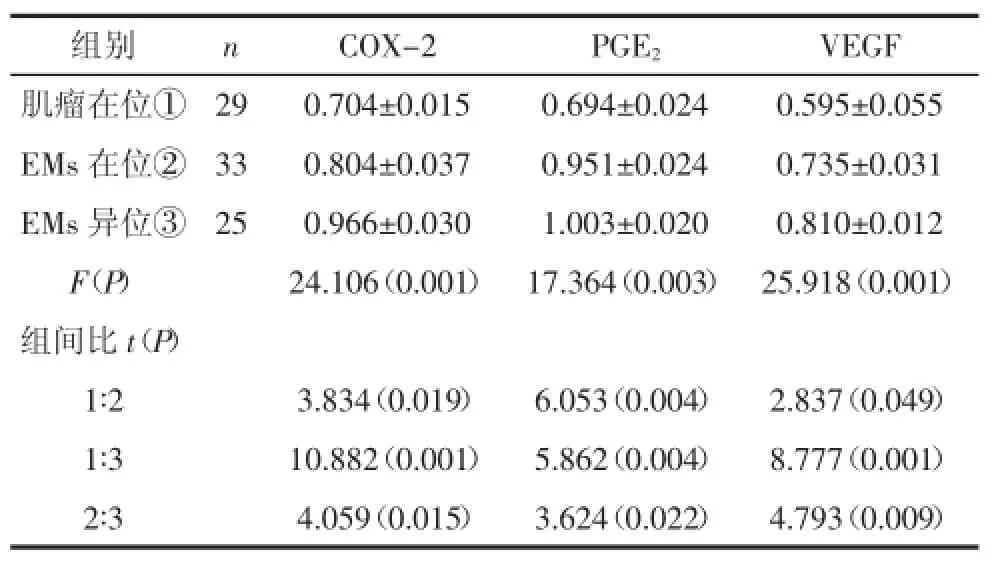
表5 各组子宫内膜间质细胞COX-2、PGE2、VEGF mRNA表达量比较(±s)
组别 n COX-2 PGE2 VEGF肌瘤在位① 29 0.704±0.015 0.694±0.024 0.595±0.055 EMs在位② 33 0.804±0.037 0.951±0.024 0.735±0.031 EMs异位③ 25 0.966±0.030 1.003±0.020 0.810±0.012 F(P) 24.106(0.001) 17.364(0.003) 25.918(0.001)组间比t(P)1∶2 3.834(0.019) 6.053(0.004) 2.837(0.049)1∶3 10.882(0.001) 5.862(0.004) 8.777(0.001)2∶3 4.059(0.015) 3.624(0.022) 4.793(0.009)
3 讨论
子宫内膜细胞主要包括子宫内膜腺上皮细胞和间质细胞,在EMs形成过程中腺上皮细胞参与异位病灶的生长,间质细胞参与异位病灶的黏附过程[7-8]。子宫内膜间质细胞的黏附作用是EMs形成的第一步[8],黏附后间质细胞负责诱导早期血管形成,提供血液供应,通过重组腺上皮细胞和间质细胞形成子宫内膜腺体而进一步促进异位病灶的生长[7]。因此,本研究以原代培养的子宫内膜间质细胞为对象,研究EMs中与血管生成相关的蛋白分泌及基因的表达。
COX-2是催化花生四烯酸转化为PGE2的诱导酶,在多数组织中不表达或表达很低,在细胞因子、内毒素、促炎因子、肿瘤刺激因子和某些激素刺激下迅速表达,与肠癌[9]、卵巢上皮性癌[10]、胃癌[11]、肺癌[12]等恶性肿瘤的发生、发展有关。COX-2在正常人子宫内膜腺体和血管内皮均有表达[13],可催化花生四烯酸合成PGH2,在PGE2合酶的作用下合成PGE2。在EMs发病中,PGE2参与调控细胞增殖、抗凋亡、免疫抑制和血管生成等病理生理过程[14]。研究表明伴有盆腔痛症状的EMs患者异位病灶COX-2、PGE2表达水平明显升高[15],EMs患者子宫内膜和盆腔微环境血管生成的潜能可影响异位病灶的形成。Brenner等[16]研究认为EMs患者盆腹腔内PGE2可能诱导VEGF的表达和细胞侵袭性的增加,从而有利于子宫内膜细胞发生黏附、血管形成和种植。EMs患者腹腔冲洗液PGE2、VEGF浓度明显升高[17-18],而腹腔冲洗液中包含炎性细胞因子、生长因子、类固醇激素、促血管生成因子、巨噬细胞、子宫内膜细胞和红细胞,因白细胞循环可产生和释放大量PGE2、VEGF[19],从而影响PGE2、VEGF测定的结果。因此,本研究以原代培养的子宫内膜间质细胞为研究对象,可代表患者体内细胞的特征,排除组织研究中间皮细胞、腺上皮细胞相关蛋白分泌和基因表达的影响。
本研究结果显示,子宫肌瘤和EMs患者增殖期在位子宫内膜分离培养的间质细胞COX-2、PGE2、VEGF蛋白分泌和mRNA表达与分泌期培养的间质细胞比较差异均无统计学意义,提示体外培养的子宫内膜间质细胞血管生成能力不受子宫内膜周期性变化的影响。郎景和教授关于EMs的发病提出了“在位内膜决定论”[20],即患者的在位内膜本身在黏附、种植、侵袭能力上要强于非EMs妇女的内膜,更易形成异位病灶。本研究结果显示,EMs患者在位子宫内膜间质细胞COX-2、PGE2、VEGF蛋白分泌和mRNA表达比子宫肌瘤患者均升高,提示EMs患者在位子宫内膜间质细胞生成血管能力强于子宫肌瘤患者,符合“在位内膜决定论”。有学者指出EMs患者在位的子宫内膜细胞要在盆腔内种植形成异位病灶,还要通过腹水、腹腔内细胞、腹膜外细胞基质这三道防线的筛选作用,最后留下最强的克隆细胞系在腹腔内种植形成异位病灶,因此提出子宫内膜异位病灶是“单克隆起源学说”[21]。本研究结果显示EMs患者异位病灶子宫内膜间质细胞COX-2、PGE2、VEGF蛋白分泌和mRNA表达比其在位内膜细胞均升高,提示异位子宫内膜细胞的功能有所改变,生成血管的能力强于在位内膜。“单克隆起源学说”可解释本研究所得到的EMs患者异位的子宫内膜间质细胞生成血管能力强于在位和子宫肌瘤患者子宫内膜间质细胞的结论。
[1]Taylor RN,Yu J,Torres PB,et al.Mechanistic and therapeutic implications of angiogenesis in endometriosis[J].Reprod Sci,2009,16(2):140-146.
[2]Healy DL,Rogers PA,Hii L,et al.Angiogenesis:a new theory for endometriosis[J].Hum Reprod Update,1998,4(5):736-740.
[3]Mueller MD,Vigne JL,Minchenko A,et al.Regulation of vascular endothelial growth factor(VEGF)gene transcription by estrogen receptors alpha and beta[J].Proc Natl Acad Sci USA,2000,97 (20):10972-10977.
[4]Uefuji K,Ichikura T,Moehizuki H.Cyelooxygenase-2 expression is related to prostaglandin biosynthesis and angiogenesis in human gastric cancer[J].Clin Cancer Res,2000,6(1):135-138.
[5]Tsuno A,Nasu K,Kawano Y,et al.Fasudil inhibits the proliferation and contractility and induces cell cycle arrest and apoptosis of human endometriotic stromal cells:a promising agent for the treatment of endometriosis[J].J Clin Endocrinol Metab,2011,96 (12):E1944-E1952.
[6]Beliard A,Noël A,Goffin F,et al.Role of endocrine status and cell type in adhesion of human endometrial cells to the peritoneum in nude mice[J].Fertil Steril,2002,78(5):973-978.
[7]Nisolle M,Casanas-Roux F,Donnez J.Early-stage endometriosis:adhesion and growth of human menstrual endometrium in nude mice[J].Fertil Steril,2000,74(2):306-312.
[8]Witz CA,Monotoya-Rodriguez IA,Schenken RS.Whole explants of peritoneumandendometrium:anovelmodeloftheearly endometriosis lesion[J].Fertil Steril,1999,71(1):56-60.
[9]Peng Q,Yang S,Lao X,et al.Meta-analysis of the association between COX-2 polymorphisms and risk of colorectal cancer based on casecontrol studies[J].PLoS One,2014,9(4):e94790.
[10]Agachan Cakmakoglu B,Attar R,Kahraman OT,et al.Cyclooxygenase-2 gene and epithelial ovarian carcinoma risk[J].Mol Biol Rep,2011,38(5):3481-3486.
[11]Yan WF,Sun PC,Nie CF,et al.Cyclooxygenase-2 polymorphisms were associated with the risk of gastric cancer:evidence from a meta-analysis based on case-control studies[J].Tumour Biol,2013,34(6):3323-3330.
[12]Coskunpinar E,Eraltan IY,Turna A,et al.Cyclooxygenase-2 gene and lung carcinoma risk[J].Med Oncol,2011,28(4):1436-1440.
[13]Jones RL,Kelly RW,Critchley HO.Chemokine and cyclooxygenase-2 expression in human endometrium coincides with leukocyte accumulation[J].Hum Reprod,1997,12(6):1300-1306.
[14]Wu MH,Lu CW,Chuang PC,et al.Prostaglandin E2:the master of endometriosis?[J].Exp Biol Med(Maywood),2010,235(6):668-677.
[15]Khan KN,Kitajima M,Fujishita A,et al.Pelvic pain in women with ovarian endometrioma is mostly associated with coexisting peritoneal lesions[J].Hum Reprod,2013,28(1):109-118.
[16]Brenner RM,Nayak NR,Slayden OD,et al.Premenstrual and menstrual changes in the maeaque and human endometrium:relevance to endometriosis[J].Ann N Y Acad Sci,2002,955:60-74.
[17]Khan KN,Kitajima M,Yamaguchi N,et al.Role of prostaglandin E2 in bacterial growth in women with endometriosis[J].Hum Reprod,2012,27(12):3417-3424.
[18]Bourlev V,Iljasova N,Adamyan L,et al.Signs of reduced angiogenic activity after surgical removal of deeply infiltrating endometriosis[J].Fertil Steril,2010,94(1):52-57.
[19]McLaren J,Prentice A,Charnock-Jones DS,et al.Vascular endothelial growth factor is produced by peritoneal fluid macrophages in endometriosis and is regulated by ovarian steroids[J].J Clin Invest,1996,98(2):482-489.
[20]郎景和.子宫内膜异位症的研究与设想[J].中华妇产科杂志,2003,38(8):478-480.
[21]Varma R,Rollason T,Gupta JK,et al.Endometriosis and the neoplastic process[J].Reproduction,2004,127(3):293-304.
Study of Angiogenesis Ability of Endometrial Stromal Cells in Endometriosis
SU Xiao-hua,SONG Dian-rong,ZHANG Ying,ZHANG Wei,GUO Jie,WANG Ya-nan,ZHAO Lin.
Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China(SU Xiao-hua);The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine,Tianjin 300150,China(SONG Dian-rong,ZHANG Wei,GUO Jie,WANG Ya-nan,ZHAO Lin);Tianjin Medical University,Tianjin 300070,China(ZHANG Ying)
SONG Dian-rong,E-mail:songdr58@126.com
Objective:To study of the secretion and expression of COX-2,PGE2and VEGF in endometrial stromal cells of patients with EMs.Methods:Ectopic endometrial tissues of EMs and eutopic endometrial tissues of patients with EMs or uterine fibroids were collected,then cultured endometrial cells by the methods of original digestion,the purified endometrial stromal cells were used for research,the secretion of COX-2,PGE2and VEGF proteins were tested by ELISA,and the expression of COX-2,PGE2and VEGF mRNA were detected by RT-PCR.Results:There were no statistically significant differences of the expression of COX-2,PGE2and VEGF proteins and mRNA between the stage of secretion and proliferation in eutopic endometrial stromal cells in patients with EMs or uterine fibroid(P>0.05).The expression of COX-2,PGE2and VEGF proteins and mRNA were significantly increased in eutopic and ectopic endometrial stromal cells of EMs compared with patients with uterine fibroid,the difference was statistically significant(P<0.05 or P<0.01).The expression of COX-2,PGE2and VEGF proteins and mRNA in ectopic endometrial stromal cells were obviously higher than that in eutopic endometrial stromal cells of EMs,the difference was statistically significant(P<0.05 or P<0.01).Conclusions:The protein secretion and mRNA expression of COX-2,PGE2and VEGF in eutopic and ectopic endometrial stromal cells were all increased and it showed that the ectopic cells increased more obviously.It indicated that the angiogenesis ability of ectopic endometrial stromal cells was stronger in the pathogenesis of EMs.
Endometriosis;Stromal cells;Cyclooxygenase 2;Prostaglandin E2;Vascular endothelial browth factors
2014-08-03)
[本文编辑秦娟]
国家自然科学基金(81102613)
300193天津中医药大学(苏晓华);天津中医药大学第二附属医院(宋殿荣,张崴,郭洁,王雅楠,赵琳);天津医科大学(张英)
宋殿荣,E-mail:songdr58@126.com
