水体中邻苯二甲酸酯类的光催化降解研究进展
2015-10-11谷传涛王春英
谷传涛,王春英,b
(江西理工大学,a.江西省矿冶环境污染控制重点实验室;b.江西省矿业工程重点实验室,江西 赣州341000)
水体中邻苯二甲酸酯类的光催化降解研究进展
谷传涛a,王春英a,b
(江西理工大学,a.江西省矿冶环境污染控制重点实验室;b.江西省矿业工程重点实验室,江西 赣州341000)
邻苯二甲酸酯类(PAEs)作为塑料的改性添加剂在塑化剂市场中占主导地位且在水环境中大量检出,对水生生物及人类健康存在潜在的威胁.光催化氧化技术对水体中PAEs的降解有着重要的作用,文章综述了光照时间、光照强度、催化剂投加量、PAEs初始浓度、反应溶液pH及添加剂等因素对PAEs的光催化降解的影响,阐述了PAEs的光催化降解动力学及其光催化降解机理,同时探讨了光催化氧化降解PAEs的趋势.
邻苯二甲酸酯;光催化降解;降解动力学;降解机理
0 前 言
邻苯二甲酸酯类(又称酞酸酯,简称PAEs)化合物作为塑料的改性添加剂在增塑剂市场中占主导地位,目前世界年产量高达 430万吨之多[1]. PAEs约有30多种,常见的有邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二正丁酯(DBP)、邻苯二甲酸二正辛酯(DOP)、邻苯二甲酸二己酯(DEHP)及邻苯二甲酸丁基苄酯(BBP)等[2](其物理化学性质见表1).
PAEs的大量使用导致其在水体中广泛存在:首先来自生产和使用PAEs工厂的废水;其次,农用塑料薄膜、驱虫剂以及塑料垃圾等经雨水淋洗、土壤浸润等过程使PAEs进入水体,且溶出速率以及总量与温度有很大的关系[4];再次,该类物质在排入大气后,通过干、湿沉降转入水环境.PAEs的蒸汽压较低,属于难挥发物质,进入水环境后很难向大气环境迁移,而主要是在水体中发生相应的迁移转化[5].在水中,它们以溶解状态存在,或吸附于悬浮物的表面,或转移至沉积物中,十分稳定,不易分解,易引起二次污染;剧烈搅拌和表面活性剂的存在,可促使PAEs的水溶解度增加.目前国内外水体中都有PAEs的检出:北美和欧洲的大部分国家在工业废水、生活污水和地表水中均检测到PAEs[6-7];日本同时对全国25个自来水厂中的内分泌干扰物进行了检测,调查亦表明水厂中存在PAEs[8];Oh等报道称PAEs为流经韩国首尔汉江的主要微污染物(约占53.4%)[9];我国的长江、黄河及其他主要水体中也都有PAEs的检出[10-11],丁国武等在黄河兰州段中对DBP的检出率为100%,检出浓度为1.48~13.89 μg/L[12],陆继龙等在第二松花江中下游水体中检出的DMP浓度高达102.77 μg/L[13].

表1 常见PAEs的物理化学参数[3]
水体中的PAEs对水生生物以及人类健康的危害是不可小觑的.PAEs对浮游植物有直接的损害作用,例如DBP对斜生栅藻及天然混合藻类生长具有抑制作用[14].PAEs的雌激素效应还可能导致生物体的生殖系统发育异常、生殖功能障碍、生殖系统与内分泌系统肿瘤以及神经系统发育和功能损伤[15-16],研究发现在人类或动物体内有180种基因/蛋白质与DEHP相关[17].PAEs引起的环境污染及毒理效应已受到全球性关注,目前已被认定为“第二个全球性PCB污染物”和典型的内分泌干扰物.美国环境保护署、欧盟和中国环境监测总站已将一些PAEs列入 “优先控制污染物名单”(例如DMP、DEP、DBP、DEHP、BBP等)[18-20].
鉴于PAEs在水体中的广泛存在,且严重威胁到水生生物和人类的健康,寻找合理有效的去除技术势在必行.水体中部分PAEs可以通过水解、光降解以及生物降解等自然降解过程去除[21],但是这些过程所需周期长,而且降解不彻底,无法达到相关的水质要求,从而需要寻求更为有效的人工去除手段.其人工去除方法主要包括物理吸附、生物去除以及化学降解法.物理吸附是比较传统的污染物去除方法,常用的吸附材料有活性碳、壳聚糖、碳纳米管等[3,22];但吸附材料不易回收利用,且存在二次污染.生物降解PAEs的效果受处理工艺类型、水力停留时间、温度及降解菌群等多种因素的影响[23-26],反应周期比较长,无法完成PAEs污染水体的快速处理.化学降解法有多种,其中纳米光催化氧化技术作为一种极具潜力的水处理技术,已受到广泛的关注.这种技术能够较为有效地降解水中多种有机污染物,而且具有降解速度快、应用范围广等特点.研究证明光催化氧化技术对水体中的PAEs具有很好的去除效果[27-28].
1 水体中PAEs的光催化降解
1.1 光 解
水环境中PAEs的光解过程主要是通过吸收290~400 nm的紫外光进行,在自然环境下,辐射到地面的这部分紫外光含量很低,而长波又缺乏足够的能量来打破共价键,故在天然水体中,PAEs都有很长的半衰期,而且矿化程度低[21].Ma等直接用350 W氙灯模拟太阳光降解DEP,45 min后,DEP浓度基本没有变化[29];Wang等通过对 300 W 氙灯加装400 nm滤光片模拟可见光降解BBP,300 min后,BBP浓度也未发现明显的变化[30].有人研究了在单独的紫外光辐射下,PAEs的降解情况:施银桃等研究了125 W高压汞灯的辐照对DMP的降解,照射60 min后,DMP的去除率不超过2%[31];周宇翔等研究了200W高压汞灯的辐照对DBP的降解,60 min后,DBP的去除率为3.8%[32];费学宁等用100 W高压汞灯辐照BBP,360 min后,BBP浓度变化很小,其降解率小于16%[33].可见,PAEs在单独的紫外光辐射下去除率仍然很低,可能是由于PAEs对290~400 nm波段的紫外光达不到有效的吸收或转化.
1.2 光催化降解
光催化剂的使用,大大提高了水体环境中PAEs的去除率.研究最多的是在紫外光辐射下,以TiO2为基体光催化剂对PAEs的降解[27,34-40].以高压汞灯为光源,在光照强度为80×103lx的条件下,无催化剂加入,13 h后DEP的光降解率还不到18%;在暗反应条件下,加入TiO2催化剂,13 h后DEP的去除率不足17%,而去除的17%的DEP则可以认为大部分被催化剂所吸附;在紫外灯照射和催化剂TiO2共存的条件下,反应4 h后DEP的降解率为 92%[41],即证明只有光源和催化剂协同作用时,水中的DEP才会被较快的降解.光催化技术与其他氧化技术的联合使用又可以进一步提高水体中PAEs的去除率,比如在UV/TiO2体系中加入助氧化剂双氧水(H2O2),所构成的UV/TiO2/H2O2体系对DBP的光降解能力远大于UV/TiO2和UV/H2O2体系,H2O2的加入显著提高了TiO2对DBP的光催化活性[42];Jing等[38]的研究发现:O3的加入也大大提高了UV/TiO2体系对DMP的去除率;Liao等[43-45]研究了微波辅助TiO2在紫外光照射下对DMP的降解,发现微波和TiO2在紫外辐照下具有协同作用; Sharma和Yuan等[46-47]在其研究中指出FeO42-的引入可以有效提高TiO2在紫外辐照下对DMP和DBP的去除效果.
在PAEs光催化降解过程中,绝大部分光催化体系的光源均以紫外光辐射为主,PAEs的可见光催化降解研究的较少.这主要是由于大部分光催化体系中均以TiO2为基体光催化剂,而TiO2的禁带宽度为3.2eV,仅能吸收波长小于387.5 nm的紫外光,因而大大限制了TiO2对太阳光的利用[48-50].近年来,可见光催化剂的研究是一大热点,主要是通过对TiO2进行改性或者制备新型的可见光催化剂[51-52].李岩和 Xu等[53-55]都研究了通过对TiO2掺杂多酸(H3PW12O40)来提高其可见光活性,并通过实验证明在模拟太阳光的条件下,H3PW12O40/TiO2对DMP、DBP、DEP均有较好的降解效果,因而证实了PAEs在可见光辐射下通过添加适当的催化剂也是可以被快速去除的.
2 影响PAEs光催化降解效率的因素
在PAEs的光催化降解体系中,除了光源和催化剂类型对PAEs的去除率有很大影响外,反应时间、光源的强度、催化剂的投加量、PAEs溶液的初始浓度、反应溶液的pH值、以及降解体系中所存在的阴阳离子和有机物都会影响PAEs的去除效果.
2.1 光照时间的影响
一般情况下,随着光照时间的延长,PAEs的去除率会越来越高,但是降解速率却会逐渐下降.这主要是由于在光照开始时,降解体系中的PAEs浓度比较高,有较多的PAEs分子吸附在催化剂表面,有利于和氧化性物质或者自由基接触;随着PAEs逐步被催化降解,吸附在催化剂上的PAEs分子相应减少,与自由基接触的机会也降低,另外,反应一段时间后,生成的一些有机中间产物也会与PAEs争夺活性位点,并被进一步降解,使PAEs的降解速率降低[35,37,53].
2.2 光照强度的影响
光照强度是影响PAEs氧化降解的另一个重要因素:Xu等[56]通过研究发现,在21.2~133.9 μW/cm2的紫外光强范围内,DMP的降解速率与光强呈线性关系(kapp=6.98×10-4I0,R2=0.987),即DMP的去除率随着光强的增加而增加,这主要是由于光强度越高,催化剂吸收光子的机会越大,从而产生更多的活性自由基,因而提高DMP的去除率,Chen等[57]的研究也指出存在随着光强增大,DMP降解率增大的规律.
2.3 催化剂投加量的影响
一般情况下催化剂的投加量存在一个最佳值,但不同的反应体系,最佳值的大小不同,比如在吴楚萍等以TiO2/沸石为催化剂降解DMP的研究中,DMP的浓度固定在20 mg/L时,催化剂最佳投加量为40 g/L[35];在50 mg/L的DBP溶液中,可见光辐照下,催化剂H3PW12O40/TiO2的最佳投加量为2 g/L[53];在景伟文等[58]以Ag/TiO2为催化剂降解DMP的研究中,当DMP浓度为10 mg/L时,催化剂的投加量为0.3 g/L时DMP的降解效果最好.
催化剂的投加量较小时,溶液中分布的催化剂的活性位点比较少,PAEs的降解率不高.当催化剂的投加量逐渐增加,溶液中分布的催化剂的活性位点增加,因此提高了PAEs的降解率.当催化剂的投加量增加到一定值后,进入悬浮液中可被吸收的光子已全部被催化剂吸收,致使催化剂表面产生的活性基团数目基本保持恒定,进一步加大催化剂的投加量不但造成光散射,而且溶液的浑浊度增加,反而阻碍了紫外光源的有效照射,造成光的吸收效率下降,反应活性不佳[58].
2.4 PAEs初始浓度的影响
陈德强等[42]以UV/TiO2薄膜为体系光催化降解酞酸酯DBP,初始浓度从10 mg/L增大到25 mg/L,DBP降解速率下降,各个初始浓度对应的一级动力学常数见表 2.景伟文[59]、洪春苗等[60]对 DOP、DMP的光催化降解研究也有类似规律:即在其他条件不变的情况下,PAEs浓度越低,其降解率越高.这是因为PAEs达到一定浓度,催化剂表面的活性位被占满,PAEs浓度增加将不会增加吸附在催化剂表面污染物浓度,导致PAEs降解率降低.
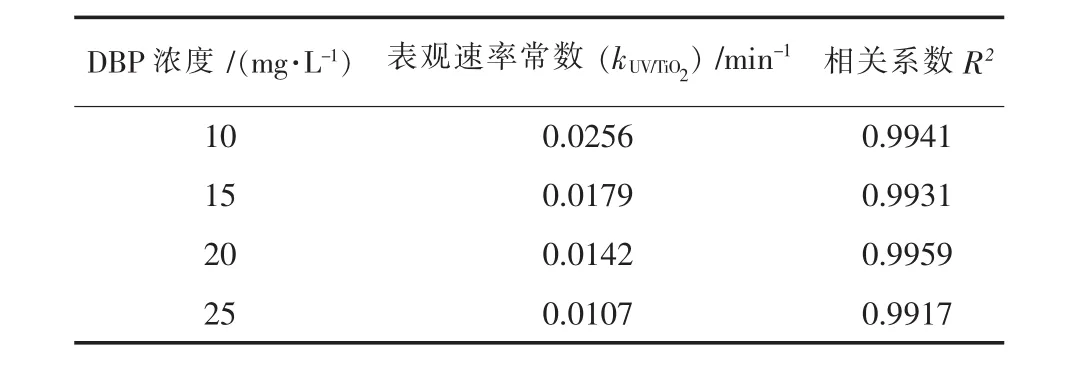
表2 不同DBP初始浓度下的一级反应动力学常数
2.5 反应溶液pH的影响
反应体系的pH值是影响有机物光催化降解的重要因素.大部分相关研究表明在以TiO2为基体的光催化反应体系中,PAEs降解的最佳pH值范围为6~8[37,59-62],即酸性或者碱性均不利于PAEs的光催化降解.这主要是由于TiO2的等电点为6.2~7.5,在pH低于TiO2的等电点时,TiO2的表面带正电荷,接受光辐射后,产生的光生电子容易与其发生中和,从而降低了羟基自由基(·OH)的产生量,故被降解的PAEs的量比较低;而当pH高于TiO2的等电点时,TiO2的表面带负电荷,因为存在大量的OH-,产生·OH的量也大大增加,但是在碱性条件下,容易吸收空气中的CO2而生成HCO3-和CO32-,进而抑制了PAEs的降解.
2.6 添加剂的影响
郑勋超等[34]在模拟二沉池出水阴离子种类及浓度的溶液中,初始浓度为5 mg/L的DMP在经过120 min的光催化反应之后,降解效率只有51.4%,远低于DMP在蒸馏水中93.2%的降解率.Xu等[56]研究的更为详细,在以邻苯二甲酸苄基丁基酯(BBP)为目标污染物、以TiO2为催化剂的的研究中,有些阴离子比如BrO3-,ClO4-和Cr2O72-促进了BBP的降解,但是另外一些水体中常见的阴离子PO43-、CO32-、NO3-、SO42-和Cl-却抑制了BBP的降解;而水体中常见的阳离子K+、Na+、Mg2+和Ca2+的引入也对BBP的降解产生抑制作用;另外,其他有机物丙酮和甲醇的存在也降低了BBP的去除效果.
3 PAEs的光催化降解动力学
PAEs的光降解过程符合一级动力学方程[37,41,53,62-63].胡晓宇等[37]用UV-TiO2-H2O2光催化氧化体系研究了5种PAEs(DMP、DEP、DBP、DEHP和DOP)的光催化降解.结果证明5种PAEs的光降解过程均符合一级动力学方程,5种PAEs的降解顺序为DOP>DEHP>DBP>DEP>DMP[37],并表明PAEs的光催化降解速率随烷基链含碳数的增加而增加,且对支链的降解能力优于直链.Hizal等[64]认为,这是由于随着烷基链长度的增加,酞酸酯对紫外光的稳定性下降造成的.李岩等[53]通过vis/H3PW12O40/TiO2光催化体系对DOP、DBP和DMP的研究也得出类似规律:3种邻苯二甲酸酯类有机物降解率由大到小的顺序为:DOP>DBP>DMP,即随着烷基链长度的增加,PAEs的光催化降解速率增大.PW12/TiO2在模拟太阳光条件下降解DMP,DEP,DBP[54],PAEs的降解率随着链长而增加.同样是降解DMP、DEP和DBP,吴楚萍等的研究[63]却有不同的结果:DMP、DBP、DEP 3种物质的降解速率都符合一级动力学方程,在相同浓度下其半衰期由大至小为DEP>DMP>DBP.而这3种物质支链中碳原子数目由大至小为DBP>DEP>DMP,即降解的速率并不是随着碳链的增长呈线性变化,并推测这可能与它们的降解历程不同相关,即·OH进攻碳链的部位不同有关,·OH主要是由支链开始进攻DBP,而对DEP、DMP则从苯环开始进攻.因而,研究PAEs的降解机理,对于环境中PAEs的去除有重要的指导意义.
4 PAEs的光催化降解机理

图1 PAEs的降解历程
初人合等利用自制装置,以TiO2为光催化剂,研究了3种酞酸酯类化合物DBP、DEP和DMP的光催化降解情况,最后通过 GC-MS法检测出中间产物并首次讨论了酞酸酯类化合物可能的降解途径[65].TiO2半导体接受光子辐照后,产生光生电子和空穴.空穴具有氧化性,与TiO2表面吸附的OH-反应生成活性物质·OH,酞酸酯在光生电子和·OH作用下生成物质A和酞酸单酯 (见图1).物质A在酸性环境作用下经由物质B变成邻苯二甲酸酐,而酞酸单酯继续脱酯生成邻苯二甲酸,最终两者都被氧化成二氧化碳和水,即PAEs类物质在TiO2和紫外光照的作用下从侧链开始降解.这一结论得到了国内学者费学宁[33]、刘芃岩[66]及国外学者Hizal[64]等的支持,他们经研究也证实了PAEs在以TiO2为催化剂的光化学反应中从侧链开始降解.
Yuan等[67]在UV/TiO2体系中加入氧化剂O2或者高铁酸盐(Fe(VI)),在降解DMP的过程中发现,加入不同的氧化剂后,DMP的降解机理不同;在UV/TiO2/O2体系中,·OH首先攻击DMP的苯环生成DMP的羟基化产物,并解释说在PAEs的烷基链中的碳数<3时,以对苯环的攻击为主开始降解;在UV/TiO2/Fe(VI)体系中,Fe(VI)作为电子接受体,容易得电子转化为铁氧中间体自由基(FeV=O↔FeIV-O·),铁氧中间体更倾向于攻击烷基链促使其降解[68],而当Fe(VI)消耗殆尽后,体系中生成的· OH也是以攻击烷基链为主.
Ding等将TiO2负载在高岭土上,然后在紫外光照射下对DMP进行光催化降解,通过气质分析鉴定出12种降解中间产物,并详细推断了DMP可能经历的两个降解途径[69].途径一:首先由·OH攻击DMP的苯环产生羟基化DMP产物;另一个·OH攻击甲基化DMP苯环的不同位置去除一个甲酸甲酯基团而生成3种二羟甲基苯甲酸酯(2,3-二羟甲基苯甲酸酯、2,4-二羟甲基苯甲酸酯、2,6-二羟甲基苯甲酸酯),也可能是由两个·OH攻击产物苯甲酸甲酯而生成;3种二羟基苯甲酸酯经进一步氧化分别生成2,3-丁二醇、1,2-丙二醇和乙二醇,最终被氧化为CO2和H2O.途径二:DMP吸收光后,连接苯环和COOCH3的C-C键发生裂解,从而得到产物苯甲酸甲酯;苯甲酸甲酯经过酯基β位的断裂丢失·CH3得到产物苯甲酸;·CH3和·OH接着攻击苯甲酸的苯环生成2,3-二甲基苯甲酸和2-羟基苯甲酸;2,3-二甲基苯甲酸经过进一步的降解最终转化为CO2和H2O,而2-羟基苯甲酸首先开环生成2-羟基-3-甲基丁酸,然后被氧化为CO2和H2O.
由此可知,基体催化剂(TiO2)相同,在不同条件下光催化降解PAEs的历程不同,但在以TiO2为基体催化剂的光催化反应中,·OH是主要的氧化物种,在降解过程中起主要作用.那么在以非TiO2为基体的光催化反应中,·OH是否依然为主要的氧化物种?PAEs的降解是从苯环开始还是从侧链开始?目前还未见详细报道.
5 总结与展望
1)水体中PAEs的光催化氧化降解受到光照时间、光照强度、催化剂投加量、PAEs的初始浓度、反应时间以及外加添加剂等因素的影响,且反应过程符合一级动力学方程.然而,PAEs的光催化降解是从烷基链开始还是从苯环开始,目前尚没有统一的结论.因此,有关降解机理的研究需进一步完善.
2)前期PAEs的光催化降解研究主要集中在两点上:紫外光辐射和以TiO2为基体催化剂.在太阳能辐射中,紫外光辐射所占比例小,仅占4%左右.为充分利用丰富的太阳能资源,应开发具有可见光响应的催化剂.
3)目前的光催化降解反应器均以实验室模拟为主,工程应用比较少,开发能够工程应用的降解装置是研究光催化氧化技术的一个必然趋势.另外,鉴于光催化技术与其他技术(吸附或者氧化降解等)的联合使用可以提高水体中PAEs的去除率,对其联合降解的过程及其机理应深入研究.
[1]Lin C,Lee C J,Mao W M,et al.Identifying the potential sources of di-(2-ethylhexyl)phthalate contamination in the sediment of the Houjing River in southern Taiwan[J].Journal of Hazardous Materials,2009,161(1):270-275.
[2]Blount B C,Milgram K E,Silva M J,et al.Quantitative detection of eight phthalate metabolites in human urine using HPLC-APCIMS/MS[J].Analytical chemistry,2000,72(17):4127-4134.
[3]Julinová M,Slavík R.Removal of phthalates from aqueous solution by different adsorbents:A short review[J].Journal of Environmental Management,2012,94(1):13-24.
[4]李海涛,黄岁樑.水环境中邻苯二甲酸酯的迁移转化研究[J].环境污染与防治,2006,28(11):853-858.
[5]徐红燕,周仕林,陶红,等.废水中邻苯二甲酸酯降解的研究进展[J].上海理工大学学报,2010,32(5):418-422.
[6]Harries J E,Janbakhsh A,Jobling S,et al.Estrogenic potency of effluent from two sewage treatment works in the United Kingdom[J].Environmental Toxicology and Chemistry,1999,18(5): 932-937.
[7]Clara M,Windhofer G,Weilgony P,et al.Identification of relevant micropollutantsin Austrian municipalwastewaterand their behaviour during wastewater treatment[J].Chemosphere,2012,87 (11):1265-1272.
[8]日本厚生省.自来水中内分泌干扰物质的暴露及其行为研究报告书[R].1998-2000.
[9]Oh B S,Jung Y J,Oh Y J,et al.Application of ozone,UV and ozone/UV processes to reduce diethyl phthalate and its estrogenic activity[J].Science of the total environment,2006,367(2/3):681-693.
[10]胡雄星,韩中豪,周亚康,等.黄浦江表层水体中邻苯二甲酸酯的分布特征及风险评价[J].环境化学,2007,26(2):258-259.
[11]张彦鹏,周爱国,刘存富,等.长江流域武汉段水体中邻苯二甲酸酯含量研究[J].环境科学与技术,2011,34(11):130-134.
[12]丁国武,魏延萍,牛静萍,等.黄河兰州段水体中有机污染物对MCF-7细胞凋亡的影响及其机制[J].兰州大学学报(自然科学版),2012,48(2):90-96.
[13]陆继龙,郝立波,王春珍,等.第二松花江中下游水体邻苯二甲酸酯分布特征[J].环境科学与技术,2007,30(12):35-37.
[14]况琪军,赵文玉,邓萍.DBP对斜生栅藻及天然混合藻类致毒效应研究[J].水生生物学报,2003,27(1):103-105.
[15]沈霞红,李冬梅,韩晓冬.邻苯二甲酸酯类胚胎生殖毒性研究进展[J].中国公共卫生,2010,26(9):1215-1216.
[16]杨章萍,金铨,周标,等.性早熟女童血清中环境内分泌干扰物水平研究[J].环境与职业医学,2014,31(5):331-335.
[17]Singh S,Li S S L.Phthalates:toxicogenomics and inferred human diseases[J].Genomics,2011,97(3):148-157.
[18]EPA U,Code of federal regulations,in:USEPA (Ed.),Part 136,1992.
[19]EPA U,National Primary DrinkingWater Regulations,in:F. Register(Ed.),40 CFR Chapter I,Part 141,US Environmental Protection Agency,Washington,DC,1991.
[20]Union E,evaluation and control of the risks of existing substances,in:European Union(Ed.),793/93,Brussels,1993.
[21]郑和辉,钱城.邻苯二甲酸酯降解状况研究进展[J].中国公共卫生,2006,22(2):228-230.
[22]周震峰,张海光,王茜.生物炭对邻苯二甲酸二甲酯在土壤中自然降解和吸附行为的影响[J].环境工程学报,2014,8(10): 4474-4479.
[23]王建龙,钱易.邻苯二甲酸酯的生物降解研究[J].环境科学,1995,16(6):26-28.
[24]夏凤毅,郑平,周琪,等.邻苯二甲酸酯化合物生物降解性与其化学结构的相关性 [J].浙江大学学报 (农业与生命科学版),2004,30(2):141-146.
[25]李会茹,曾锋,崔昆燕.Pseudomonas fluorescens Z1999降解邻苯二甲酸酯的二级动力学特征[J].环境化学,2005,24(2):189-192.
[26]He Z,Xiao H,Tang L,et al.Biodegradation of di-n-butyl phthalate by a stable bacterial consortium,HD-1,enriched from activated sludge[J].Bioresource Technology,2013,128:526-532.
[27]Jiang W,Joens J A,Dionysiou D D,et al.Optimization of photocatalytic performance of TiO2coated glass microspheres using response surface methodology and the application for degradation of dimethyl phthalate[J].Journal of Photochemistry and Photobiology A:Chemistry,2013,262:7-13.
[28]银洲,张建强.二氧化钛光催化降解环境内分泌干扰物技术的研究进展[J].水处理技术,2013,39(1):24-28.
[29]Ma F,Zhang S,Yang X,et al.Fabrication of metallic platinum and indium oxide codoped titania nanotubes for the simulated sunlightphotocatalytic degradation ofdiethylphthalate[J]. Catalysis Communications,2012,24:75-79.
[30]Wang X K,Wang C,Jiang W Q,et al.Sonochemical synthesis and characterization of Cl-doped TiO2and its application in the photodegradation of phthalate ester under visible light irradiation [J].Chemical Engineering Journal,2012,189:288-294.
[31]施银桃,李海燕,曾庆福.UV/O3氧化邻苯二甲酸二甲酯溶液研究[J].武汉科技学院学报,2003,16(2):56-59.
[32]周宇翔.源水中环境激素—邻苯二甲酸酯类的降解研究[D].南京:南京理工大学,2007.
[33]费学宁,吕岩,张天永.几种环境激素酞酸酯的光催化降解研究[J].环境化学,2006,25(5):567-571.
[34]郑勋超.Ag-TiO2/浮石对二沉池出水深度处理的研究[D].广州:暨南大学,2009.
[35]Wu C P,Pinhe Y I N,Ling Z,et al.Photodegradation of dimethyl phthalate in water using TiO2/pumice[J].Ecology and Environmental Sciences,2009,18(4):1223-1226.
[36]王灵.纳米TiO2光催化氧化难降解有机物研究[D].扬州:扬州大学,2010.
[37]胡晓宇,张克荣,郑波,等.水体中邻苯二甲酸酯光降解研究[J].四川大学学报(医学版),2003,34(2):300-302,305.
[38]Jing Y,Li L,Zhang Q,et al.Photocatalytic ozonation of dimethyl phthalate with TiO2prepared by a hydrothermal method[J]. Journal of Hazardous Materials,2011,189(1/2):40-47.
[39]Huang Z,Wu P,Lu Y,et al.Enhancement of photocatalytic degradation of dimethyl phthalate with nano-TiO2immobilized onto hydrophobic layered double hydroxides:A mechanism study [J].Journal of Hazardous Materials,2013,246:70-78.
[40]程沧沧,付洁媛,岳茜,等.TiO2薄膜光催化降解邻苯二甲酸乙酯的研究[J].环境科学与技术,2005,28(4):39-41,117.
[41]王硕.光催化降解酞酸酯的研究[J].天津建设科技,2009(4):50-52.
[42]陈德强,吴振斌,成水平,等.UV/TiO2薄膜体系光降解酞酸酯研究[J].环境污染治理技术与设备,2005,6(11):15-18.
[43]Liao W,Zheng T,Wang P,et al.Efficient microwave-assisted photocatalytic degradation ofendocrine disruptor dimethyl phthalate over composite catalyst ZrO (x)/ZnO [J].Journal of Environmental Sciences-China,2010,22(11):1800-1806.
[44]Liao W,Wang P.Microwave-assisted photocatalytic degradation of dimethyl phthalate using a microwave discharged electrodeless lamp[J].Journal of the Brazilian Chemical Society,2009,20(5): 866-872.
[45]LiaoW,ZhengT,WangP,etal.Microwave-assisted photocatalytic degradation of dimethyl phthalate over a novel ZrO(x)catalyst[J].Environmental Engineering Science,2010,27 (12):1001-1007.
[46]Sharma V K,Graham N J D,Li X Z,et al.Ferrate(VI)enhanced photocatalytic oxidation of pollutants in aqueous TiO2suspensions[J].Environmental Science and Pollution Research,2010,17(2):453-461.
[47]Yuan BL,Li X Z,Graham N.Aqueous oxidation of dimethyl phthalate in a Fe(VI)-TiO2-UV reaction system [J].Water Research,2008,42(6/7):1413-1420.
[48]AsahiR,Morikawa T,OhwakiT,etal.Visible-light photocatalysis in nitrogen-doped titanium oxides[J].Science,2001,293(5528):269-271.
[49]Linsebigler A L,Lu G,Yates J T.Photocatalysis on TiO2surfaces: rrinciples,mechanisms,and selected results[J].Chem.Rev.,1995, 95(3):735-758.
[50]Yu J C,Zhang L Z,Zheng Z,et al.Synthesis and characterization of phosphated mesoporous titanium dioxide with high photocatalytic activity[J].Chem.Mater.,2003,15(11):2280-2286.
[51]Anandan S,Pugazhenthiran N,Lana-Villarreal T,et al.Catalytic degradation of a plasticizer,di-ethylhexyl phthalate,using Nx-TiO2x nanoparticles synthesized via co-precipitation[J].Chemical Engineering Journal,2013,231:182-189.
[52]Mohamed R M,Aazam E.Synthesis and characterization of P-doped TiO2thin-films for photocatalytic degradation of butyl benzyl phthalate under visible-light irradiation[J].Chinese Journal of Catalysis,2013,34(6):1267-1273.
[53]李岩.纳米H3PW12O40/TiO2复合材料光催化降解水中酞酸酯类化合物的研究[D].长春:东北师范大学,2006.
[54]Xu L,Yang X,Guo Y,et al.Simulated sunlight photodegradation of aqueous phthalate esters catalyzed by the polyoxotungstate/ titania nanocomposite[J].Journal of Hazardous Materials,2010,178(1/3):1070-1077.
[55]Ma F,Shi T,Gao J,et al.Comparison and understanding of the different simulated sunlight photocatalytic activity between the saturated and monovacant Keggin unit functionalized titania materials[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2012,401:116-125.
[56]Xu X R,Li S X,Li X Y,et al.Degradation of n-butyl benzyl phthalate using TiO2/UV[J].Journal of Hazardous Materials,2009,164(2/3):527-532.
[57]Xu B,Gao N,Cheng H,et al.Oxidative degradation of dimethyl phthalate (DMP)by UV/H2O2process[J].Journal of Hazardous Materials,2009,162(2/3):954-959.
[58]景伟文,李君,康志强,等.Ag掺杂改性TiO2催化降解水体中的邻苯二甲酸二甲酯[J].环境科学与技术,2012,35(7):112-116.
[59]景伟文,刘义轩,张欣茜.SiO2-TiO2复合催化剂降解水体中的邻苯二甲酸二甲酯[J].新疆农业大学学报,2012,35(1):70-74.
[60]洪春苗,闫绍轩,李乃瑄.双氧化剂光催化降解水中邻苯二甲酸酯类污染物[J].环境保护科学,2012,38(1):23-25.
[61]吴楚萍,尹平河,赵玲,等.流化型TiO2光催化处理邻苯二甲酸二甲酯微污染水[J].水处理技术,2010,36(12):63-66.
[62]杨开林.微波+Fenton试剂+活性炭处理邻苯二甲酸酯的研究[D].重庆:重庆大学,2006.
[63]吴楚萍.TiO2浮石光催化降解水中邻苯二甲酸酯类污染物的研究[D].广州:暨南大学,2010.
[64]Hizal G,Zhu Q,Fischer C H,et al.On the photolysis of phthalic acid dialkyl esters:a product analysis study[J].Journal of Photochemistry and Photobiology A:Chemistry,1993,72(2):147-152.
[65]初人合,闫福成,闫吉昌,等.二氧化钛纳米粒子的合成及其催化降解酞酸酯类化合物的研究[J].高等学校化学学报,2005,26 (9):1699-1703.
[66]刘芃岩,冯关涛,刘金巍,等.邻苯二甲酸酯的光降解研究[J].环境科学学报,2009,29:1049-1055.
[67]Yuan B L,Li X Z,Graham N.Reaction pathways of dimethyl phthalate degradation in TiO2-UV-O2and TiO2-UV-Fe(VI) systems[J].Chemosphere,2008,72(2):197-204.
[68]Sharma V K.Ferrate(V)oxidation of pollutants:a premix pulse radiolysis study[J].Radiation Physics and Chemistry,2002,65 (4):349-355.
[69]Ding X,An T,Li G,et al.Photocatalytic degradation of dimethyl phthalate ester using novel hydrophobic TiO2pillared montmorillonite photocatalyst[J]. Research on Chemical Intermediates,2008,34(1):67-83.
Advances in photocatalytic degradation research on PAEs in water
GU Chuantaoa,WANG Chunyinga,b
(a.Jiangxi Key Laboratory of Mining Engineering;b.Jiangxi Key Laboratory of Mining&Metallurgy Environmental Pollution Control,Jiangxi University of Science and Technology,Ganzhou 341000,China)
Phthalic acid esters (PAEs)paly a dominant role in the plasticizer market and have been widely detected in water.Existence of PAEs in water has already been a threat to the aquatic organisms and human health.This paper summarized the degradation of PAEs by photocatalytic oxidation technology:the effects of PAEs on the removal efficiency by such factors as irradiation time,irradiation intensity,catalyst dosage,initial concentration of PAEs,pH value of reaction solution and additives;the reaction dynamics of PAEs decomposition;and the degradation pathway of PAEs.At last,the further research was discussed.
PAEs;photocatalytic degradation;degradation dynamics;degradation mechanism
2095-3046(2015)01-0012-07
10.13265/j.cnki.jxlgdxxb.2015.01.003
O643.3;X703
A
2014-11-12
国家自然科学基金资助项目(51408277);江西省自然科学基金资助项目(20142BAB213019);江西理工大学矿业工程高水平学科经费资助项目(3304000008);江西理工大学博士启动基金(3401222090)
谷传涛 (1981- ),男,硕士,助教,主要从事光催化材料的制备及其在环境污染治理中的应用等方面的研究,E-mail: beyond_life@163.com.
