基于介电电泳的微流控细胞分离芯片的研究进展
2015-10-09郑小林罗洪艳廖彦剑
陈 礼 郑小林 胡 宁 杨 军 罗洪艳 姜 帆 廖彦剑
(重庆大学生物工程学院,生物流变科学与技术教育部重点实验室,视觉损伤与再生修复重庆市重点实验室,重庆400030)
1 引言
细胞分离作为一个重要的纯化过程[1],在生物研究和分析诊断中有着极其重要的应用。许多基于细胞的研究领域,如临床诊断、环境监测、食品加工以及制药工业等都需要进行目标细胞的高灵敏度检测和高纯度加工,上述基础及应用研究工作的开展都依赖于细胞分离技术[2~5]。针对悬浮液中生物微粒的电磁操作是目前生物分析领域的一个研究热点,细胞分离也是其中一个重要内容。
传统的细胞分离方法主要分为两类[6]:第一类是依靠细胞本身的尺寸、重力特性进行分离,如离心法、重力沉积法等,这类方法分离精度较低,分离时间较长且操作复杂,对细胞活性有较大影响;第二类则需要细胞间接带电或者外加磁性物质,最后在电场或者磁场作用下进行细胞分离,如电泳法、磁性分离法等,这类方法通常需要对细胞进行预处理,在细胞表面附着其它物质,且在分离之后难以去除附着物,对于细胞存活率影响较大,操作流程繁琐,价格不菲。同时,上述细胞分离方法通常需要旋流器、流式细胞仪等专业设备,存在体积大、操作人员需进行专业培训、成本昂贵等缺点,限制了其广泛应用。
由电泳技术发展而来的介电电泳(Dielectrophoresis,DEP)[7]打破了前者要求微粒带电的限制,能让电中性微粒在空间非均匀直流或者交流电场的作用下,发生极化而沿场强变化方向受到介电电泳力(净力),并在介电电泳力作用下发生移动。自1978年Pohl[8]将介电电泳引入生物和化学领域,特别是将该技术应用于传统电泳无法高效解决的细胞分离和操纵难题以来,该技术就一直受到各国研究者的重视并不断发展完善[9]。较传统电泳方法而言,该技术具有许多优点[10~12],如不需要标记抗体,从而可避免细胞在分离过程中因抗体反应而发生生物性质改变;所用低强度的交变电场对细胞的作用是“非破坏性”的,大量研究结果已经证明其不会改变细胞的生长及分裂性质;使用灵活,电场强度、频率、相位都容易调控,便于自动化操作;同时,介电电泳分离方法还可与其它方法结合使用,以达到最佳的细胞分离检测效果。
近年来,随着介电电泳技术的理论成熟和微流控芯片加工技术的飞速发展,利用微流控芯片体积小、造价低廉、液体流动可控、消耗试样和试剂极少、通量高、检测分析精度好等优点,在芯片上开展基于介电电泳的细胞分离成为国内外研究热点[13~16]。基于介电电泳的微流控细胞分离芯片结合了介电电泳和微流控芯片技术的优点,同时,分离目标不仅局限于细胞,也可以进行微米尺度的矿物颗粒[17]、聚苯乙烯微球[18]、液滴[19]、细菌[20~21]和酵母菌[22]等目标物的分离纯化,甚至还可以分离纳米尺度的病毒[23]、纳米粒子、DNA[24]、碳纳米管[25~26]等。
本文介绍基于介电电泳的微流控细胞分离芯片的研究现状,总结了影响介电电泳分离的关键因素,对不同类型的微流控细胞分离芯片进行了介绍,并对该技术的未来发展趋势进行了展望。
2 介电电泳细胞分离的基本理论
带电粒子在直流电场作用下于一定介质中所发生的定向运动,称为电泳;非带电颗粒(电介质)在电场作用下的定向运动叫电介质电泳(Dielectrophoresis,DEP),简称“介电电泳”[27]。电泳和介电电泳有着本质的区别。电泳的粒子带电,而介电电泳的颗粒为电中性。悬浮于盐溶液中的细胞可以在电场中运动,这是因为细胞表面具有一定的电荷(通常为负电荷),可以吸附被极化的水分子层,它与介质之间存在着电位差,此电位差产生了细胞电泳运动的驱动力。电中性颗粒(例如细胞)处于非均匀电场时,电介质颗粒中的电荷在电场极化作用下发生移动从而构成一个电偶极子,该细胞电偶极子在电场中受到电场力的作用。该电场力即为介电电泳力,简称DEP力[28,29]。
当微粒和溶液处于交流电场中时,微粒和溶液都会受到极化作用,当微粒比溶液受到的极化作用强时,微粒受到的沿场强增大方向的力大于溶液,从而使中性微粒聚集在电场的极大值处,这一现象称为正介电电泳,所受的力为正介电电泳力,简称pDEP力;反之则为负介电电泳,所受的力为负介电电泳力,简称 nDEP 力[30]。
对球形颗粒或者球形细胞(半径为r,相对介电常数为εP,电导率为σp)悬浮于流体介质(相对介电常数为εf,电导率为σf)的情形,处于外加非均匀交变电场中且电场的相位不发生变化时,根据偶极子模型可以得到作用在其上的DEP力(FDEP),其简化计算公式[31,32]为:

式中:ε0为真空介电常数;ω为外加电场信号的角频率;Erms为外加电场的均方根。DEP力的方向取决于K*(ω)实部部分(Clausius-Mossotti因子,简称CM因子,用fCM(ω)表示)的符号。当Re[K*(ω)]>0时,颗粒在非均匀外加电场的作用下从低电场区域被吸引至高电场区域,为正介电电泳(pDEP);反之,当Re[K*(ω)]<0时,将从高电场区域被排斥至低电场区域,则为负介电电泳(nDEP)。式(1)所示DEP力(FDEP)的计算有一个前提,那就是施加的非均匀交变电场的相位不发生变化。当相位发生变化的时候,式(1)就不再适用了,此时的介电电泳力与K*(ω)的虚部部分有关,计算较为复杂,称为行波DEP[33,34]。
细胞在介电电泳力作用下可改变其运动状态或趋势,进而可以实现细胞操作。根据细胞在缓冲液中所受介电电泳力的差异,可以进行细胞的分离。通常情况下,在分离样本和缓冲液环境固定后,CM因子只与电场信号频率有关,因此在实验中CM因子-频率图谱是选定合适的介电电泳分离频段的重要依据[35]。要分离两种不同细胞的混合样品,可以借助介电电泳力的差异设计相应的实验方案。目前经典的方案有两种:(1)使一种细胞的CM因子为正值,受到正介电电泳作用,运动方向为靠近电极方向(高电场区域),另一种细胞的CM因子为负值,受到负介电电泳作用,运动方向为远离电极方向(低电场区域);(2)两种细胞受到同一类型介电电泳力时(pDEP或nDEP),借助介电电泳力大小的差异实现样本在芯片内部运动轨迹差异达到分离的目的。
3 不同类型的微流控细胞/微粒分离芯片
由公式(1)可知,影响细胞DEP作用的因素有细胞尺寸、细胞和悬浮液的相对介电常数和电导率、电场梯度的大小、电信号频率等。其中,电场梯度的产生主要取决于电极形状,因而电极形状的选择对介电电泳细胞分离芯片的设计非常重要[36,37];而外加信号的类型将直接影响分离操作,因此激励信号的优化配置显得尤为关键。此外,选择合适的悬浮液也是必须考虑的因素。
3.1 基于细胞尺度效应的介电电泳分离芯片
细胞的尺寸从几微米到几十乃至上百微米,对于不同尺寸的细胞,在非均匀电场中,所受到的介电电泳力FDEP与细胞半径r的三次方成正比,因此可以利用此原理进行细胞分离。下面介绍几种利用此类方法进行分离的微流控芯片。
3.1.1 DEP与Field-Flow-Fractionation(FFF)联用法分离芯片 根据层流理论,在微管道中流动的液体流层与管壁、流层与流层之间的粘性力导致管壁处流层流速最低,管轴处速度最大,且越靠近管轴处速度越大,速度与管轴处的距离成抛物线分布。Wang等[38,39]发展了基于DEP力场的流动分离方法(图1),当流场以图示方向流动时,电极阵列置于流道的底部,形成非均匀电场,通过选择合适的频率使细胞受nDEP力作用,而nDEP力将把颗粒推离流道底部;颗粒最终的位置取决于DEP力在垂直方向上的分量FDEPz与颗粒重力及浮力合力Fsed的平衡关系。由于DEP力与颗粒半径成正比,不同尺度的颗粒将承受不同的DEP力,它们在垂直方向的平衡位置(h1和h2)也会同。不同的颗粒将分别处于抛物线速度剖面的不同层,由此具有不同的移动速度(v1与v2)。当在管内流动一段时间和距离之后,各尺寸不同的粒子就会在距离上产生差异,此时在管口分时收集就可达到分离不同种细胞或者微粒的目的。

图 1 DEP-FFF 细胞分离微流控芯片[38,39]Fig.1 Dielectrophoresis-field-flow-fractionation(DEP-FFF)cell separation microfluidic chip
3.1.2 DEP与曲率诱导联用法分离芯片 Zhu等[40]在2011年提出了一种介电电泳细胞分离芯片。该芯片在蛇形通道内使用曲率诱导介电电泳,成功地用于分离酵母菌和3 μm尺寸的聚苯乙烯颗粒(图2),分离效率高达95%。该芯片由4个流通池和连接流通池的蛇形分离通道构成(图2a)。其工作原理如图2b所示:混合样品(颗粒)从A口流入,B口流入缓冲液。当混合微粒运动到转弯位置的时候,选择合适的频率使白色颗粒CM因子为负,蓝色颗粒CM因子为正,这样在转弯时蓝色颗粒由pDEP产生的向心力继续留在内侧流层中,而白色颗粒受到nDEP作用向外侧流层偏移,这样经过数十个蛇形转弯通道的曲率诱导介电电泳作用积累,使白色颗粒在外侧流层中,蓝色颗粒留在内侧流层。在出口处,在外侧流层中的白色颗粒从C口流出,在内侧流层中的蓝色颗粒从D口流出,达到分离的目的。研究人员借助Comsol模拟(图2c和2d)其分离过程,结果显示,借助曲率诱导介电电泳效应,能够对细胞尺寸不一和CM因子不同的两种细胞进行分离。
该类分离芯片可用于对介电电泳极性相反(一种为pDEP,另一种为nDEP)的细胞进行分离,分离精度较高,操作简便,但缺点是只能分离两种细胞或者微粒,且需实验前需测得两种细胞或者微粒的正-负介电电泳临界频率。
细胞半径是标志细胞大小的参数,常用作细胞分选的特征参数。介电电泳力FDEP与细胞半径r的三次方成正比,使得基于介电电泳和细胞尺寸差异的分离方法更容易得以实现。与尺寸相关的DEP分离方法也常与其它方法联合使用,如DEP与超声联用、DEP与磁场联用、DEP与光镊技术联用等[31,32],在此就不一阐述。此外,基于细胞尺度效应的介电电泳分离芯片在某些方面亟需改进:(1)在理论和仿真研究中,细胞模型的建立还有待进一步完善。由于大多数细胞是球型,因此在进行理论仿真时候常把细胞看作是双层球壳,但事实上很多细胞是长条状、棒状或者其它不规则形状。(2)在实际样本中,细胞(粒子)间的区别低于实验中选取的特定样本,也就是说,当两种细胞在尺寸、形状上具有一定的相似性时,对于这类性质差别不大的分离对象,还需进一步提高介电电泳的分辨率。而且,对于植物细胞而言,细胞壁的存在也会使细胞理论模型和实际情况有所区别。

图2 曲率诱导介电电泳细胞分离芯片[40](a)芯片实物图;(b)原理图;(c)芯片入口流路分布图;(d)芯片出口流路分布图。Fig.2 Cell separation microfluidic chip via curvature-induced dielectrophoresis:(a)Picture of microfluidic chip;(b)Illustration of sheath-flow focusing and dielectrophoretic separation of particles;(c)and(d)Numerical prediction of the flow of inlet and outlet[40]
3.2 基于电极优化的介电电泳分离芯片
在基于介电电泳的细胞分离研究中,电场梯度同样是影响细胞DEP作用的重要因素。微流控芯片上的非均匀电场主要是由电极产生的,所以电极的形状和分布对FDEP的分布具有决定意义[41]。芯片电极的分类方法比较多,没有统一标准。如按照电极形状可分为叉指电极、城墙状电极、螺旋电极、对电极等;按照电极的分布可分为底部电极、侧壁电极、和空间电极等,其中侧壁电极还可分为单侧电极、双侧电极等;按照电极的材质和制作工艺可分为金属电极、碳电极、复合电极等;按照电极的配置方式可分为二维平面电极、三维立体电极等。本文将按照电极的结构将电极分为阵列式电极、环状电极、柱状电极和不规则电极等类型。
3.2.1 阵列式电极 阵列电极分离芯片的设计思路是通过在微流控芯片上集成阵列化微电极(不同或同种结构),实现大量生化样品的在线分离和富集。电极的形状、大小和位置直接影响非均匀电场的分布,而电极的厚度则影响芯片的键合和系统的集成化。Yang等[42]对平面交错式阵列电极设计的DEP芯片(图3a)采用多物理量耦合分析软件(FEMLAB)进行仿真,计算了图3b中右上角所示电极结构的电场分布。电极阵列中高电场区域始终位于电极边缘处,该处适合做正介电电泳运动的细胞实现富集。在电极的宽度和间距相等时,低电场区域出现在电极的中心位置和相邻电极的中心线位置,且场强相等;如果电极的宽度大于电极的间距,则低电场区域集中于电极平面的中心线位置;如果电极的宽度小于电极的间距,则低电场区域集中于相邻电极间距的中心线位置,在该处适合作负向介电电泳的细胞实现富集。Yang等[42]设计的芯片管道高度不到100 m,在2 V和2 MHz的电信号条件下,能够保证99%的捕获效率,从而实现心肌细胞的正介电电泳分离和富集。
阵列式电极以其独特的结构,具有很多优点:可在有限的区域内分列排布大量电极;适用于高通量的分析检测要求,分离效率高且速度快。但阵列式电极对电极加工工艺和流程要求较高,电极间隙和相邻电极间的距离有较为严格的要求,在设计芯片时,应先根据适用对象和目标使用数值模拟软件得到其最佳的物理分布位置[43]。
3.2.2 环状电极 随着介电电泳技术的发展,单纯的针状或者对状电极已经不能满足实验的需要。而且,随着分离的细胞种类多样化,对电场梯度的要求也越来越高。因此,一些新型电极,如环状电极被设计出来(图4)[44,45]。环状电极的特点在于其电极形状不是传统的城墙形状或者叉指形状,而是根据实验对象灵活多变,大多比较复杂,电极曲线比较光滑,如常见的螺旋电极。
3.2.3 柱状电极 在介电电泳分离芯片中,常用的二维电极具有许多局限性,而且加工工艺复杂。传统芯片微电极是厚度为几百纳米的金属薄膜平面电极,其加工方法是在采用电镀或溅射的方法在基片上形成特定图案的金属电极,对于过量的部分利用剥离、蚀刻,结合某些特殊的光刻加工工艺去除[46]。但二维电极产生的电场随着粒子距电极表面距离的增加而呈指数型衰减[47],这意味着部分粒子由于距离电极较远,受到电场的作用微弱,而无法实现有效控制。
为了解决上述问题,近年来越来越多的芯片采用双侧平面电极或三维电极来产生三维电场。与二维电极相比,三维电极的鲁棒性更好,可承受的电流密度更大,且在电流热效应作用下产生的焦耳热较平面电极小,在平面电极发展的同时,三维电极以其空间的电场分布优势,需要电压小且捕捉更牢靠的优势吸引了人们的视线[48]。三维电极中常采用柱状电极,其使用频率较高,加工难度较小,分离效果较好。
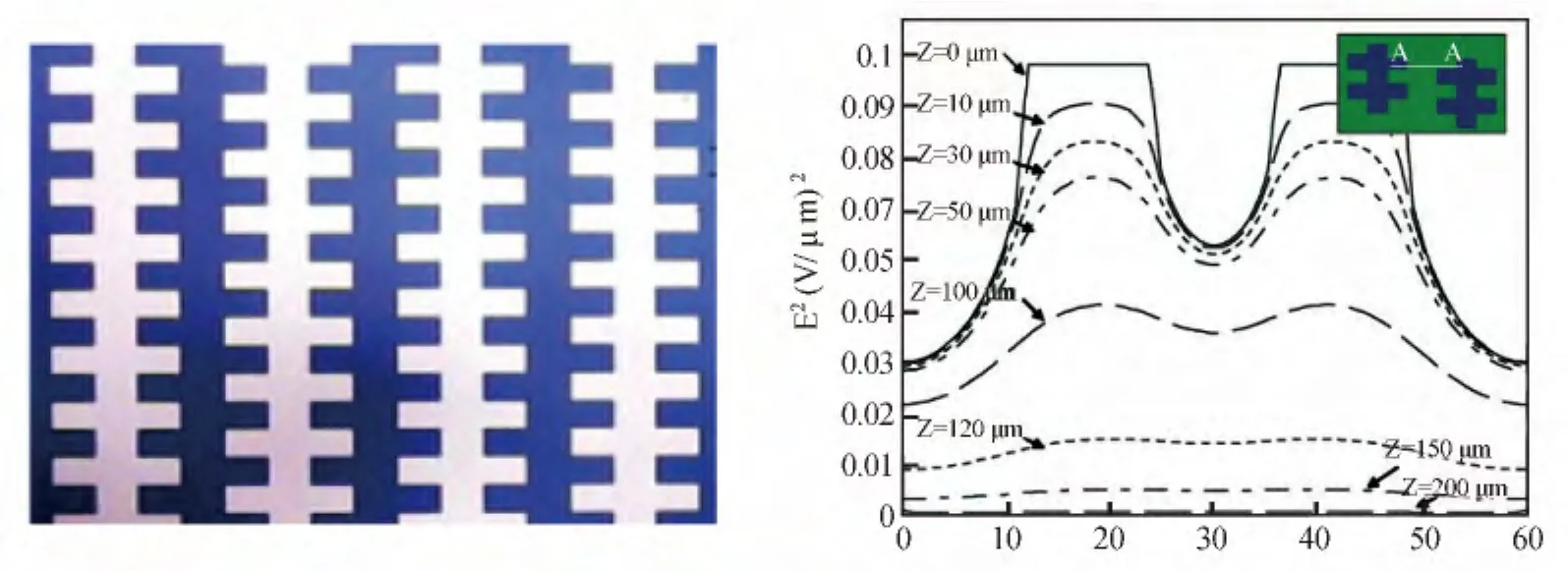
图3 阵列式电极[42]Fig.3 Array of electrodes[42]a.电极结构(Electrode structure);b.电场仿真(Simulation of field)。

图 4 环状电极[44,45]Fig.4 Ringlike electrodes[44,45](a)螺旋电极(Picture of spiral electrodes);(b)同心环电极(Picture of concentric electrodes)。
Hunt等[49]设计并制作了圆柱状电极微流控芯片(图5a),每个柱状电极由单独的引线供电,故可在同一芯片区域选择不同幅值、频率和相位的信号配合使用,使该电场区域适合进行介电电泳分离活动。
Iliescu等[50]设计并制作了三维正方体柱状电极细胞分离微流控芯片(图5b),与Hunt等的圆柱形电极[49]相比,此电极截面为正方形,通过数值仿真可以看出正方形的4个顶点处电场梯度值最高,在介电电泳作用下,细胞吸附能力最强,较圆柱形电极的分离、富集效果更好,将其用于分离活、死酵母细胞的分离精度95%。

图 5 三维电极[49,50]Fig.5 Three-dimensional(3D)electrodes[49,50](a)圆柱状电极(Picture of columnar electrodes);(b)正方体柱状电极、电场仿真图(Picture and the numerical simulation of electric field of the cubic electrode)。
当然,柱状电极只是三维电极的一个典型代表,三维电极作为近几年来热门的研究话题,其发展速度也是日新月异,各种形状、各种材质的三维电极已经多次报道。
3.2.4 不规则电极 在介电电泳分离技术中,电极的设计占据了相对重要的地位。
由于分离目标的多样化,导致了电极形状和结构的多样化。除了前面介绍的几种常规电极,很多非常规的不规则电极也在使用。Hoettges等[51]发展了拉链状环形电极(图6a),并使用其进行了孢子的富集和分离,实验观察到孢子聚集在拉练环状的中心处,在该装置中,孢子受到nDEP作用。Malnar等[52]设计的条状电极尖端有三角形弯折(图6b),使得一种微粒被捕捉在电极处,而另一种微粒随着流体的拖曳力流出。Gonzalez[53]设计了可分别加信号的棘齿状电极(图6c),成功进行了铁磁矿物粒子和聚苯乙烯颗粒的捕捉和分离,分离效率高。Pethig等[54]设计了波浪形电极阵列,利用多重介电电泳和行波介电电泳的重叠,使得微粒达到分离目的(图6d)。除了上述不同电极形状之外,还有糖葫芦状、叉指电极等各式电极,其设计思路与分离对象也各不相同。

图6 各种不规则电极Fig.6 Different kinds of irregular electrodes(a) 拉链环状电极(Zipper annular electrodes)[51];(b) 弯折三角形电极(Bending triangle electrodes)[52];(c) 棘齿状电极(Ratchet electrodes)[53];(d) 波浪形电极(Undulating electrodes)[54]。
以上分类是从电极形状上考虑的,不能包含所有报道过的微电极,这是因为电极分类方法较多,分类标准不统一。在考虑芯片上微电极的设计时候,应当从实验目的和实验对象出发,综合电极形状、电极厚度、加工难度以及组装集成的难度等方面来考虑。二维平面电极已经广泛应用于各种微流控芯片中,最近几年三维电极以其独特的空间电场分布优势正在逐渐扩展到微流控芯片的各个领域,是微电极发展的主要方向与趋势之一。
3.3 基于激励信号优化的介电电泳分离芯片
根据所施加的外加电场的种类不同,可以将介电电泳分离芯片分为直流式介电电泳芯片(DC-DEP Chip)、交流式介电电泳芯片(AC-DEP Chip),而交流式介电电泳芯片还可细分为常规介电电泳芯片、行波介电电泳芯片。
3.3.1 直流式-介电电泳芯片(DC-DEP Chip) 根据介电电泳的定义,当细胞处于非均匀直流电场中时,也会发生极化现象,产生介电电泳力。直流式-介电电泳芯片模式中,直流信号施加在介电电泳芯片微通道两端,利用微通道内加工的绝缘障碍可以使电力线发生扭曲,从而产生非均匀电场,进而产生极化现象,实现样品的介电电泳富集、分离操控。Blanca和Cummings研究小组证明了集成圆形绝缘微柱阵列的介电电泳芯片对分散性微粒和聚苯乙烯的介电电泳诱捕能力[55,56]。Ciprian等[57]采用相同的集成有圆形绝缘微柱阵列的介电电泳芯片实现了酵母细胞的介电电泳富集,其富集效率达到75%。魏庆华等[58]采用SU-8聚合物材料制作的绝缘微柱介电电泳芯片(图7),用于分离和富集直径为16 m的乳胶粒子。受到电场强度较大区域(微圆柱周围)吸引的粒子将在圆柱周围产生集中;而没有受到吸引的粒子会在电场强度较小的区域(微圆柱与微圆柱之间)成串流动,从而达到微粒分离的目的。

图7 直流式-绝缘微柱电极[58]Fig.7 Direct current-insulated micro-column electrodes.
采用绝缘微柱构建的介电电泳芯片,由于直流电压同时作为待分析样品的驱动电压和富集分离电压,必然导致样品缓冲液中电流值的增加,从而对生物样品的活性造成破坏,如细胞膜被击穿等。然而,在实际的科研中,使用直流介电电泳的机会较少,使用交流信号介电电泳则比较普遍,这是因为尽管介电电泳理论上并没有限制直流电的使用,然而高频交流电的使用可以更有效地消除直流电所引起的电解、电热等问题,因此目前绝大部分实验中都使用高频交流电产生所需的电场,以避免在电极附近区域过热或发生电解。
3.3.2 交流式-介电电泳芯片(AC-DEP Chip) 在直流介电电泳中,电场会以焦耳热的形式产生功率损耗,相应的温度变化可能会对细胞生理状态产生负面影响。目前己知较高的温度(高于细胞生理温度4℃以上)将导致细胞迅速死亡。而在细胞内,细胞动力学过程和温度呈指数关系,所以很小的温度漂移也可能对细胞生理状态造成影响。目前关于诱导细胞响应所需要的最小的温度漂移还不清楚。所以实验中必须尽力减小化温度漂移。通常认为保持温度变化<1℃是可以接受的,这个温度变化和体内温度变化相近,不会对细胞有明显影响。而交流电在降低功率损耗方面具有相当的优势,这就使得交流式-介电电泳在分离研究中较直流式-介电电泳具有更广阔的应用。
(1)信号频率恒定的介电电泳芯片 信号频率恒定的介电电泳是最简单、最基本、最早研究的介电电泳形式。其特点是使用两相相位相反的交流信号,形成非均匀电场,使细胞在非均匀电场中产生感应偶极矩,从而受到介电电泳力的作用。根据细胞和悬浮液介电性质的差异,细胞将向电场中电场最强(pDEP)或者最弱的地方运动(nDEP)。利用微加工技术,现已设计制作出多种具有确定电场分布的信号频率恒定的介电电泳芯片,电极的形状主要有多项式函数形、正弦函数形、城堡形以及可单独寻址的圆形电极阵列等。
2005年,韩国的Doh等[59]报道了一种可连续分离细胞的微流控芯片(图8),在该芯片流路的底部或者通道侧壁配置电极,施加恰当的交流信号,当混合样品流过分离通道的时候,一种细胞受正向介电电泳作用从而产生一个与流路垂直的远离原混合流体中心位置的横向偏移量,随着流动的持续,这种横向偏移量会越来越大,细胞将从出口1流出;而另一种细胞受负向介电电泳作用,则仍按原轨迹运动,从出口2流出。Doh等[59]使用该方法进行了活、死酵母细胞的分离,由于缺乏对流体力与介电电泳力共同作用于样品体系时受力情况的深入讨论,采用该介电电泳芯片在出口处收集的酵母菌纯度低于80%。

图8 信号频率恒定的介电电泳芯片[59]Fig.8 Dielectrophoretic chip with constant frequency signal[59]
信号频率恒定的介电电泳芯片是使用非常广泛的一种微流控芯片,该芯片对信号要求较低,只需选择使两种细胞分别处于正、负介电电泳的频率即可完成分离,如果需要高精度的实验结果,需考虑流场的影响。在条件不足的情况下,使用寻常的信号发生器也可以勉强用于实验,对信号源的依赖性较小,但是为了获得更好的分离效果,信号源的带负载能力是不能忽视的指标。
(2)行波介电电泳芯片(Traveling wave dielectrophoresis,twDEP) 与信号频率恒定的介电电泳不同,行波介电电泳一般采用四相交流信号,相邻电极之间施加的信号相位差为90°。该方法一般通过在一系列线性排列的电极上施加上述交流信号,构建一个空间行波电场,其相位沿着电极排列的方向变化。当细胞处于这样的电场中时不仅会受到由于电场强度分布不均匀产生的介电电泳力,即常规介电电泳力;同时也会受到由于电场相位分布不均匀而产生的介电电泳力,称为行波介电电泳力[60]。细胞在行波介电电泳力作用下的运动称为行波介电电泳。此处需注意的是,使用公式(1)计算行波介电电泳力并不合适,因为常规的介电电泳所用交变电场的频率和相位是固定值,然而行波介电电泳的相位不固定,需使用更为复杂的计算方法。
最早开展这方面研究的是Masuda研究小组,他们于1980年代后期报道了在同步移动电场的作用下可以实现细胞与电场一起运动[61]。Fuhr及其合作者发展了他们的工作,研究了twDEP与电旋转原理上的相似性,并提出了“异步”行波介电电泳的概念和具体实施方案[62]。目前,已有多种电极形状和尺寸不同的行波介电电泳芯片被设计出来[63,64]。如图9所示,图中电极宽度与间距均为20 μm,电极与流动方向平行,在不同电极上施加不同相位(相位相差90°)的信号产生twDEP力,不同细胞或颗粒在twDEP作用下的侧向运动速度存在差别,最终,在twDEP作用下使颗粒产生垂直于流动方向的运动,达到很好的空间效果[33]。行波介电电泳芯片对于信号要求较高,且电极分布需合理,理论较常规介电电泳较为复杂,但对于多种(大于两种)细胞或者微粒的具有较为明显的优势,分离精度较高。
在分离操作中,外加电场信号是介电电泳分离活动的核心因素,是分离活动成功与否的关键,因此,针对不同的芯片结构,不同的分离目标以及对分离速度要求等因素的考虑,选择合适的电场信号,能够有效地提高分离效率。此外,除了外加信号的不同以外,流体的流动作用不可忽视,流体流动除了能推动细胞向分离区域流动外,还可改变细胞与电极之间的相对位置,对分离过程影响很大。单纯依靠电场DEP作用只能在小范围内对细胞进行操纵,想要分离过程满足高通量和高效率,引入其它物理场是常采用的技术手段。现阶段大多数研究人员认为多物理场之间是互不影响的,但事实却并非如此。

图9 行波介电电泳分离细胞微流控芯片[33]Fig.9 Traveling wave dielectrophoresis(TWDEP)microfluidic chip[33]
4 结论和展望
自从1991年英国学者Pethig利用交流电场将细胞从液体中成功分离以来,使用介电电泳分离细胞已经开展了20余年的研究[8]。随着微加工技术的发展,介电电泳和微流控芯片携手,使细胞分离进入了微观时代。在这期间,介电电泳理论得到长足的发展,新的细胞分离模型不断出现,各种结构的微流控细胞分离芯片被报道出来,从最开始的单一非均匀电场到后来的多物理场相结合,每一次创新都是对该领域的重大贡献。
基于介电电泳的细胞分离微流控芯片在未来的发展将着重于以下五方面:(1)在理论和仿真研究中,各种模型的建立还有待进一步完善。此处的模型不仅是指细胞模型,而且还有多物理场耦合时互相影响的模型。(2)分离过程的高精度和高效率。更多不同结构和不同分离方法的微流控芯片是有效的手段。(3)拓展介电电泳分离的应用范围。可以对其它的些粒子进行分离,如矿物质粒子、胶体粒子等,而且对于粒子的形态也可以广泛化,除了固态粒子,液态粒子也可以考虑作为分离对象之一;此外,分离尺寸从微米粒子到纳米粒子都可以作为适用范围。(4)芯片上多功能集成。实验时需要在芯片上集成多种检测分析方法,实时准确地观察和分析细胞分离的进程;为了排除细胞悬液中其它物质的影响或者实现实验细胞的富集,需要集成样品前处理模块;为了实现细胞的分析和再利用,需要集成细胞分离后的培养等模块。(5)实验系统的小型化、自动化。现阶段实验经常使用高倍数显微镜配置成像系统进行实验观察,新的显微成像方法如无镜头阴影成像技术[65]等可以用于实验,体积和造价均远低于前者;分离之后统计的方法也有待进一步完善,现在的方法比较原始,采取显微镜视野下的人工计数得到结果,在今后的实验中可以考虑引入图像处理的方法进行细胞计数,效率更高,自动化程度更高。此外,在有些方面还需要进行改进,如分离后细胞的存活率分析[66]等。
基于介电电泳的细胞分离微流控芯片的发展与数学、物理、生物、分析化学、微加工技术的研究紧密相关。一方面,细胞分离微流控芯片的设计和制作,以微加工技术,数值模拟技术,生物标志和化学分析为基础;另一方面,对基于介电电泳的细胞分离微流控芯片的研究,进一步推动微加工技术的发展,特别是芯片上细胞的操纵技术的发展,将对生物、分析化学技术的长足发展贡献一份力量。随着微流控技术的快速发展,相信在不远的将来,高精度、高通量、高效率、多功能、便携式、经济实用的细胞分离微流控芯片将在生物、医学、农业等领域得到广泛应用。
1 Jinhee J,Seo S K,Joo Y D,Han K H.Sens.Actuators B,2011,157(1):314-320
2 Yuta N,Sakiko H,Takashi Y.Sen.Actuators B,2009,145(1):561-569
3 dela R C,Tilley P A,Fox J D,Kaler K V.IEEE TBiomed.Eng,2008,55(10):2426-2432
4 Moon H S,Nam Y W,Park J C,Jung H I.Environ.Sci.Technol,2009,43(15):5857 -5863
5 Chow K S,Du H J.Sens.Actuators A,2011,170(1-2):24 -31
6 Lackowski M,Krupa,Butrymowicz D.J.Electrostat.,2013,71(5):921 -925
7 Bert T,Smet H D.Displays,2003,24(4-5):223-230
8 Pohl H A.Dielectrophoresis,1978
9 Kadaksham J,Singh P,Aubry N.Mech.Res.Commun.,2006,33(1):108 -122
10 Deng Y L,Chang J S,Juang Y J.Bioresource.Technol.,2013,135:137 -141
11 Tomoyuki Y,Masato S,Hitoshi S,Tomokazu M .Sens.Actuators B,2009,142(1):400-403
12 Demierre N,Braschler T,Muller R,Renaud P.Sens.Actuators B,2008,132(2):388-396
13 FANG Zhao-Lun.Production and Application of Microfluidic Chip.Beijing:Chemical Industry Press,2005:102方肇伦.微流控分析芯片的制作及应用.北京:化学工业出版社,2005:102
14 LIU Shun-Dong,ZHANG Hong-Yan,SHEN Ping,CUI Hai-Hang.Micronanoelectronic Technology,2012,49(4):268-279刘顺东,张鸿雁,沈 萍,崔海航.微纳电子技术,2012,49(4):268-279
15 Cao J,Cheng P,Hong F J.Sci.China.Technol.SC,2009,52(12):3477 -3490
16 Robert B.Sensor.Rev,2013,33(4):300-304
17 Chen H Y,Liu Y,Zhang H T,Yu L,Zhu Yl,Li D.Chinese J.Chem.Eng.,2010,18(6):1034-1037
18 Lewpiriyawong N,Kandaswamy K,Yang C,Ivanov V,Stocker R.Anal.Chem.,2011,83(24):9579-9585
19 Chen C H,Tsai S L,Jang L S.Sens.Actuators B,2009,142(1):369-376
20 Cifra M,Fields J Z,Farhadi A.Prog.Biophys.Mol.Bio,2011,105(3):223-246
21 Hamada R,Takayama H,Shonishi Y,Mao L,Nakano M,Suehiro J.Sens.Actuators B,2013,181:439-445
22 Markx G H,Talary M S,Pethig R.J.Biotechnol,1994,32(1):29-37
23 Hughes M P,Morgan H,Rixon F J.BBA-Gen.Subjects,2002,1571(1):1 -8
24 Ravi P,Karan V K.Sens.Actuators B,2012,169(5):274-283
25 Wei C H,Wei T Y,Liang C H,Tai F C.Diam.Relat.Mater,2009,18(2-3):332-336
26 Wei C H,Wei T Y,Tai F C.Diam.Relat.Mater,2010,19(5-6):573-577
27 YIN Zhi-Wen.Dielectric Physics.Beijing:Science Press,2003:96殷之文.电介质物理学.北京:科学出版社,2003:96
28 Sun L N,Liu D L,Chen L G.Procedia.Eng.,2011,15:336-340
29 Cao J,Cheng P,Hong F J.J.Electrostat.,2008,66(11-12):620 -626
30 Pham P,Texier I,Larrea A S,Blanc R,Revol C F,Grateau H,Perraut F.J.Electrostat.,2007,65(8):511 -520
31 Song B Y,Liu D L,Sun L N,Chen L G.Procedia.Eng.,2011,15:341-345
32 Tomoyuki Y,Junko Y,Hitoshi S,Fumio M,Tomokazu M.Sens.Actuators B,2013,186:9-16
33 Sander D,Vivek R,Dietmar P E,Wojciech W,Michael J V.Sens.Actuators B,2012,170:207-214
34 Cen E G,Dalton C,Li Y,Adamia S,Pilarski L M,Kaler K V.J.Microbiol.Meth.,2004,58(3):387-401
35 Nuttawut L,Chun Y,Yee Ch L.Microfluid.Nanofluid,2012,12(5):723-733
36 Saar G,David E,Uri D.Sensors Actuators A,2008,142(1):138-146
37 Chin H K,Yee C L,Chun Y,Kamal Y T,Isabel R.J.Electrostat.,2008,66(9-10):514 -525
38 Wang X B,Yang J,Huang Y,Jody V,Frederick F B,Peter R C .Anal.Chem.,2000,72(4):832-839
39 Huang Y,Wang X B,Becker F F,Gascoyne P R.Biophys.J.,1997,73(2):1118-1129
40 Zhu J J,Robert C C,Gyunay K,Pallavi V,Tzeng T R,Xuan X C.Microfluid.Nanofluid,2011,11(6):743-752
41 ZENG Xue,XU Yi,CAO Qiang,HAO Dun-Ling,WU Yong-Jie.Micronanoelectronic.Technology,2009,46(1):34 - 40曾 雪,徐 溢,曹强,郝敦玲,吴永杰.微纳电子技术,2009,46(1):34-40
42 Yang M,Zhang X.Sens.Actuators A,2007,135(1):73-79
43 Chin H K,Yee C L,Yang C,Kamal Y T,Isabel R.J.Electrostat.,2008,66(9-10):514 -525
44 Gascoyne P R,Vykoukal J V.IEEE.Inst.Electr.Electron.Eng.,2004,92(1):22 -42
45 Ho C T,Lin R Z,Chang W Y,Chang H Y,Liu C H.Lab Chip,2006,6(6):724-734
46 Wang L,Flanagan L,Lee A P.J.Microelectromech.S,2007,16(2):454-461
47 Hywel M,Alberto G I,David B,Nicolas G G,Antonio R.J.Phys.D.Appl.Phys.,2001,34(2708):1553 -1561
48 Masashi Y,Tomoyuki Y,Masato S,Satoshi K,Hitoshi S,Tomokazu M,Fumio M.Electrochim.Acta,2012,82:35-42
49 Hunt T P,Issadore D,Westervelt R M.Lab Chip,2008,8(1):81-87
50 Iliescu C,Xu G,Loe F C,Ong P L,Tay F E.Electrophoresis,2007,28(7):1107-1114
51 Hoettges K F,Hughes M P,Cotton A,Hopkins N A E,McDonnell M B.IEEE Proc.Nanobiotechnol.,2003,22(6):68-74
52 Malnar B,Malyan B,Balachandran W,Cecelja F.IEEE Proc.Nanobiotechnol.,2003,150(2):66 -9
53 Gonzalez C F.Doctor Paper,July 10,2007
54 Pethig R,Talary M S,Lee R S.IEEE Proc.Nanobiotechnol.,2003,22(6):43- 50
55 Blanca H,Blake A S,Eric B C,Yolanda F.Anal.Chem.,2004,76(6):1571-1579
56 Cummings E B.IEEE Proc.Nanobiotechnol.,2003,22(6):75 -84
57 Ciprian I,Yu L M,Francis E H,Chen B T.Sens.Actuators B,2008,129(1):491-496
58 WEI Qing-Hua,HUANG Zhong-Ren,LU Jin-Tu,HAN Wen-Xiang,XU You-Ming.Polymer Annual Conference Papers,2006魏庆华,黄忠仁,吕金涂,韩文祥,徐佑铭.高分子年会会议论文,2006
59 Doh I,Cho Y H.Sensors.Actuat.A,2005,121(1):59 -65
60 Hagedorn R,Fuhr G,Müller T,Gimsa J.Electrophoresis,1992,13(1-2):49-54
61 Masuda S,Washizu M,Iwadare M.IEEE Trans.Ind.Appl,1988,23:474- 480
62 Fuhr G,Fiedler S,Muller T.Sens.Actuators A,1994,41:230-239
63 Morgan H,Green N G,Hughes M P,Monaghan W.J.Micromech.Microeng,1997,7:65-70
64 Wang X B,Huang Y,Becker F F.IEEE Ias.Trans,1997,33:660 -669
65 Jin G,Yoo I H,Pack S P,Yang J W,Ha U H,Paek S H,Seo S.Biosens.Bioelectron.,2012,38(1):126-131
66 Alazzam A,Stiharu,Bhat R,Meguerditchian A N.Electrophoresis,2011,32(11):1327-1336
