乙醇水溶液体积分数和温度的近红外激光拉曼光谱研究
2015-10-09邹小波沈乐丞石吉勇
邹小波,沈乐丞,石吉勇
(江苏大学食品与生物工程学院,江苏镇江212013)
醇-水二元体系长期以来是一个热门的研究对象,学者们采用实验手段[1]和计算机模拟方法[2-3]对其进行了深入研究,获得了较多的有关动力学特性和分子结构的信息.由于水的拉曼散射很微弱,拉曼光谱是研究水溶液中的生物样品和化学化合物的理想工具[4].张洪波等[5]用乙醇分子的2个拉曼特征峰(位于2 970 cm-1和2 873 cm-1附近)的强度比值与体积分数间的线性关系实现了对水溶液中乙醇体积分数的测定.吴斌等[6]发现乙醇水溶液位于2 800~3 050 cm-1的3个C—H伸缩振动特征峰的峰值位置相对纯乙醇对应峰位的偏移量大致与乙醇体积分数呈线性相关,据此进行一元线性回归及进一步二元线性回归得到乙醇体积分数与C—H伸缩振动频率变化量的回归模型.吴斌等[7]还用激光拉曼光谱研究液态乙醇的水合作用过程,发现位于2 800~3 050 cm-1区间的C—H伸缩振动频率随乙醇中加入水量的增加整体呈现蓝移趋势,而位于1 048 cm-1附近的C—O伸缩振动频率的变化规律却与此相反,分析认为,这种现象主要由溶液内部分子间发生的不同水合作用所致,并据此阐明了液态乙醇的水合作用过程.李响等[8]将自适应偏最小二乘的方法应用于酒精浓度检测过程中,实现了拉曼光谱的噪声和背景自动扣除,从而更好地对拉曼光谱进行预处理,所得的乙醇浓度预测模型优于其他传统方法.但以上研究都是基于激光拉曼光谱仪,该设备价格昂贵,因此都是停留在实验室阶段,无法实现在线检测.另外,众所周知,乙醇水溶液的密度、声速等物理特性会随温度发生一定的变化,但乙醇水溶液的拉曼光谱随温度变化很少有人研究.
近年来由于便携式激光拉曼光谱仪具有携带方便、操作过程简单、使用条件不苛刻、价格适宜等优点而得到广泛的应用.由于近红外波段的荧光背景影响小,噪声低,窄带激光器能提供更多的物质成分信息[9],因此近红外激发拉曼光谱技术以其独特优势成为研究化学材料[10-12]以及生物大分子结构[13-15]的有力手段而备受研究者关注.但是正因为获得的信息数据冗杂,严重影响了拉曼信号的识别和比较.因此,提取光谱有效信息,是光谱分析工作必须解决的关键问题之一.偏最小二乘法(PLS)是一种基于因子分析的多变量校正方法,是目前在定量分析中应用最多的多元分析方法[16].通过这种方法对光谱进行筛选,可以剔除不相关或非线性变量的影响.因此文中用此方法来研究乙醇水溶液近红外激光拉曼光谱随体积分数和温度的变化,为实现乙醇水溶液体积分数的在线快速定量检测提供参考.
1 试验与方法
1.1 试验样品
采用无水乙醇(分析纯,体积分数99.7%,国药集团化学试剂有限公司)与超纯水配置待测溶液,共配制乙醇水溶液样本11个,乙醇体积分数范围为0~100%,间隔为10%.试验温度为10~30℃,每隔1℃测一次.
1.2 拉曼光谱采集
采用美国EnWave Optronics的HRC-10便携式近红外拉曼分析仪.激发源:NIR,频率稳定,狭窄线宽二极管激光器,785 nm;激光功率:150~200 mW;线宽:0.5 cm-1;光纤探测器:2个单一光纤的永久结合体,100μm激发光纤,200μm收集光纤,焦距为6 mm;光谱范围:300~3 900 cm-1;积分时间为20 s,平均参数为2,窗口滤波参数为0.使用前预热15 min,使输出达到稳定.从10℃开始,依次量取2 mL左右不同体积分数乙醇水溶液于3 mL进样瓶中,先收集暗电流参考数据,再收集拉曼光谱,直至30℃.
1.3 光谱数据处理及PLS建模
采用MATLAB 7.14.0.739(R2012a)软件来进行数据处理及建模.PLS是处理两数据块之间关系的一种数学方法,它将因子分析和回归分析结合,是一种经典的化学计量学算法,也是使用最多和效果最好的处理方法之一.其中模型精度采用校正均方根误差(RMSEC)表示,RMSEC越小,则说明模型的拟合精度越高,模型越可靠.模型的拟合程度采用复相关系数R表示,R越接近1,则说明预测值与实测值之间的相关程度越好.模型的预测能力采用预测均方根误差(RMSEP)表示,RMSEP越小,则表明模型对外部样本的预测能力越高.
2 试验结果与分析
2.1 乙醇和超纯水的拉曼光谱分析
图1为乙醇和超纯水的拉曼光谱,乙醇分子的不同拉曼特征峰对应着分子内不同原子基团的振动模式,从低波数到高波数,800 cm-1以前的峰均为容器峰,峰1(840.4 cm-1)为对称 C—C—O骨架伸缩,峰2(1 006.6 cm-1)为C—O伸缩,峰3(1 050.8 cm-1)为 C—C—O骨架剪式摇摆,峰4(1 237.7 cm-1)为乙醇分子CH2形变,峰5(1 411.7 cm-1)为CH3反对称形变,峰6(3 278.1 cm-1)为非对称CH2伸缩,峰7(3 355.2 cm-1)为非对称CH伸缩,乙醇的这7个典型的特征峰在文献[17]中也有描述.从图1还可以看出纯水没有明显的特征峰.

图1 乙醇和超纯水的拉曼光谱
2.2 乙醇水溶液的拉曼光谱分析
2.2.1 不同温度乙醇水溶液体积分数模型的建立及预测
分别对10,15,20,25和 30 ℃(即从 10 ℃ 开始每漂移5℃取一个温度值)下的10个体积分数建立乙醇与拉曼光谱之间的多元校正模型,并利用所建立的模型进行相互预测,以判定所建模型的优劣,得到结果如表1 所示.其中模型 1,2,3,4,5分别代表10,15,20,25和30℃的体积分数校正模型.由表 1 可知,模型 1,2,3,4,5 的校正相关系数(Rc)分别为 0.997 3,0.997 9,0.993 4,0.992 5和 0.988 3,RMSEC分别为 2.21,1.82,3.48,3.67和4.41,较高的Rc和较低的RMSEC对于一个可靠的模型是十分必要的,但一个模型的优劣不仅取决于此,还要求有较高的预测相关系数(Rp)和较低的RMSEP,在实际应用中后者往往尤为重要.由表1可知,对于与建模样品温度相同的模型,Rp较高,RMSEP也较低,但对于与建模样品温度不同的预测集样品,Rp最低值为0.995 3,RMSEP最高达到3.74.由此可以看出单个温度的体积分数模型对不同温度的样品体积分数的预测效果不是很理想,也就是说温度漂移对体积分数模型预测精度影响很大.结果说明5个模型的适用范围都较窄,不能很好地满足预测乙醇水溶液体积分数的要求.

表1 不同温度下体积分数模型的建立及预测性能
2.2.2 乙醇水溶液联合模型的建立及预测
为了解决上述问题,使所建体积分数预测模型准确可靠,覆盖范围宽,适用性广,试验进一步对上述5个温度处10个体积分数联合建立乙醇与拉曼光谱之间的多元校正模型.得到校正模型的Rc为0.997 6,RMSEC为1.94,此模型相关系数较高,模型拟合度较高,用不同温度的体积分数模型来检测此模型的预测能力,得到结果如表2所示,预测模型Rp均达到0.995 0以上,RMSEP均小于2.92.结果表明:建立的乙醇水溶液体积分数混合模型性能较稳定,能够满足不同温度下乙醇水溶液体积分数的测定,具有较高的适用范围,满足实际检测的需要,为开发快速、灵敏、实时在线检测乙醇体积分数的装备奠定基础.

表2 联合模型的预测结果
2.3 乙醇水溶液拉曼光谱的温度分析
图2显示了纯乙醇在10~30℃时的拉曼光谱,将最后2个峰放大示于图右上角.从图2可以看出,纯乙醇在不同温度下的21条光谱几乎重叠成一条光谱,变化规律不明显,用肉眼很难看到温度变化的影响,本研究决定用PLS方法来建立温度模型.对11个乙醇体积分数处的21个温度分别建立乙醇温度与拉曼光谱之间的多元校正模型,结果如表3所示.每个体积分数下温度模型的相关系数R均在0.734 4和0.954 7之间,说明温度对拉曼光谱强度具有影响.这是因为随着乙醇水溶液温度逐渐上升,乙醇分子的振动-转动作用变强,也即拉曼效应变强,导致拉曼光谱强度变大.从表3还可知随着乙醇体积分数变大,其相应的温度模型相关系数R也越来越大.说明乙醇体积分数越大,温度变化对拉曼光谱强度的影响越大.这是由于体积分数增大,单位体积溶液中的乙醇分子增多,此时拉曼光谱强度会由于温度变化而变化得更明显.
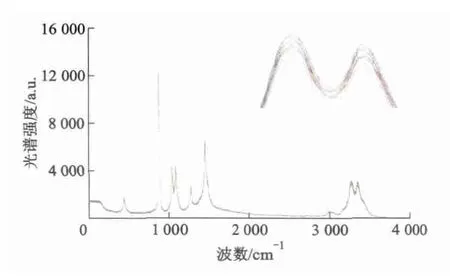
图2 10~30℃下的纯乙醇拉曼光谱
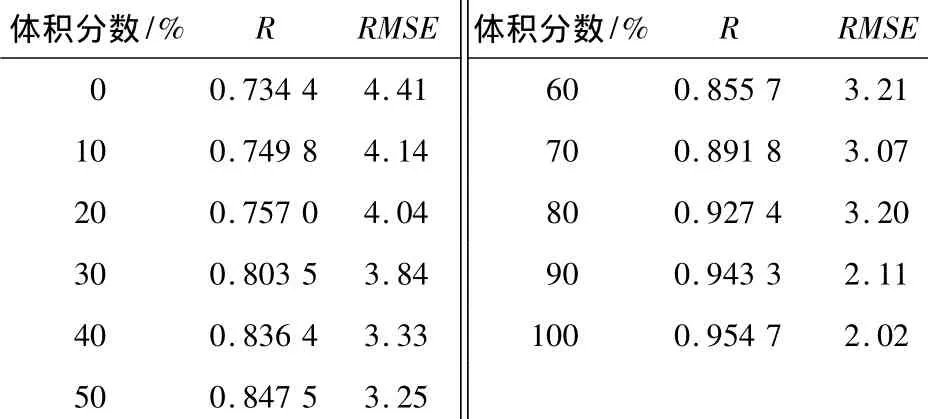
表3 体积分数0~100%的温度模型结果
3 结论
文中建立的乙醇水溶液联合模型性能较稳定,能够满足不同温度下乙醇水溶液体积分数的测定,满足实际在线检测的需要.进一步研究温度与乙醇水溶液的近红外拉曼光谱的关系,建立的11个温度PLS模型的相关系数R值在0.734 4和0.954 7之间,并且随着乙醇体积分数变大,R值越来越大.说明温度对不同体积分数下的拉曼光谱具有影响,并且温度随乙醇体积分数的增大对拉曼光谱的影响加大.
References)
[1] Sikorska A,Ponikwicki N,Koniecko A,et al.Comparative studies of the mixing effect on the thermal effusivity,compressibility,and molar volume for aqueous solutions of alcohols[J].IntJThermophys,2010,31(1):131-142.
[2] AlaviS,Takeya S,Ohmura R,et al.Hydrogen-bonding alcohol-water interactions in binary ethanol,1-propanol,and 2-propanol+methane structure II clathrate hydrates[J].TheJournalofChemicalPhysics,2010,133(7):1-6.
[3] Mandal A,Prakash M,Kumar R M,et al.Ab initio and DFT studies on methanol water clusters[J].JPhys ChemA,2010,114(6):2250-2258.
[4] 贾丽华,王一丁,曲冠男,等.激光诱导等离子体对水团簇受激拉曼散射的影响[J].红外与毫米波学报,2012,31(4):375-378.Jia Lihua,Wang Yiding,Qu Guannan,et al.Influence of laser-induced plasma on Raman scattering of water cluster[J].JInfraredMillimWaves,2012,31(4):375-378.(in Chinese)
[5] 张洪波,宿德志,何焰蓝.用傅里叶变换拉曼光谱法测定乙醇浓度[J].分析测试技术与仪器,2007,13(3):190-193.Zhang Hongbo,Su Dezhi,He Yanlan.Determination of ethanol concentration using FT-Raman spectroscopy[J].AnalysisandTestingTechnologyandInstruments,2007,13(3):190-193.(in Chinese)
[6] 吴 斌,骆晓森,陆 建,等.用激光拉曼频移测定乙醇水溶液的浓度[J].光学精密工程,2011,19(2):392-396.Wu Bin,Luo Xiaosen,Lu Jian,et al.Determination of ethanol concentration of aqueous solution by using Raman stretching frequency shifts [J].OpticsandPrecisionEngineering,2011,19(2):392-396.(in Chinese)
[7] 吴 斌,刘 莹,韩彩芹,等.用激光拉曼光谱研究液态乙醇的水合作用过程[J].光谱学与光谱分析,2011,31(10):2738-2741.Wu Bin,Liu Ying,Han Caiqin,et al.Hydration of liquid ethanol probed by Raman spectra[J].SpectroscopyandSpectralAnalysis,2011,31(10):2738-2741.(in Chinese)
[8] 李 响,吕 勇.拉曼光谱检测酒精浓度的背景扣除技术研究[J].北京信息科技大学学报:自然科学版,2013,28(2):27-30.Li Xiang,Lü Yong.Background subtraction in Raman measurement of ethanol concentration[J].Journalof BeijingInformationScienceandTechnologyUniversity:NaturalScienceEdition,2013,28(2):27-30.(in Chinese)
[9] 廖艳林,刘 晔,曹 杰,等.一种基于光纤器件的表面增强拉曼散射光谱检测系统[J].中国激光,2012,39(7):215-219.Liao Yanlin,Liu Ye,Cao Jie,et al.A kind of surface enhanced Raman scattering spectroscopy detection system based on optical devices[J].ChineseLaser,2012,39(7):215-219.(in Chinese)
[10] 刘文涵,吴小琼,杨 未,等.环境光对 PE塑料薄膜近红外激光拉曼光谱的影响[J].光谱实验室,2006,23(6):1135-1138.Liu Wenhan,Wu Xiaoqiong,YangWei,et al.Influence of environment light on the near-infrared laser Raman spectrum of PE plastic film [J].ChineseJournalof SpectroscopyLaboratory,2006,23(6):1135-1138.(in Chinese)
[11] 刘文涵,吴小琼,郑建珍,等.环境光对谷氨酸钠溶液近红外激光拉曼光谱的影响[J].光谱学与光谱分析,1994,26(12):2244-2246.Liu Wenhan,Wu Xiaoqiong,Zheng Jianzhen,et al.Studies of influences of environmental light on near infrared laser Raman spectra of sodium glutamic acid solution [J].SpectroscopyandSpectralAnalysis,1994,26(12):2244-2246.(in Chinese)
[12] 刘文涵,汪涓涓,张 丹.外界光对 ZnCl2溶液近红外激光拉曼光谱的影响[J].光谱实验室,2009,26(5):1141-1144.Liu Wenhan,Wang Juanjuan,Zhang Dan.Studies of near-infrared laser Raman spectra of ZnCl2solution effected by environmental light[J].SpectroscopyLaboratory,2009,26(5):1141-1144.(in Chinese)
[13] 冯尚源,陈 荣,李永增,等.人血红细胞傅里叶变换红外和近红外拉曼光谱[J].光谱学与光谱分析,2005,25(5):712-714.Feng Shangyuan,Chen Rong,Li Yongzeng,et al.Fourier transform infrared and near infrared Raman spectra of human red blood cell[J].SpectroscopyandSpectral Analysis,2005,25(5):712-714.(in Chinese)
[14] 马寒露.表面增强拉曼光谱快速检测孔雀石绿技术研究[D].镇江:江苏大学食品与生物工程学院,2009.
[15] 刘仁明,刘瑞明,武延春,等.基于新型NIR-SERS基底的肝癌血清 NIR-SERS光谱研究[J].光学学报,2011,31(6):270-275.Liu Renming,Liu Ruiming,Wu Yanchun,et al.Investigations on NIR-SERS spectra of serum for liver cancer based on NIR-SERS substrate[J].ActaOpticaSinica,2011,31(6):270-275.(in Chinese)
[16] 黄晓玮,邹小波,赵杰文,等.近红外光谱结合蚁群算法检测花茶花青素含量[J].江苏大学学报:自然科学版,2014,35(2):165-170.Huang Xiaowei,Zou Xiaobo,Zhao Jiewen,et al.Measurement of anthocyanin content in flowering tea using near-infrared spectroscopy combined with ant colony optimization[J].JournalofJiangsuUniversity:Natural ScienceEdition,2014,35(2):165-170.(in Chinese)
[17] 邹 晗,郑晓燕,潘玉莲.乙醇和甲醇混合溶液的拉曼光谱法研究[J].大学物理实验,2005,18(4):1-6.Zou Han,Zheng Xiaoyan,Pan Yulian.A research on Raman spectroscopy of mixed liquor of ethanol and methanol[J].PhysicalExperimentofCollege,2005,18(4):1-6.(in Chinese)
