常压室温等离子体诱变选育高产四甲基吡嗪地衣芽孢杆菌
2015-09-29丁雪梅王瑞明肖冬光天津科技大学生物工程学院天津300457齐鲁工业大学轻工学部山东济南50353
孟 武,丁雪梅,王瑞明,肖冬光*(.天津科技大学生物工程学院,天津300457;.齐鲁工业大学轻工学部,山东济南50353)
常压室温等离子体诱变选育高产四甲基吡嗪地衣芽孢杆菌
孟武1,2,丁雪梅1,王瑞明2,肖冬光1*
(1.天津科技大学生物工程学院,天津300457;2.齐鲁工业大学轻工学部,山东济南250353)
地衣芽孢杆菌(Bacillus lincheniformis)可以利用葡萄发酵产生四甲基吡嗪,四甲基吡嗪广泛应用于食品、临床和其他领域。该文以地衣芽孢杆菌BL1为出发菌株,采用常压室温等离子体诱变系统进行诱变,根据脱脂奶粉平板初筛、摇瓶发酵复筛,连续传代培养后得到遗传稳定的四甲基吡嗪产量较高的突变株BT12,该菌株摇瓶发酵生产四甲基吡嗪的最大产量为43.16 g/L,相比出发菌株的37.89 g/L的提高了13.91%。
常压室温等离子体诱变系统;地衣芽孢杆菌;四甲基吡嗪;选育
四甲基吡嗪(tetramethylpyrazine,TTMP)又名川芎嗪,是中药川芎中的有效活性成分[1-2],在治疗脑血管、肺水肿、胃溃疡、肾脏疾病方面有显著疗效,作为常备药品广泛应用于临床。TTMP又是一种重要的呈香物质,天然存在于可可豆、茶、牛羊猪肉、奶酪、咖啡、花生、坚果、白酒中,具有烤肉、烤面包等香气,GB2760—2014《食品添加剂使用标准》规定其为允许使用的食用香料,被美国食品香料和萃取物制造者协会风味和提取制造委员会(Flavour Extract Manufacturers'Association,FEMA)认定为公认安全物质(generallyrecognizedassafe,GRAS),可作为食品中的调味剂[3]。在白酒酿造中TTMP是其风味形成的重要物质,对白酒质量和保健效果有重要影响[4-5]。目前,TTMP主要通过微生物发酵、直接提取和化学合成3种方法进行。吡嗪类物质的化学合成法主要有Strecker降解化学法、美拉德反应以及非Strecker降解化学法,但是此方法生产TTMP普遍存在设备要求较高、反应条件剧烈、环境污染严重、产品非天然等问题。直接提取法主要是从稀少的药用植物川芎中提取,但是由于来源有限和提取成本过高而无法进行工业化大规模生产。与以上两种方法相比,微生物发酵法具有无污染、安全性高、应用性强等优点。
目前,乳酸乳球菌乳酸亚种(Lactococcuslactissubsp. lactisbiovar.diacetylactisFC1)[6]、谷氨酸棒杆菌(Corynebacterium glutamicum)突变株[7]和枯草芽孢杆菌(Bacillus subtilis)[8-9]是微生物发酵法生产TTMP的主要菌株,也有利用红曲霉[10]生产四甲基吡嗪的相关报道。但是,利用地衣芽孢杆菌生产TTMP的研究较少,相关研究表明,地衣芽孢杆菌野生菌株可以通过发酵代谢生成较低量的四甲基吡嗪(mg/L)[11]。对发酵温度、培养基组分和pH值进行优化可以提高四甲基吡嗪的产量,但产物达到一定浓度后会对整个反应过程造成抑制。
常压室温等离子体诱变系统(atmospheric and room temperature plasma,ARTP)具有操作简单、成本低、诱变效果好、成功率高等优点[12-13],是常用的微生物育种技术。研究表明,该技术可以快速诱变酵母、霉菌、微藻等微生物,并且可以在较短的时间内获得遗传稳定性优良的突变株[14-15]。所以本研究利用ARTP对TTMP产生菌——地衣芽孢杆菌(Bacillcus lincheniformis)BL1进行诱变,以期建立常压室温等离子体诱变和平板筛选四甲基吡嗪高产菌株的方法,并对突变株进行遗传稳定性试验,最终获得四甲基吡嗪产量较高、遗传稳定性好的菌株。
1 材料与方法
1.1材料与试剂
地衣芽孢杆菌(Bacillcus lincheniformis)BL1:齐鲁工业大学轻工学部王瑞明教授提供。
无水葡萄糖(分析纯)、蛋白胨(分析纯):天津市北方北方天医化学试剂厂;酵母粉(分析纯):安琪酵母股份有限公司;磷酸氢二铵(分析纯)、无水乙醇(色谱纯)、氯化钠(分析纯)、TTMP(色谱纯):天津市天达化工实验厂。
脱脂牛奶筛选培养基:蛋白胨10 g/L,氯化钠5 g/L,牛肉膏3 g/L,脱脂奶粉15 g/L,pH调至7.0~7.5,固体培养基加20 g/L琼脂粉。120℃灭菌25 min。
LB种子液体培养基:氯化钠10 g/L,酵母浸粉5 g/L,蛋白胨10 g/L,pH调至7.0,120℃灭菌25 min。
LB种子固体培养基:氯化钠10 g/L,酵母浸粉5 g/L,蛋白胨10 g/L,培养基加2 g/L琼脂粉,pH调至7.0,120℃灭菌25 min。
酵母蛋白胨葡萄糖(yeast peptone glucose,YPG)发酵培养基:蛋白胨30 g/L,葡萄糖70 g/L,酵母浸粉10 g/L,磷酸氢二铵30 g/L,pH调至7.5,120℃灭菌25 min。
1.2仪器与设备
GC7890A气相色谱仪配7697A顶空固相微萃取(head space-solidphasemicroextraction,HS-SPME)装置、GC-6890 NPD氮磷检测器:美国Agilent科技有限公司;ARTP诱变系统:北京思清源生物科技有限公司;UV-722紫外分光光度计:上海欣茂仪器有限公司。
1.3方法
1.3.1培养方法
种子培养:无菌条件下接种一环活化好的目标菌株于250 mL三角瓶中(含有50 mL种子培养基),200 r/min、37℃培养12h。然后按接种量2%(V/V)接到250mL三角瓶中(装有50mL含10 g/L葡萄糖的LB种子液体培养基),200 r/min、37℃培养12 h。
发酵培养:取培养后的种子悬液按4%的接种量(V/V)接种到装有200 mL含70 g/L葡萄糖的YPG培养基的500 mL三角瓶中,37℃、200 r/min振荡培养8 d。期间每12 h补加5 mL质量浓度为1 mg/mL的葡萄糖溶液。
1.3.2诱变与突变株选育
细胞生物量的估算:将菌种接种于LB种子液体培养基,37℃、200r/min摇瓶培养,每隔1h取样,测定菌液的OD600nm,并取样,离心,稀释适当倍数后涂布平板,计算该吸光度下对应的菌落数,记录数据。
菌悬液的制备:从平板挑一环活化后的菌种接于液体种子培养基中,37℃、200 r/min培养至对数生长期的中后期,取1 mL菌液测其OD600nm,根据OD600nm及菌落数的大体关系估算菌体浓度,取1 mL菌液8 000 r/min离心2 min,收集沉淀并用生理盐水洗涤2~3次,将其稀释至106CFU/mL的菌悬液。
ARTP诱变:取上述菌悬液滴加到载片表面,滴加量为10 μL,后至ARTP诱变系统中诱变,诱变条件见表1。

表1 ARTP照射条件Table 1 Irradiation conditions of ARTP
将上步骤中经诱变处理的载片置于装有1 mL无菌生理盐水的1 mL离心管中,剧烈振荡,洗脱载片上的菌液。将所得的菌悬液做7次10倍梯度稀释,分别取200μL涂布到LB种子固体培养基上,每个梯度涂布5个平板做平行,未经诱变的载片作为对照组,在相同的操作和培养条件下培养,进行活菌计数。
突变株初筛:取诱变后的菌悬液稀释涂布于筛选培养基平板,37℃培养24 h,根据透明圈的大小(吡嗪环上的氮原子来自氨基酸代谢来源的氨,微生物自身分泌的蛋白酶分解发酵培养基中的大分子蛋白质产生氨基酸,透明圈的大小显示了菌株分泌蛋白酶,进而分解蛋白质生成氨基酸的能力)及菌落差异挑选菌株,于LB种子固体培养基斜面4℃保存。
突变株复筛:从筛选平板初筛中挑选透明圈菌落直径比较大的突变株接入种子培养液,按照1.3.1所述的方法进行种子培养,后将种子液接入发酵培养基,按1.3.1所述的方法进行发酵培养。发酵结束后,所得发酵液进行TTMP产量的分析检测,TTMP产量最高的菌株即为所要得到的最佳突变株。
突变株遗传稳定性分析:将复筛所得突变株连续7代传代培养,并将各代分别进行相应的种子液制备及发酵培养,通过比较TTMP的产量变化来测定突变株的遗传稳定性。
菌株形态观察:将复筛及遗传稳定性测定后的目的菌株制成种子液,适当倍数稀释后按照初筛中的平板涂布条件进行培养和菌落形态特征观察,并对菌落生长情况进行拍照记录。
1.3.3分析方法
(1)致死率计算
对处理过的样品在适当的稀释度下涂板,通过菌落数来计算致死率,并获得致死曲线。致死率计算公式如下:
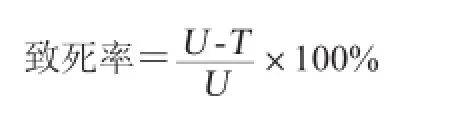
式中:U为不经过诱变处理对照菌的总菌落数,CFU;T为经诱变处理后对应的总菌落数,CFU。
(2)TTMP的测定
顶空条件:平衡温度65℃,定量环温度80℃,传输线温度100℃,平衡时间30 min,压力平衡时间0.1 min,进样时间0.5 min,样品瓶压力100 kPa。
气相色谱条件:进样口温度250℃,分流比0.5∶1,色谱柱型号为HP-INNOWax(30 m×250 μm×0.25 μm),流速为1mL/min,柱箱升温程序为50℃保持2min后,以5℃/min升至180℃保持3 min,然后以15℃/min升至230℃保持5 min。检测器温度250℃。
(3)细胞生长量的测定
用紫外分光光度计对细胞生长的OD600nm值进行监测。
2 结果与分析
2.1致死率曲线的绘制
诱变结束后根据菌种致死率绘制致死率曲线(图1)。
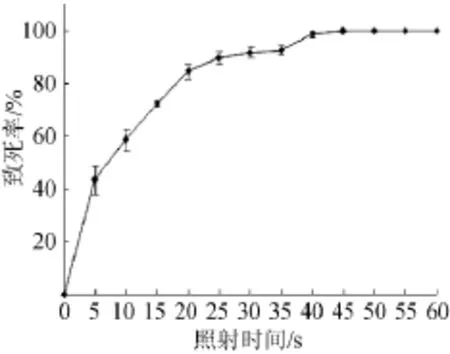
图1 不同ARTP照射时间下的致死率曲线Fig.1 Lethality curve of strains with different treatment time
由图1可见,菌体致死率随着照射时间的增加而增大。等离子体对该地衣芽孢杆菌的杀伤力比较强,处理30s即可杀死90%的菌体,当照射55 s时菌体致死率达到100%。由现代育种理论可知,菌体致死率在90%~95%时正向突变率最高。因此,本实验选择提高菌体正向突变率,致死率为92.65%的最佳诱变照射时间35 s。
2.2突变株初筛
出发菌株BL1诱变结束后,将菌悬液稀释一定浓度后涂布到脱脂奶粉培养基上进行初筛,培养一段时间后挑选菌落形态好、透明圈较明显的菌落120个。然后将活化后的突变菌涂布到筛选培养基上并与出发菌株进行对比,选取透明圈直径与菌落直径比值较大的20株菌,测量并记录各自的R值见表2。
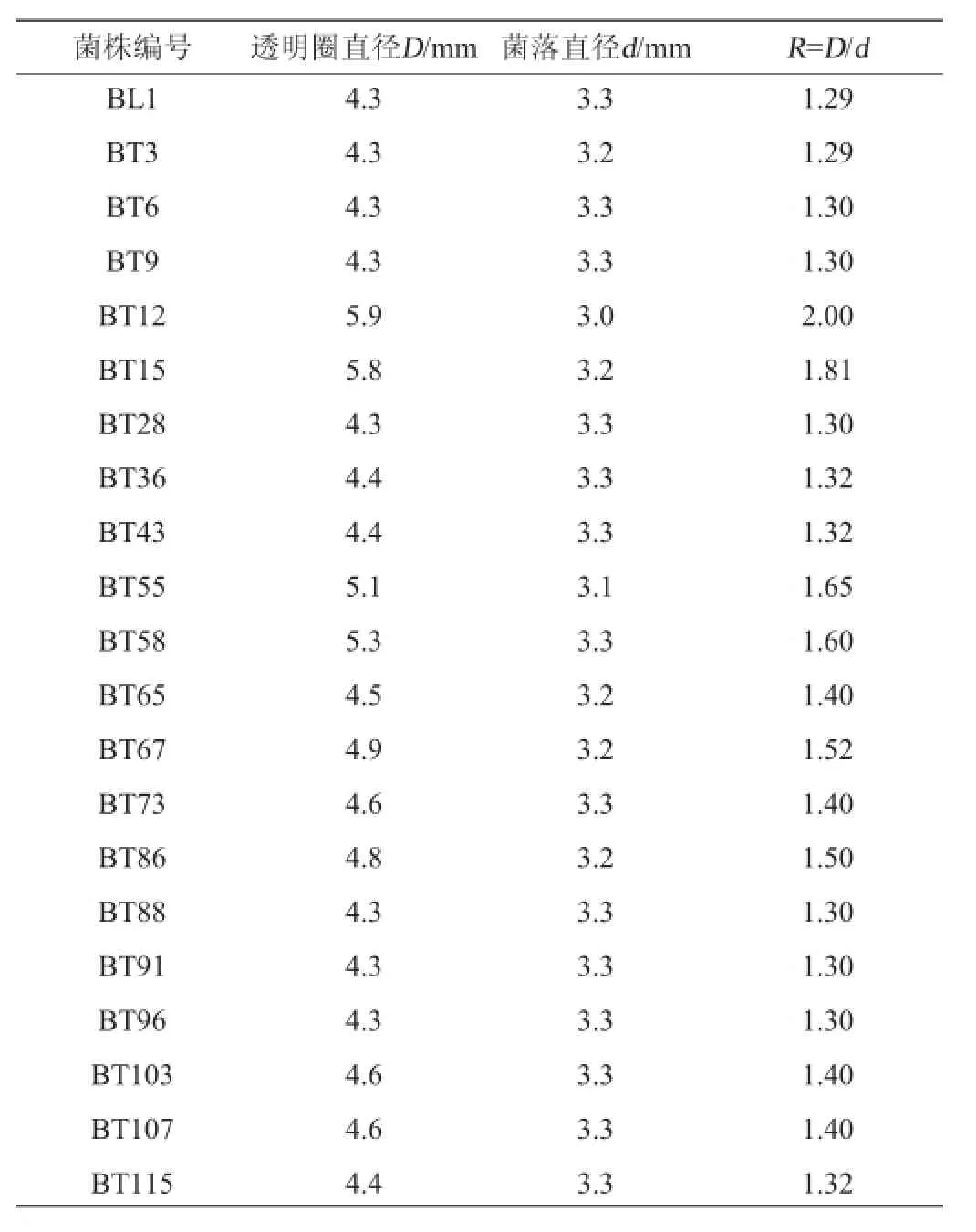
表2 BL1菌株与突变株的R值Table 2 The R values of strain BL1 and mutant strains
由表2可知,突变株透明圈菌落直径比R比出发菌株都大,表明菌株分泌蛋白酶分解蛋白质产生氨基酸的能力均比出发菌株强,其中突变株BT12、BT15、BT55、BT58、BT67、BT86这6株R值与出发菌株区别较大。
2.3摇瓶发酵复筛
将表2中所有突变株接种到YPG发酵培养基中进行复筛,结果见图2。

图2 突变株摇瓶复筛四甲基丙嗪产量Fig.2 TTMP production of the mutants strains in shake flask screening
由图2可知,14株突变株摇瓶发酵产量比BL1高,说明以高产蛋白酶作为筛选高产TTMP枯草芽孢杆菌的依据是可行的。其中,突变株BT12、BT15、BT55、BT58、BT67、BT86这6株透明圈菌落直径比R比出发菌株区别较大,且产量较出发菌株产量高得明显,因此本实验选择这6株TTMP产量较高且差异明显的菌株进行遗传稳定性分析。
2.4突变株遗传稳定性分析
对突变株进行遗传稳定性分析,连续培养7代以上,以剔除突变株在传代过程中出现菌株的“衰退”现象的菌株。
用LB培养基斜面分别将突变株BT12、BT15、BT55、BT58、BT67、BT86这6株传代培养7代,并将各代菌株制成种子液,然后接种到YPG发酵培养基上摇瓶发酵培养,结果如图3所示。
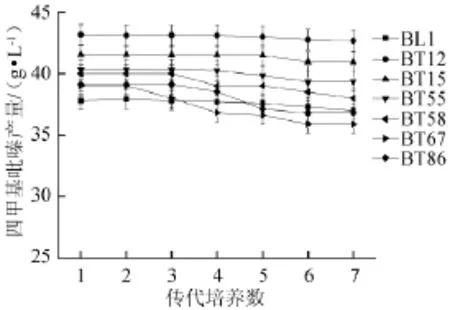
图3 突变株的遗传稳定性Fig.3 Genetic stability of mutant strains
由图3可知,筛选出的6株突变株连续传代7代的情况各不相同,其中,BT55、BT58、BT67、BT86连续传代7代后均出现了产量下降的现象,表现了遗传的不稳定性。突变株BT12的四甲基吡嗪产量比其他5株都高,其摇瓶发酵产量为43.16 g/L,比出发菌株提高了13.91%,且连续传代7代内的产量较稳定,说明该突变株在传代过程中具有良好的遗传稳定性。从工业生产的角度分析,能满足生产性能稳定的要求,即相同的生产条件下菌株性能保持不变。因此,综合考虑,选择产量高且遗传稳定的突变株BT12作为后续实验的出发菌株。
2.5菌落形态观察
微生物突变株的获得往往伴随着菌落形态的变化,出发菌株BL1未经诱变时菌落呈白色叶片状,菌落表面呈淮状;BL1经ARTP诱变后得到的突变株BT12颜色和菌落形态均发生变化,呈粉色或微黄褶皱状,表面粗糙不光滑,即诱变造成了菌落性状的明显变化。
3 结论
本研究表明,ARTP诱变育种方法能够有效的诱变地衣芽孢杆菌BL1菌株,脱脂奶粉平板初筛结合摇瓶发酵复筛,筛选出一株TTMP产量升高的地衣芽孢杆菌突变株BT12,该突变株摇瓶发酵产量为43.16 g/L,比出发菌株提高了13.91%。遗传稳定性分析试验表明该菌株连续转接7代后产量较稳定。说明常压室温等离子体诱变系统(ARTP)能引起地衣芽孢杆菌BL1的基因突变,但是突变株BT12四甲基吡嗪产量提高的原理尚不清楚,有待进一步研究。
[1]赵德义,汤丹丹,曹建全,等.产四甲基吡嗪微生物菌株的选育[J].中国酿造,2015,34(3):102-106.
[2]王国明,尹婉嫱,乔阳,等.浓香型“山庄老酒”中吡嗪类物质的分析研究[J].中国酿造,2015,34(4):146-149.
[3]ADAMS T,DOULL J,FERON V,et al.The FEMA GRAS assessment of pyrazine derivatives used as flavor ingredients[J].Food Chem Toxicol,2002,40(4):429-451.
[4]康文怀,徐岩.中国白酒中风味分析及其影响机制的研究[J].北京工商大学学报,2012,30(3):53-58.
[5]王慧君,葛霞,田世龙,等.马铃薯及其蒸馏酒香气成分的鉴定[J].食品工业科技,2015,36(15):270-274,280.
[6]KIM K H,LEE H J,SHON D H,et al.Optimum conditions for the production of tetramethylpyrazine flavor compound by aerobic fed-batch culture ofLactococcuslactissubsp.lactisbiovar.diacetylactisFC1[J].J Microbiol Biotechn,1994,4(4):327-332.
[7]DEMAIN A L,JACKSON M,TRENNER N R.Thiamine-dependent accumulation of tetramethylpyrazine accompanying a mutation in the isoleucine-valine pathway[J].J Bacteriol,1967,94(2):323-326.
[8]董丹,车振明,关统伟.白酒酒糟中产纤维素酶菌株的筛选及其酶活力特性检测[J].中国酿造,2015,34(8):44-48.
[9]YAMAGUCHI N,TODA T,TERAMOTO T,et al.Effect of sugars on microbiological pyrazine formation byBacillus nattoin synthetic liquid medium[J].J Jpn Soc Food Sci,1993,40(12):841-848.
[10]吴晶晶.红曲霉(Monascus.spp)产生川芎嗪的发酵工艺条件研究[D].杭州:浙江大学硕士论文,2011.
[11]张荣.产酱香功能细菌的筛选及其特征风味化合物的研究[D].无锡:江南大学硕士论文,2009.
[12]LI H P,LI G,SUN W T.Radio-frequency,atmospheric-pressure glow discharges:producing methods,characteristics and applications in biomedical fields[M].COMPLEX SYSTEMS:5th International Workshop on Complex Systems.AIP Conference Proceedings,2008.
[13]LI G,LI H P,WANG L Y,et al.Genetic effects of radio-frequency,atmospheric pressure glow discharges with helium[J].Appl Phys Lett,2008,92(22):221504.
[14]WANG L Y,HUANG Z L,LI G,et al.Novel mutation breeding method forStreptomyces avermitilisusing an atmospheric pressure glow discharge plasma[J].J Appl Microbiol,2010,108(3):851-858.
[15]王立言.常压室温等离子体对微生物的作用机理及其应用基础研究[D].北京:清华大学硕士论文,2010.
Screening ofBacillus lincheniformiswith high-yield tetramethylpyrazine by atmospheric room temperature plasma mutation
MENG Wu1,2,DING Xuemei1,WANG Ruiming2,XIAO Dongguang1*
(1.College of Biological Engineering,Tianjin University of Science and Technology,Tianjin 300457,China;2.Faculty of Light Industry,Qilu University of Technology,Jinan 250353,China)
Bacillus lincheniformiscan produce tetramethylpyrazine(TTMP)by glucose fermentation,TTMP is widely used in food,clinical application and other fields.UsingB.lincheniformisBL1 as original strain,based on skim milk powder preliminary screening,shake flask fermentation screening,a genetic stable mutant strain BT12 was obtained by atmospheric and room temperature plasma treatment.Compared to the original strain,the maximum TTMP yield increased from 37.89 g/L to 43.16 g/L,which increased by 13.91%.
ARTP;Bacillcus lincheniformis;TTMP;breeding
TS201.3
A
0254-5071(2015)11-0031-04
10.11882/j.issn.0254-5071.2015.11.008
2015-09-25
国家高技术研究发展计划‘863计划'(2012AA022108);山东省科技发展计划(2014GSF121008)
孟武(1983-),男,讲师,硕士,研究方向为微生物发酵。
肖冬光(1956-),男,教授,博士,研究方向为现代酿造技术。
