CT导引下微波消融治疗少血供型肝癌的临床应用
2015-09-27左太阳许淑玲张忠涛刘宗花张楠
左太阳,许淑玲,张忠涛,刘宗花,张楠
原发性肝癌是常见的严重威胁我国人民生命的恶性肿瘤之一[1],由于起病隐匿,进展快,临床多数患者确诊时,已失去手术切除的机会。经皮肝动脉化学栓塞术(transcatheter arterial chemoembolization,TACE)是治疗这些不能切除肝癌的首选方法,但TACE治疗肝癌的疗效受到许多因素的制约,肿瘤的血液供应情况是重要的因素之一[2-3]。微波消融术作为肝肿瘤的微创治疗方法,创伤小、疗效确切,越来越受到较为广泛的应用,且已逐渐成为肝癌非手术治疗的一种常用手段。据文献报道,微波消融术治疗早期肝癌可以达到手术切除的效果[4-5]。本文回顾性分析2006年6月-2013年2月的36例少血供肝癌患者CT引导下微波消融的疗效。
材料与方法
1.临床资料
本组36例患者治疗前均经穿刺活检病理证实为肝细胞癌,男23例,女13例,年龄37~74岁,平均58.2岁。所有患者均经螺旋CT三期增强扫描,动脉期肿瘤呈无或轻度增强,门静脉期强化不明显,延迟期呈等或低密度(图1a,b)。36例共46个病灶,其中单发病灶30例,2~3个病灶者6例(共16个病灶),肿瘤最大径为2.2~6.5cm,平均(4.3±2.2)cm。36例患者术前乙肝表面抗原均为阳性,AFP均增高,为30.6~3000μg/mL。27例患者有肝硬化病史3~11年,其中19例合并脾功能亢进;肝功能Child-Pugh评分A级31例,B级5例,36例患者均未见门静脉癌栓。
2.仪器和设备
采用Philips 64排螺旋CT,微波治疗仪为南京福中生产 METI-IVD 型,冷循环微波针为 MTC-150-2.0,18G穿刺针。
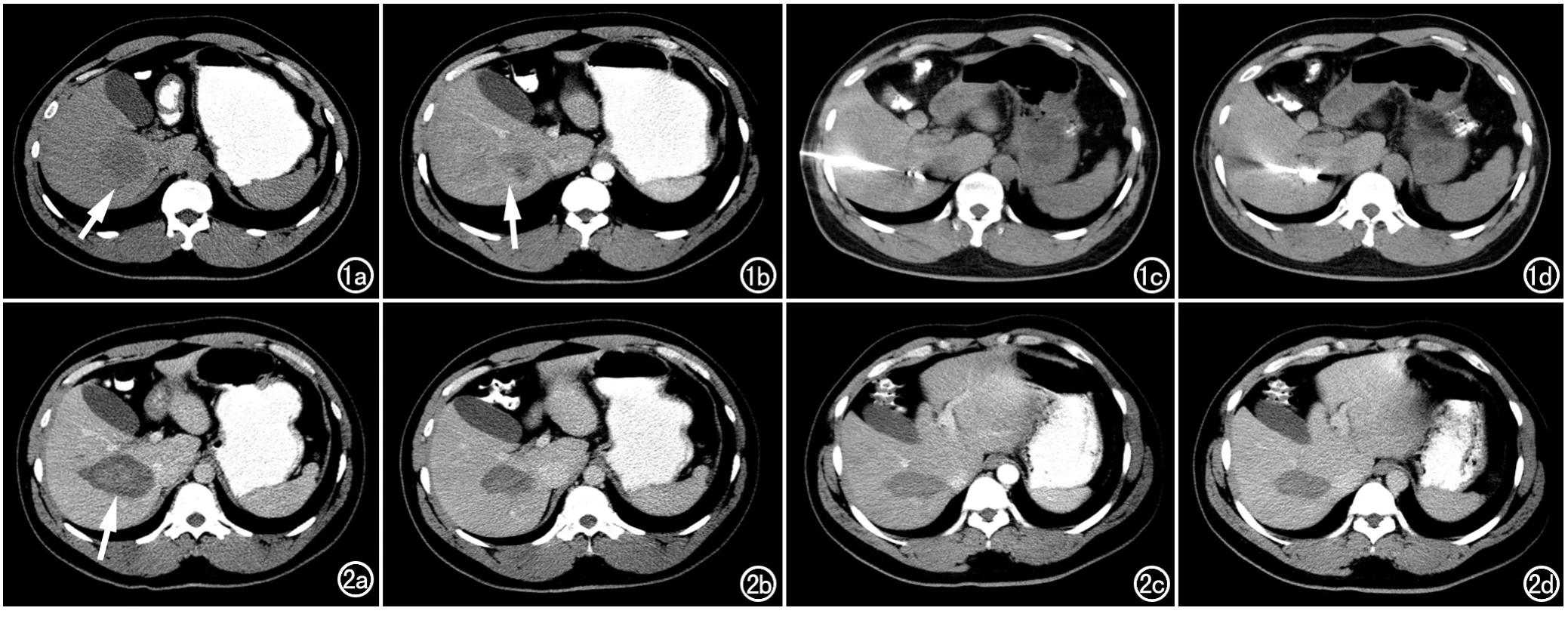
图1 男,59岁,肝癌。a)CT平扫示少血供肝癌(箭);b)CT增强动脉期示少血供肝癌(箭);c)微波针刺入肝右叶病灶内;d)微波治疗病灶后。 图2 a)术后3个月CT复查图像,病灶无强化(箭);b)术后6个月CT复查图像;c)术后12个月CT复查图像;d)术后24个月CT复查图像。
3.治疗方法
患者取仰卧、侧卧或俯卧位,术前反复训练同一呼吸时相屏气动作,尽量使膈肌位置在多次扫描中保持一致,双臂交叉上举于头部。用自制栅栏定位,穿刺路径避免经过较大血管。治疗前结合增强CT显示的肿块的大小,形态及其与周围血管、组织结构和重要脏器的关系,确定并标记微波针进入瘤体的穿刺点及使用微波针的数量、路线,病灶最大径线<3cm者可选择单个微波针治疗,病灶最大径线3.0~6.5cm者可选择双微波针进行治疗,常规消毒、铺无菌巾,采用局部浸润麻醉或基础麻醉加局部浸润麻醉,壁层腹膜充分浸润麻醉,破皮0.5cm,在CT导引下将微波针缓缓刺入靶点(图1c,d),针尖穿出瘤体0.5~1.0cm,实时CT扫描,确认位置符合设计后,启动冷循环系统,选择输出功率为60~80W,每点作用时间6~20min,改变进针方向,多点作用,力求使微波消融范围完全覆盖肿瘤。治疗后以输出功率为10W进行针道消融并拔出微波针。靠近膈顶部肿瘤,采用倾斜穿刺技术,从足侧向头侧穿刺,尽量避免经肺、经膈肌穿刺;靠近胆囊、胃肠道等危险器官的肿瘤病灶,尽量平行于脏器穿刺,并于靠近危险脏器的病灶边缘适时测温;19个病灶于消融术中注射无水乙醇3~16mL作为补充治疗。消融完成后,常规应用CT增强验证肿瘤完全消融。术后常规心电监护24h,吸氧12h,禁饮食6h,并予以护肝、止痛、对症支持治疗3~7d。
4.疗效评价标准
术后3、6、12和24个月行血甲胎蛋白(AFP)及生化常规检查,并通过复查增强CT随访肿瘤(图2),观察其变化情况,评价疗效。以改良RECIST为标准通过影像观察肿瘤变化情况,分析局部控制率[6]。改良RECIST分为:完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。有效率(RR)计算公式为:RR=CR+PR[7]。并统计治疗后3、6、12和24个月患者生存率。
结 果
本组36例患者46个病灶穿刺成功率100%,均完成消融治疗,4例患者于6~24个月死亡。19例患者术中感觉肝区发热、疼痛;12例患者感觉右肩区疼痛;7例患者术中出现恶心;3例患者轻度胸闷;29例患者出现术后发热,37.5℃~39.0℃,持续1~7d;3例出现肝包膜下少量积血,7例出现右侧少量胸腔积液,均自行吸收;1例出现呃逆,予以中药、针灸治疗后缓解;无气胸、无膈肌穿孔、无胆囊或胃肠道穿孔、无大出血、无肝脓肿,未见针道转移。本组36患者治疗后,AFP变化情况、局部控制RR见表1~2。
生存率情况:本组56患者治疗后3、6、12和24个月生存率依次是:100%(36/36)、100%(36/36)、94.4%(34/36)和88.9%(32/36)。

表1 本组36患者治疗后3月、6月、12月、24月甲胎蛋白(AFP)变化情况(%)
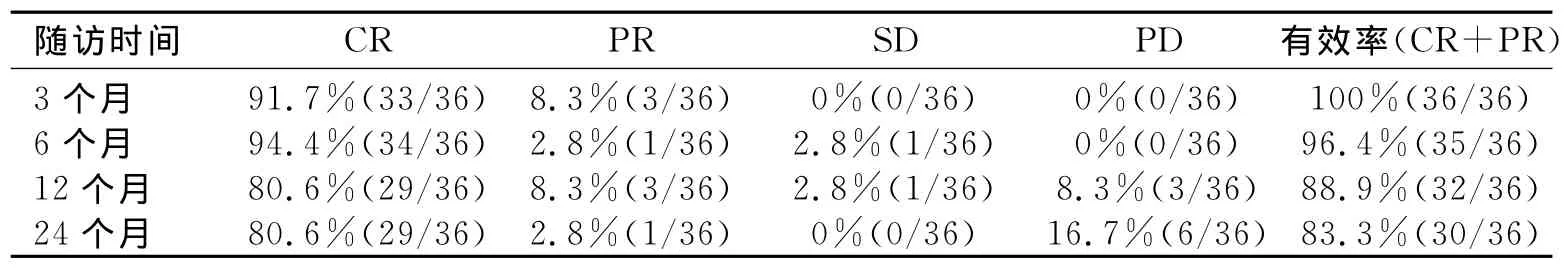
表2 本组36患者治疗后3月、6月、12月、24月CT复查显示局部控制情况(%)
讨 论
1.区分肝癌血供对介入治疗的意义
肝癌的生长方式取决于其组织内血管的生成[8-9],对肝癌的供血血管及血供情况的准确判断是诊断肝癌并判断预后的重要前提,对肝癌的个体化治疗具有指导意义。随着影像学的发展,术前区分少血供肝癌和富血供肝癌以及混合型肝癌已经具有可行性,结合穿刺活检病理学诊断,就更有助于明显诊断。少血供肝癌约占肝癌总数的15%~16%[10],采用TACE治疗其生存率明显低于富血供肝癌。从病理角度,少血供肝癌组织结构坚硬,富含纤维组织成分,药物不宜渗透,从血液供应角度,少血供肝癌血液供应少于富血供肝癌,化疗药物难以随血液渗透到肝癌组织中,达不到完全控制病灶的效果。王建华等[11]和 Malsui等[12]认为富血供肝癌经过数次TACE可使肿瘤血管逐渐狭窄、中断,化疗药物渗透困难,达不到完全控制病灶的效果。微波消融治疗能够在一定程度上避免这一不利因素。本组资料表明,对于少血供肝癌,微波消融治疗,局部控制率和生存率均较高。
2.CT导引下微波消融治疗少血供肝癌的依据和优势
日本学者Seki等[13]1994年首次报道微波消融成功应用于治疗原发性肝癌,此后微波消融以其创伤小、痛苦少、具有可重复性等优势在肝癌临床治疗中得到很好的应用[14]。董宝玮等[14]报道治疗小肝癌216例,1、3、5 年 生 存 率 分 别 达 到 94.87%、80.44% 和68.63%,取得了可以和外科手术相媲美的远期疗效。微波消融治疗少血供肝癌有以下优点:①热效率高、升温速度快、高温热场较均匀、凝固区坏死彻底,可有效杀灭癌细胞。②充血带窄,受血流影像因素小。③少血供肝癌内纤维组织丰富,血管少,有助于热消融的扩散。④微波消融的肿瘤组织留在体内。可诱发抗瘤细胞的免疫反应等[15]。
另外,CT导引较B超引导具有其独特的优势:膈顶部肿瘤与胸腔相邻,位置狭小,气体回声易影响B超的引导;肥胖及有腹水的患者,B超穿透力受到限制;肝癌靠近胃肠道时B超引导时也易受气体影响,而CT导引定位精确,密度分辨力高,可提高穿刺安全性,有效保护危险组织、器官,避免损伤[16],且可保存较多未被肿瘤累及肝组织,保留肝储备能力;当然,CT扫描有一定的放射性损伤,笔者采取低剂量CT扫描,并且尽量减少扫描次数和扫描范围,从而减少辐射剂量。
3.手术并发症防治
在微波消融治疗少血供肝癌主要有以下不良反应:①术后发热:常出现在手术次日,体温多在38℃~39℃之间,一般持续3~7d。多为肿瘤组织坏死,刺激机体产生。体温超过38.5℃者,予以吲哚美辛栓肛塞,同时注意补充液体量,维持水电解质平衡。②腹部疼痛:多于1~3d后缓解,常规予以镇痛处理。③恶心、呕吐:多因镇痛和迷走神经刺激引起,术前6h禁饮食,可防止窒息,术后6h禁饮食,防止应激性溃疡,术后对症止吐,抑酸处理。④肝功能异常:治疗后1~2d出现转氨酶升高,与肝基础状态和消融坏死范围有关,常规予以保肝治疗。⑤肝被膜下出血和腹腔出血:发生率低,术前应进行呼吸训练,避免肝被膜划伤。⑥胸腔积液:多为反应性积液,且多为肿瘤靠近膈肌时,刺激膈肌、胸膜引起,积液量较大时,可以置管引流。⑦血红蛋白尿[17]:术后常规碱化尿液,保护肾功能,患者体质较弱者,可以考虑分次微波消融。⑧针道种植转移:常规予以针道消融预防。
4.微波消融治疗少血供肝癌的不足
近些年来,微波消融技术在临床的应用不断增加,成为了肝癌治疗的重要手段之一,但是此技术仍然存在许多缺陷,如:不适合数目大于3个的肝癌;对大肝癌的凝固不全;难以消融邻近膈肌、胆囊、胆管等特殊部位的肝癌;操作不当,易损伤周围组织而出现出血、发热、气胸、胆漏等并发症。另外,为提高治疗效果,应将微波消融与其他治疗技术联合治疗肝癌,如可联合TACE、无水酒精注射以及免疫药物注射等。
总之,CT导引下微波消融治疗少血供型肝癌定位准确、疗效可靠,是提高肿瘤局部控制率和生存率的有效方法。
[1]杨秉辉,夏景林,汤钊猷,等.我国肝癌“临床相”30年的变迁-原发性肝癌3250例的对比研究[J].中华医学杂志,2003,83(12):1053-1057.
[2]胡效坤,张福君.CT介入治疗学[M].北京:人民卫生出版社,2012:1056-1059.
[3]Paul SB,Gamanagatti SR,Aneesh MK,et al.Percutaneous ablative therapy for liver carcinoma[J].Natl Med J India,2011,24(6):347-355.
[4]陈建勋,孙昌勤.小肝癌行手术切除与微波热凝固疗效比较[J].四川医学,2007,28(12):1387-1388.
[5]Lencioni R,Llovet JM.Modified(mRECIST)assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30(1):52-60.
[6]神兆玉,王吉明,胡效坤,等.CT引导下多极射频消融治疗少血供型肝癌的研究[J].医学影像学杂志,2011,21(7):1019-1023.
[7]Llovet JM,Di Bisceglie AM,Bruix J,et al.Design and endpoints of clinical trials in hepatocellular carcinoma[J].J Natl Cancer Inst,2008,100(10):698-711.
[8]Vogl TJ,Trapp M,Schroeder T,et al.Transarterial chemoembolization for hepatocellular carcinoma:volumetric and morphologic CT criteria forassessment of prognosis and therapeutic success-results from a liver transplantation center[J].Radiology,2000,214(2):349-457.
[9]贺声.肝癌血管观察的临床病理学意义[J].国外医学肿瘤学分册,1999,26(2):237-239.
[10]程红岩,徐爱民,陈栋,等.根据大肝癌的血供特点确定介入治疗的碘油用量[J].中华肿瘤杂志,2003,25(2):186-189.
[11]王建华,周康荣,顔志平,等.小肝癌的介入治疗研究(附42例报告)[J].中华放射学杂志,2000,34(12):823-826.
[12]Matsui O,Kadoya M,Yoshikawa J,et al.Subsegmental transcatheter arterial embolization for small hepatocellular carcinomas:local therapeutic effect and 5-year survival rate[J].Cancer Chemother Pharmacol,1994,33(1):84-88.
[13]Seki T,Wakabayashi M,Nakagawa T,et al.Ultrasonically guided percutaneous microwave coagulation therapy for small hepatorcellular carcinoma[J].Cancer,1994,74(3):817-825.
[14]刘瑞宝,王强,张立成.经皮微波凝固治疗肝癌的进展[J].中国现代医药杂志,2009,11(9):134-136.
[15]董宝玮,梁萍,于晓玲,等.超声引导经皮微波消融治疗早期原发性肝癌的远期疗效[J].中华医学杂志,2006,86(12):797-800.
[16]梁萍,董宝玮.肝癌微波消融治疗合理选择与评价[J].中国实用外科杂志,2008,(8):615-618.
[17]郭大伟,魏云涛,侯学忠,等.肝癌微波治疗术中出现血红蛋白尿的影响因素[J].现代肿瘤医学,2009,17(3):504-507.