HDAC6、p21WAF1/CIP1和CyclinD1在皮肤鳞状细胞癌中的表达
2015-09-27李广帅刘林嶓
毋 磊,董 斌,李广帅,刘林嶓
(1.郑州市第一人民医院整形外科河南郑州450004;2.郑州大学第一附属医院整形外科河南郑州450052)
·基础研究·
HDAC6、p21WAF1/CIP1和CyclinD1在皮肤鳞状细胞癌中的表达
毋磊1,董斌1,李广帅2,刘林嶓2
(1.郑州市第一人民医院整形外科河南郑州450004;2.郑州大学第一附属医院整形外科河南郑州450052)
目的:检测皮肤鳞状细胞癌(SCC)组织中HDAC6、p21WAF1/CIP1及CyclinD1的表达。方法:采用免疫组织化学SP法检测40例SCC及15例正常皮肤组织中HDAC6、p21WAF1/CIP1及CyclinD1的表达。结果:SCC组织中HDAC6及CyclinD1阳性表达率(70.0%、72.5%)均高于正常皮肤组织(33.3%、40.0%),p21WAF1/CIP1阳性表达率(32.5%)低于正常皮肤组织(66.7%),差异均有统计学意义(P<0.05)。SCC组织中HDAC6与p21WAF1/CIP1表达呈负相关(r=-0.594,P=0.000),HDAC6与CyclinD1表达呈正相关(r=0.330,P=0.038)。结论:HDAC6在SCC中可能通过影响p21WAF1/CIP1及CyclinD1对肿瘤细胞的增殖分化产生影响,为HDAC6抑制剂应用于SCC的治疗提供理论依据。
组蛋白去乙酰化酶6;p21WAF1/CIP1;细胞周期蛋白D1;皮肤鳞状细胞癌
组蛋白的乙酰化和去乙酰化是基因表达过程中重要的调控方式,是转录过程中的关键修饰。研究表明组蛋白乙酰化和去乙酰化与肿瘤的发生和发展有密切的关系。组蛋白乙酰化状态取决于组蛋白乙酰基转移酶(HATs)与组蛋白去乙酰化酶(HDACs)之间的活性竞争。HATs与HDACs之间平衡的紊乱常使基因表达失控[1]。组蛋白去乙酰化酶6(Histone deacetylase 6,HDAC6)通过去除组蛋白的乙酰基和其他转录调控参与肿瘤发生和进展。细胞周期的正常运行,依赖于周期蛋白、周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)和周期蛋白依赖性激酶抑制因子(CDK inhibitor,CDKI)系统,细胞周期失去正常的信息调控而处于紊乱无序的状态导致肿瘤的发生。为了解HDAC6、p21WAF1/CIP1及CyclinD1在SCC中的作用,作者检测了40例SCC组织及正常皮肤组织中HDAC6、p21WAF1/CIP1及CyclinD1的表达,并分析HDAC6与p21WAF1/CIP1及CyclinD1的相关性。
1 材料和方法
1.1标本收集
收集郑州大学第一附属医院病理科2010年9月-2011年3月归档的皮肤鳞状细胞癌蜡块标本40例,男25例,女15例,年龄36~85岁,均有完整的病史资料和明确的组织病理学诊断。所有的病例术前均未接受放疗、化疗以及生物免疫治疗。15例正常皮肤来源于植皮手术修剪剩余的全厚皮片。
1.2主要试剂
HDAC6兔抗人多克隆抗体、p21WAF1/CIP1兔抗人多克隆抗体、CyclinD1兔抗人多克隆抗体和免疫组织化学染色试剂盒均购自北京博奥森生物科技有限公司,DAB显色试剂盒购自北京中杉金桥科技有限公司。
1.3步骤方法
采用免疫组化SP法进行检测,按染色试剂盒步骤操作。HDAC6工作液浓度为1∶200,p21WAF1/CIP1工作液浓度为1∶100,CyclinD1工作浓度为1∶200。
1.4结果判定
细胞质或细胞核呈棕黄色颗粒为阳性细胞,在高倍镜下每张切片随机选取10个视野,每个视野选取200个细胞。(1)按阳性细胞占肿瘤细胞数的百分比评分:阳性细胞数占肿瘤细胞数的25%以下为1分,25%~50%为2分,51%~75%为3分,>75%为4分。(2)按着色程度评分:无显色,0分;浅黄色,1分;棕黄色,2分;棕褐色,3分。取2项积分的乘积为总积分,0~1分为(-),≥2分为(+)。每张切片经两名有经验的病理科医师在光镜下独立完成,当结果不一致时,重新计数。
1.5统计学分析
所有数据采用SPSS 17.0统计软件包行χ2检验及2×2配对资料的关联性分析。检验水准α=0.05。

图1 A正常皮肤HDAC6蛋白表达(IHC×200)
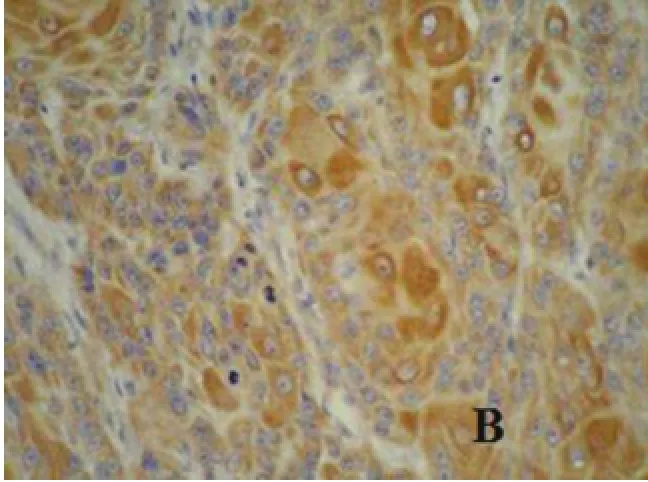
图1 B皮肤鳞状细胞癌HDAC6蛋白表达(IHC×200)
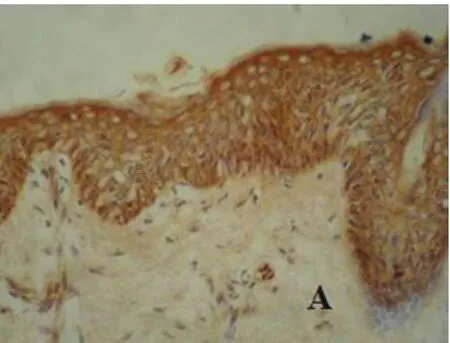
图2 A正常皮肤p21WAF1/CIP1蛋白表达(IHC×200)
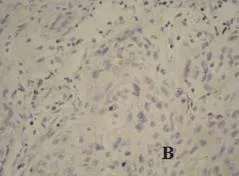
图2 B皮肤鳞状细胞癌p21WAF1/CIP1蛋白表达(IHC×200)
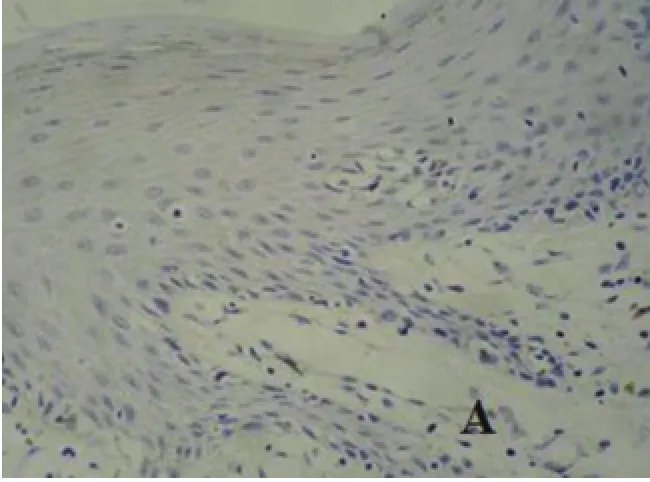
图3 A正常皮肤CyclinD1蛋白表达(IHC×200)
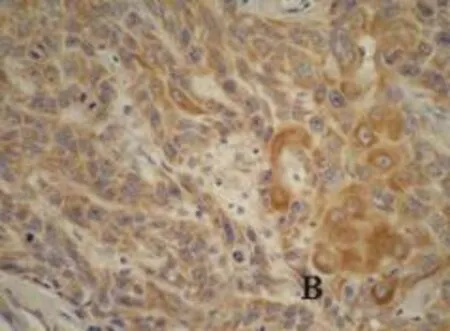
图3 B皮肤鳞状细胞癌CyclinD1蛋白表达(IHC×200)
2 结果
2.1HDAC6、p21WAF1/CIP1及CyclinD1在皮肤鳞状细胞癌及正常皮肤组织中的表达情况。见图1、2、3及表1。
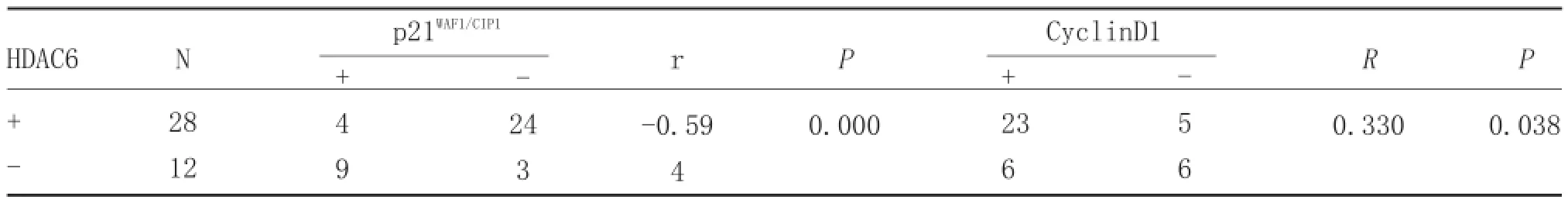
表2 SCC组织中HDAC6与p21WAF1/CIP1及CyclinD1表达的相关性
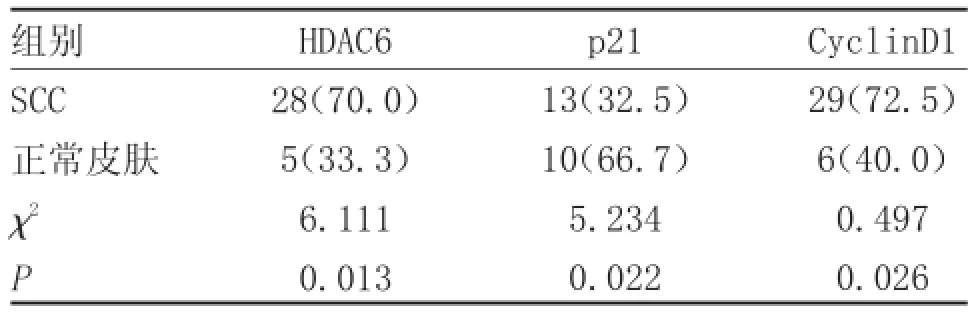
表1 不同组织中HDAC6、p21WAF1/CIP1及CyclinD1的表达情况比较[例(%)]
2.2SCC组织中HDAC6与p21WAF1/CIP1及CyclinD1的相关性。见表2,通过对HDAC6与p21WAF1/CIP1、CyclinD1的关联性分析,证实HDAC6的过表达与p21WAF1/CIP1的表达降低呈负相关关系,与CyclinD1的过表达呈正相关关系。
3 讨论
SCC是常见的皮肤恶性肿瘤,发病率约占全部非黑素细胞癌的20%。研究表明,遗传学和表遗传学(epigenenetics)改变引起癌基因活化和抑癌基因失活是肿瘤发生的核心生物学进程。
HDAC6归于HDACs家族的第Ⅱ类,HDAC6基因定位于X染色体11p23区带,在人体内证实由1216个氨基酸组成[2]。绝大数的HDACs位于细胞核中,但是第Ⅱ类的HDACs能够转移去细胞质中[3]。HDAC6有别于其它HDACs家族成员的重要特点是唯一具有两个催化位点的去乙酰化酶,而其它成员均只有一个催化位点[4-5]。HDAC6在心、肝、肾、脑和胰腺等脏器中呈高表达[2],主要定位于细胞质,同时也发现表达于核周及亚细胞的生长前沿区域,与p150粘连蛋白复合物有关[6]。已报道,HDAC6在口腔鳞状细胞癌、乳腺癌、食管鳞状细胞癌、胃癌、卵巢浆液性囊腺癌等多种恶性肿瘤组织中呈高表达[7-11],本研究中也得出同样的结果,HDAC6在SCC组织中的表达显著高于其在正常皮肤组织中的表达,提示HDAC6的高表达可能在皮肤鳞状细胞癌发生中发挥重要作用。
大量研究表明,HDAC6可能通过与一些转录抑制因子在抑癌基因启动子区域异常的相互作用,造成抑癌基因表达下降,从而参与肿瘤的发生、发展。p21WAF1/CIP1基因启动子区甲基化或染色质中组蛋白去乙酰化异常可能是导致该基因转录受抑制的重要原因[12]。Eun Joo Noh等的[13]研究表明,HDAC抑制剂作用于Hela细胞时降低细胞周期蛋白水平,上调p21WAF1/CIP1的表达,导致细胞周期停滞。另有报道显示:肿瘤抑制因子(cylindromatosis,CYLD)介导HDAC6的抑制作用能够降低有丝分裂的速度,延长细胞周期,CYLD介导HDAC6的抑制作用最终导致核周CYLD的移位,从而抑制Bcl-3在核内聚集,阻断Bcl-3与NF-κB家族p50/p52结合激活靶基因的转录,减少CyclinD1的表达,阻碍细胞周期G1到S的过渡[14]。为此,本实验还检测了细胞周期相关因子CyclinD1及p21WAF1/CIP1在皮肤鳞状细胞癌组织中的表达情况。结果显示:p21WAF1/CIP1在皮肤鳞状细胞癌组织中的表达率显著低于在正常皮肤组织中的;而CyclinD1则在皮肤鳞癌组织中的表达显著高于其在正常皮肤组织中表达。这可能是因为CyclinD1的过表达及p21WAF1/CIP1的低表达共同作用使细胞周期调控失常,导致癌细胞的无限增殖。通过对HDAC6与p21WAF1/CIP1、CyclinD1的关联性分析,证实HDAC6的过表达与p21WAF1/CIP1的表达降低呈负相关关系,与CyclinD1的过表达呈正相关关系。这可能是由于HDAC6可以特异性地结合p21WAF1/CIP1基因的启动子区,直接调控p21基因的表达,同时对CyclinD1启动子上游基因座去乙酰化而抑制CyclinD1启动子,进而调控细胞周期进程[15]。抑制HDACs表达可以诱导CDK抑制剂p21WAF1/CIP1的表达,抑制周期素与CDK的活性[15]。HDACs可能通过影响CyclinD1及p21WAF1/CIP1等肿瘤细胞异常增殖的作用因子而对皮肤鳞状细胞癌的增殖分化产生重大影响。
由上可见,HDAC6有望作为临床治疗SCC的新靶点,为HDAC6抑制剂应用于SCC的治疗提供理论依据。
[1]Botrugno OA,Santoro F,Minucci S.Histonedeacetylase inhibitors as a new weapon in the arsenal of differentiation therapies of cancer[J].Cancer Lett,2009,280(2):134-144.
[2]Grozinger CM,Hassig CA,Schreiber SL,et al.Three proteinsdefine a class of human histone deacetylases related to yeast Hda1p[J].Proceed Nation Aca Sci U.S.A.,1999,96(9):4868-4873.
[3]De Ruijter AJM,Van Gennip AH,Caron HN,et al.Histone deacetylases(HDACs):characterizationoftheclassicalHDAC family[J].BiochemJ,2003,370(3):737-749.
[4]Kwon S,Zhang Y,Matthias P.The deacetylase HDAC6 is a novel critical component of stress granules involved in the stress response[J].Genes Dev,2007,21(24):3381-3394.
[5]Matthias P,Youshida M,Khochbin S.HDAC6 a new cellular stress surveillance factor[J].Cell Cycle,2008,7(1):7-10.
[6]HubbertC,GuardiolaA,ShaoR,etal.HDAC6isa microtububule-associateddeacetylase[J].Nature,2002,417(6887):455-458.
[7]Sakuma T,Uzawa K,Onda T,et a1.Aberrant expression of histone deacetylase 6 in oral squamous cel carcinoma[J].Int J Oncol,2006,29(1):117-124.
[8]Zhang Z,Yamashita H,Toyama T,et al.HDAC6 expression is correlated with better survival in breast cancer[J].Clin Cancer Res,2004,10(20):6962-6968.
[9]李群,胡卫红,李斌,等.HDAC6在胃癌组织中的表达[J].中国现代普通外科进展,13(11):855-857.
[10]杨晋,赵绍林,杨新玲,等.HDAC6在食管癌中表达的初步研究[J].中国实验诊断学,2009,13(11):1577-1579.
[11]韩艳,张梅花,金铁峰,等.HDAC 1和HDAC6蛋白过表达在卵巢浆液性癌中的临床病理学意义[J].临床与实验病理学杂志,2010,26(4):394-396.
[12]Abbas T,Dutta A.p21 in cancer:intricate networks and multiple activities[J].Nat Rev Cancer,2009,9(6):400-414.
[13]NohEJ,LimDS,JeongG,etal.AnHDACinhibitor,trichostatin A,induce a delay at G2/M transition,slippage of spindlecheckpoint,andcelldeathinatranscriptiondependant manner[J].Biochem Biophy Res Commun,2009,378(3):326-331.
[14]WickstromSA,MasoumiKC,KhochbinS,etal.CYLD negatively regulates cell-cycle progression by inactivating HDAC6 and increasing the levels of acetylated tubulin[J]. EMBO J,2010,29(1):131-144.
[15]BlagosklonnyMV,RobeyR,SackettDL,etal.Histone deacetylase inhibitors all induce p21 but differentially cause tubulin acetylation mitotic arrest,and cytotoxicity[J]. Mol Cancer Ther,2002,1(11):937-941.
[16]RampalliS,Pavithral,Bhatta,etal.Tumorsuppressor SMAR1 mediates cyclinD1 repression by recruitrment of the SIN3/histone deacetylase 1 complex[J].Mol Cel Biol,2005,25(19):8415-8429.
编辑/张惠娟
Expression of HDAC6,p21WAF1/CIP1and CyclinD1 in squamous cell carcinoma of the skin
WU Lei1,DONG Bin1,LI Guang-shuai2,LIU Lin-bo2
(1.Department of Plastic Surgery,Zhengzhou First People's Hospital,Zhengzhou 450004,China;2.Department of Plastic Surgery,The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China;)
ObjectiveTo examine the expression of HDAC6,p21WAF1/CIP1and CyclinD1 in the skin squamous cell carcinoma(SCC)tissue.MethodsSP immunohistochemieal staining was used to investigate the expression of HDAC6,p21WAF1/CIP1and CyclinD1 in 40 cases of SCC and 15 cases of normal skin.Results The expression rates of HDAC6(70.0%),CyclinD1(72.5%)in SCC tissue were higher than those of the normal skin(33.3%,40.0%).The expression rate of p21WAF1/CIP1(32.5%)in SCC lower than the normal skin(66.7%)(P<0.05).The expression rate of HDAC6 was correlated with the CyclinD1 expression rate1(r=0.330,P=0.038),The expression rate of HDAC6 was negative correlated with the p21WAF1/CIP1expression rate(r=-0.594,P=0.000).ConclusionHDAC6 can affect the tumor cell's proliferation and differentiation by influencing p21WAF1/CIP1and CyclinD1,and provide the theory basis of HDAC6 inhibitors used in the treatment of skin squamous cell carcinoma.
Histone deacetylase 6;p21WAF1/CIP1;CyclinD1;Skin squamous cell carcinoma
R739.5
A
1008-6455(2015)15-0034-04
刘林嶓主任医师教授博士/硕士研究生导师,主要研究方向:体表肿瘤的基础与临床研究,E-mail:liulinbo@zzu.edu.cn
2015-05-11
2015-07-25
