颅内血管周细胞瘤与孤立性纤维瘤的影像与病理对照
2015-09-26韩引萍张玉婷刘建莉张学凌周俊林
韩引萍,张玉婷,刘建莉,张学凌,周俊林
颅内血管周细胞瘤与孤立性纤维瘤的影像与病理对照
韩引萍,张玉婷,刘建莉,张学凌,周俊林*
目的 对比分析颅内血管周细胞瘤与孤立性纤维瘤的影像学差异。材料与方法 回顾性分析经手术病理证实的颅内血管周细胞瘤18例,孤立性纤维瘤10例,所有病例均行MR平扫及增强扫描,对其影像征象进行对照分析。统计学方法采用单因素分析,计数资料组间比较采用卡方检验。结果 血管周细胞瘤与孤立性纤维瘤在与附着硬膜的关系、硬膜尾征征象方面无统计学意义(P>0.05);在肿瘤形态、T2WI信号、囊变坏死及出血、瘤周水肿、骨质破坏及强化方式方面差异有统计学意义(P<0.05)。前者肿瘤形态多呈分叶状、不规则形,T2WI等高信号,囊变坏死及出血多见,瘤周水肿较明显,颅骨破坏可见,增强后明显强化;后者肿瘤形态多呈类圆形或椭圆形,T2WI有低信号区,囊变坏死及出血少见,瘤周水肿轻,无颅骨破坏,增强后明显强化,并有延迟强化。结论 颅内血管周细胞瘤与孤立性纤维瘤影像表现存在一定差异。
脑膜间叶组织肿瘤;血管周细胞瘤;孤立性纤维瘤;磁共振成像
颅内血管周细胞瘤(hemangiopericytoma,HPC)又称血管外皮细胞瘤,是起源于脑膜间质的毛细血管Zimmerman细胞,约占脑肿瘤的1%[1],2007年WHO中枢神经系统肿瘤分类中属于WHOⅡ级。孤立性纤维瘤(solitary fibrous tumour,SFT)是一种少见的软组织梭形细胞肿瘤[2],发生颅内者非常少见,颅内SFT认为起源于脑膜CD34阳性的树突状间叶细胞,WHOⅠ级。HPC与SFT同属于脑膜间叶组织肿瘤,WHO分级不同,二者的临床预后截然不同,且两者的影像学表现有较多相似之处。笔者收集了二者的影像与病理资料,并查阅相关文献分析,探讨两者之间的MRI特征差异,以资鉴别。
1 材料与方法
1.1临床资料
收集兰州大学第二医院2001年以来经手术和病理证实的18例颅内HPC患者的资料,肿瘤均为单发,其中男性10例,女性8例,年龄41~66岁,平均53.7岁。临床表现颅内高压10例,癫痫发作6例,出现精神症状8例。术前MRI 8例诊断为HPC,7例诊断为SFT,3例诊断为脑膜瘤。18 例HPC中,10例术后2年内复发,2例神经系统外转移,1例转移至胸椎,另1例转移至左肺。10例SFT中,男5例,女5例,年龄41~52岁,平均年龄46.5岁。临床表现颅内高压8例,一侧肢体无力6例,出现精神症状4例,癫痫5例。术前MRI 5例诊断为HPC,4例诊断为SFT,1例诊断为脑膜瘤。术后2年内复发1例,未见转移。
1.2MR检查
使用西门子3.0 T磁共振机,采用GRE及TSE序列进行轴位、矢状位及冠状位成像。扫描参数:GRE:T1WI(TR/TE 250 ms/2.48 ms),层厚5 mm,层间隔1 mm,FOV 22 cm×22 cm,矩阵256×256,TSE:T2WI(TR/TE 4000 ms/96 ms),ETL 8,ES 10 ms,Average 2,层厚5 mm,层间隔1 mm,FOV 22 cm×22 cm;矩阵256×256。TSE序列FLAIR扫描参数:TR 6000 ms,TE 94 ms,T1 2500 ms,ETL 8,ES 10 ms,Average 2,层厚5 mm,层间隔1 mm,FOV 22 cm×22 cm,矩阵256×256。增强扫描肘静脉团注Gd-DTPA,剂量0.1 mmol/kg体重。
1.3病理检查
各例手术标本分别进行HE染色,Vimentin,CD34染色,CD99染色,上皮膜抗原(epithelial membrane antigen,EMA)、S-100等相关指标的免疫组织化学染色,并将影像学表现与病理所见进行对照分析。
1.4统计学分析
应用SPSS 19.0软件包进行统计学分析。在单因素分析中,计数资料组间比较采用卡方检验。P<0.05具有统计学意义。
2 结果
2.1血管周细胞瘤影像与病理
2.1.1影像分析
18例HPC病灶均位于颅内脑外,其中位于大脑镰旁10例,大脑凸面4例,颅底4例。病灶呈分叶状或不规则形14例(见图1A),类圆形4例。MR平扫T1WI呈等稍低信号16例,稍高信号2例(见图1B)。T2WI呈等稍高信号15例,等低信号3例。增强扫描不均匀显著强化18例(见图1C),囊变坏死10例,瘤内出血9例,肿瘤以窄基底附着于硬膜13 例(见图1C),“硬膜尾征”3例,轻度瘤周水肿6例,中度瘤周水肿7例,重度瘤周水肿5例,颅骨破坏8例。
2.1.2病理分析
HE染色镜下观察:瘤细胞密集,呈弥漫分布,细胞短梭形,胞质少,胞界不清,胞核卵圆形,大小不一,核异性,核分裂相多见(见图1D),间质有较丰富的裂隙状、鹿角状血管。本组18例病例中10例可见囊变坏死,9例可见出血,未见钙化。免疫组化染色Ki-67>10%,Vimentin染色17例阳性(见图1E),EMA染色阴性,CD34表达均阳性。
2.2孤立性纤维瘤影像与病理
2.2.1影像分析
本组10例SFT中,位于顶枕部大脑镰旁3例,4例位于额颞部,3例位于中颅窝。肿瘤均单发。病灶呈分叶状或不规则形3例,类椭圆形7例(见图2A)。MR平扫T1WI等信号7例,略低信号3例(见图2A)。T2WI呈等稍高信号4例,低信号6例(见图2B)。增强扫描明显强化6例(见图2C),延迟强化4例,囊变坏死1例,瘤内出血1例,肿瘤以窄基底附着于硬膜6例,“硬膜尾征”2例,颅骨骨质破坏0例,轻度瘤周水肿8例,明显瘤周水肿2例。
2.2.2病理分析
HE染色镜下观察:瘤组织之瘤细胞长梭形,呈束状、编制状排列,疏密不均,瘤细胞胞质丰富,胞界不清(见图2D),胞核无明显异型性,核分裂相少见,间质血管及胶原纤维增生、玻璃样变。本组10例病例中囊变坏死2例,瘤内出血1例,无钙化。免疫组化染色Ki-67<15%,Vimentin染色9例阳性,EMA染色呈阴性,CD34均阳性(见图2E)。
2.3不同影像特点在HPC组与SFT组进行统计学单因素分析(见表1)
分析结果:肿瘤在与附着硬膜的关系、硬膜尾征指标方面差异无统计学意义(P>0.05)。在肿瘤形态、T2WI信号、囊变坏死及出血,瘤周水肿、骨质破坏及强化方式方面两组之间差异有统计学意义(P<0.05)。
3 讨论
颅内HPC和SFT均少见,HPC较SFT更易复发及转移,侵袭性更强。2007年WHO中枢神经系统肿瘤分类中两者同属间叶组织来源,HPC起源于毛细血管的外皮细胞(Zimmerman氏细胞),该细胞呈紧贴毛细血管网状纤维的梭形细胞,为一种血管外周变异的平滑肌细胞,具有多向分化潜能[3-4],属于2007年WHO中枢神经系统肿瘤Ⅱ级,间变性HPC属于WHO Ⅲ级。颅内SFT多为颅内脑外,但也可发生于脑实质和脑室内,WHO中枢神经系统肿瘤的分类认为起源于脑膜CD34阳性的树突状间叶细胞,具有成纤维和(或)成肌纤维细胞性分化能力的细胞[4-5],属于2007年WHO中枢神经系统肿瘤Ⅰ级。
两者瘤体内部结构成分不同,影像学表现存在一定程度的差异。HPC镜下纤维基质中可见肥胖的、多角形瘤细胞,核分裂相多见。肿瘤细胞排列密集,无特定的排列方式,肿瘤血管增生形成典型的“鹿角状”结构,肿瘤细胞围绕毛细血管呈“洋葱皮”样或片状排列。免疫组化染色表达Vim、CD34,大多表达CD99,也有部分表达Bcl-2,EMA大多阴性[6]。但目前没有HPC的特异性肿瘤标记物,有待进一步研究[7]。SFT镜下主要由梭形细胞构成,由细胞稀疏区和细胞密集区组成,肿瘤间质有较丰富的“鹿角状血管”,形成“血管周细胞瘤”样的组织学构象。瘤细胞呈短梭形,一般无明显的异型性,核分裂相罕见。免疫组化:Vimmtin,CD34,CD99常阳性,EMA阴性。由此可见在病理上,两者的镜下特点有差异,免疫组化表达谱一致[8]。
HPC与SFT在形态方面存在一定的差异。前者肿瘤多呈分叶状及不规则形,后者多为边界清楚的孤立性肿块,较小时呈圆形或椭圆形,体积较大时可有不同程度的分叶状。本组研究中,HPC呈分叶状或不规则形14例,SFT3例,与文献报道一致[9-10],这可能与二者的侵袭性不同有关,前者核分裂相多见,后者瘤细胞一般无明显的异型性,核分裂相罕见。HPC侵袭性明显,常破坏周围结构,在本研究中,HPC骨质结构破坏的有8例,而SFT为0例。在肿瘤坏死及囊变、出血方面,HPC出血9例,囊变坏死10例,SFT出血1例,囊变坏死1例,这可能与HPC生长速度快、侵袭性强、破坏血管有关。两者在MRI信号上常不均匀,HPC血供丰富,有大量新生毛细血管,T2WI呈不均匀高信号,肿瘤实质强化显著。而SFT由于肿瘤血管、细胞密集区、致密胶原纤维区分布不同,T2WI表现为略高、低信号区,低信号区是其特征性改变[11]。本研究中,有6例在T2WI呈低信号,增强呈不均匀强化,血管丰富区及细胞密集区明显强化,强化早期即可见清晰的迂曲血管影,而细胞稀疏区、胶原纤维区呈静脉期强化,延迟强化是其特征性改变[12],本组延迟强化有4例。在瘤周水肿方面,SFT多为轻度,较HPC不明显,且认为HPC瘤周水肿的程度与肿瘤的大小和位置无明显关系[13]。HPC和SFT均起源于脑膜间叶组织,与脑膜关系较不密切,多以窄基底与硬膜相连,脑膜尾征少见,本研究中HPC组有3例,SFT组有2例。
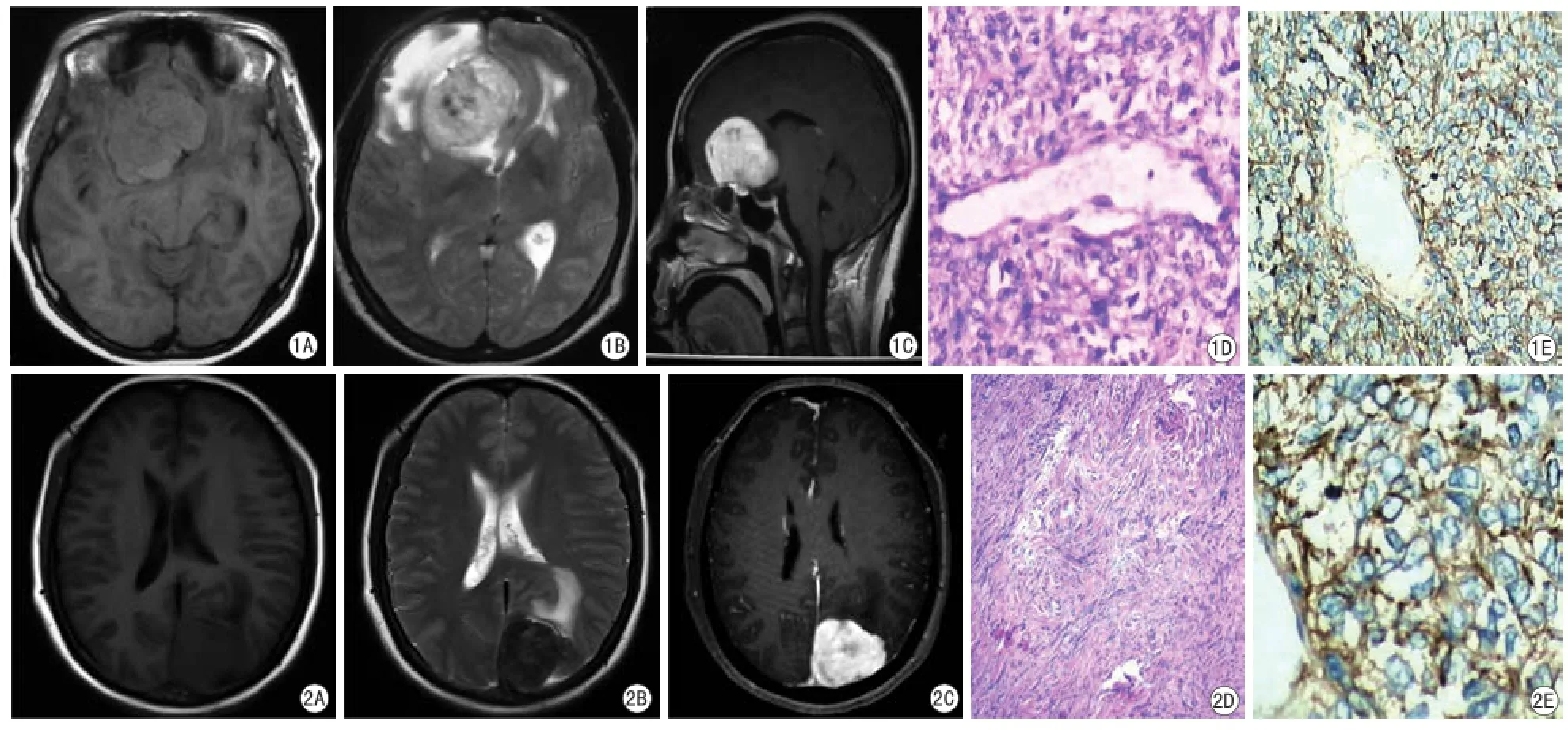
图1 女,46岁,血管周细胞瘤,病灶呈分叶状。A:T1WI轴位示肿瘤不均等低信号,边界不清;B:T2WI轴位示肿瘤呈高低混杂信号,瘤周水肿明显;C:增强T1WI矢状位呈不均匀显著强化,以窄基底与硬膜相连;D:瘤细胞丰富,核大小不等,深染,有异性,围绕血管(HE染色,×400);E:免疫组化染色,Vimtenin表达阳性,棕黄色核浆阳性,核不着色,被苏木精复染成蓝色 图2 女,44岁,孤立性纤维瘤,病灶呈类圆形。A:T1WI轴位示肿瘤略低信号,边界清;B:T2WI轴位示肿瘤内见低信号区,瘤周水肿不明显;C:增强T1WI呈不均匀显著强化,可见脑膜尾征;D:瘤细胞长梭形,呈束状、编织状排列,疏密不均,瘤细胞胞质丰富,胞界不清,胞核无明显异型性,核分裂象少见,间质血管及胶原纤维增生(HE染色,×400);E:免疫组化染色,CD34表达阳性,棕膜棕黄色Fig. 1 Female, forty-six years old, hemangiopericytoma, lobulated tumor. A: T1WI axis shows heterogeneous and iso-intense or mildly hypointense in signal intensity, ill-defined; B: T2WI axial shows a Mixed-signal with hypointense and hyperintense in signal intensity, Significant peritumoral edema; C: Sagittal T1WI shows heterogeneous and significant enhancement, connected to the dura with narrow base; D: Rich tumor cells, nuclear of varying sizes,stained, atypia, around blood vessels (HE staining, ×400); E: Immunohistochemical staining, vimtenin positive expression, positive brown nuclear plasma,nuclear non-staining, hematoxylin was dyed blue. Fig. 2 Female, forty-four years old, solitary fibrous tumors, round lesions. A: T1WI axial shows a slightly lower signal, the margin was well defined; B: Axial T2WI shows low signal area in the tumour, peritumoral edema was not obvious; C: Enhanced T1WI showed significant and heterogeneous enhancement, dural tail sign visible; D: Fusiform tumor cells, showing bundles, braided arrangement, uneven density, abundant cytoplasm of tumor cells, the cell boundary is unclear, no nuclear atypia, mitotic rare, interstitial blood vessels and collagen fibers proliferation (HE staining, ×400); E: Immunohistochemical staining, CD34 expression was positive, brown brown membrane.
颅内HPC和SFT影像表现存在一定的交叉,但通过本研究分析,二者在肿瘤形态、T2WI信号、囊变坏死及出血,瘤周水肿、骨质破坏及强化方式方面两组之间差异有统计学意义,表现为HPC形态多不规则、T2WI多为等高信号,低信号区少见、囊变坏死及出血多见、瘤周水肿显著、骨质破坏可见、显著强化。SFT多呈类圆形、椭圆形,T2WI有低信号区,囊变坏死及出血少见,瘤周水肿轻,无骨质破坏,增强后明显强化,延迟强化是其特征。
本研究存在的局限性:肿瘤样本量少,有待加大样本量进一步研究。
[References]
[1] Mekni A, Kourda J, Chelly I, et al. Hemangiopericytoma in the central nervous system: A study of eight cases. Neu-rochirurgie, 2008, 54(1): 15-20.
[2] Alawi F, Stratton D, Freedman PD. Solitary fibrous tumor of the oral soft tissues-A clineicopathologic and immunohisto-chemical study of 16 cases. Am J Sui Pathol, 2001, 25(7): 900-910.
[3] Bouvier LC, Liprandi A, Piercecchi MD, et a1. Contribution of immunohistochemistry and electron microscopy for the diagnosis ofmeningeal hemangiopericytoma: 15 cases reports. Ann Pathol, 2000, 20(5): 492-498.
[4] Gu WB, Ma J. Foramen magnum hemangiopericytoma: a case report. Chin J Magn Reson Imaging, 2013, 4(1): 38-39.
顾卫彬, 马军. 枕骨大孔区血管外皮细胞瘤一例. 磁共振成像, 2013, 4(1): 38-39.
[5] Magro G, Bisceglia M, Michal M, et al. Spindle cell lipoma-like tumor, solitary fibrous tumor and myofibroblastoma of the breast: a clinicopathologicalanalysis of 13 cases in favor of a unifying histogenetic concept.Virchows Arvhiv, 2002, 440(3): 249-260.
[6] Vimi S, Punnya VA, Kaveri H, et a1. An aggressive solitary fibroustumor with evidence of malignancy: a rare case report. Head NeckPathol, 2008, 2(3): 236-241.
[7] Chen M, Li F, Liu CY, et al. Study on imaging features of intracranial hemangiopericytoma correlated with pathology. Radiol Practice, 2014, 29(1): 49-52.
陈明, 李凤, 刘春英, 等. 颅内血管周细胞瘤的影像学特征与病理对照研究. 放射学实践, 2014, 29(1): 49-52.
[8] Li L, Wang H, Yuan SM, et al. Hemangiopericytoma of central Nervous System:a Clinicopathological analysis. Diagnostic theory and practice, 2009, 8(1): 67-71.
李良, 王海, 袁斯明, 等. 中枢神经系统血管周细胞瘤的临床病理分析. 诊断学理论与实践, 2009, 8(1): 67-71.
[9] Yan F, Ao QL, Sun JH, et al. Solitary fibrous tumor in central nervous system: clinicopathological features of 12 cases. Huazhong University of Science and Technology (Medical Sciences), 2011, 40(6): 692-696.
晏菲, 敖启林, 孙建海, 等. 12例中枢神经系统孤立性纤维瘤的临床病理分析. 华中科技大学学报(医学版), 2011, 40(6): 692-696.
[10] Zhang J, Zhou JL, Liu JL, et al. Comparision of imaging and pathological findings of intracranial anaplastic hemangiopericytoma and anaplastic meningioma. China Clinic Medical Imaging, 2014, 25(6): 381-384,412.
张婧, 周俊林, 刘建莉, 等. 颅内间变型血管外皮细胞瘤与间变型脑膜瘤的影像与病理对照. 中国临床医学影像杂志, 2014, 25(6): 381-384,412.
[11] Liu Y, Liu JY, Wang HL, et al. Imaging findings of solitary fibrous tumors. Zhonghua Fang She Xue Za Zhi, 2012, 46(5): 441-444.
刘毅, 刘剑羽, 王宏磊, 等. 孤立性纤维瘤的影像表现. 中华放射学杂志, 2012, 46(5): 441-444.
[12] Zhang WD, Chen JV, Cao Y, et a1. Computed tomographyand magnetic resonance imaging findings of imaging findingsof solitary fibrous tumors in the pelvis: correlation with his-topathological findings. Eur J Radiol, 2O11, 78(1): 65-70.
[13] Agarwal VK, Plotkin BE, Dumani D, et a1. Solitary fibrous tumorof pleura:a case report and review of clinical,radiographic andhistologic findings. Radiology Case, 2009, 3(5): 16-20.
Comparison of imaging and pathological findings of intracranial hemangiopericytoma and solitary fibrous tumour
HAN Yin-ping, ZHANG Yu-ting, LIU Jian-li, ZHANG Xue-ling, ZHOU Jun-lin*
Department of Radiology, Second Hospital Affiliated to Lanzhou University, Lanzhou 730030, China
*Correspondence to: Zhou JL, E-mail: zjl601@163.com
21 Sep 2015, Accepted 9 Nov 2015
Objective: To compare and analyze imaging features of intracranial hemangiopericytoma(HPC) and Solitary fibrous tumour(SFT). Materials and Methods: Eighteen patients of HPC and 10 patients of SFT proved by operation and pathology were analyzed retrospectively. Both plain and enhanced MR scans were performed and the results were analyzed in all cases. Results: There were no significant difference between HPC and SFT in relation to the attachment of the dura mater, dural tail sign(P>0.05). The difference between the two groups were significant difference,in relation to tumor shape, T2WI signal, necrotic and cystic areas and hemorrhage, peritumoral edema, skull destruction, enhancement(P<0.05). Conclusion: Imaging findings of intracranial HPC and SFT are different, the former has mostly lobulated,irregular shape, iso-high signal on plain T2WI, cystic necrosis and hemorrhage more common, obvious peritumoral edema, visible skull destruction, significant enhancement; the latter is mostly round or oval, low signal area on plain T2WI, rare cystic and necrosis, hemorrhage, light peritumoral edema, no skull destruction, significant enhancement with delayed enhancement.
Meningeal mesenchymal tumors; Hemangiopericytoma; Solitary fibrous tumors; Magnetic resonance imaging
甘肃省卫生行业科研计划资助项目(编号:GSWST2012-01);兰州市科技项目(编号:2011-2-250)
兰州大学第二医院放射科,兰州730030
周俊林,E-mail: zjl601@163.com
2015-09-21
R445.2;R739.9
A
10.3969/j.issn.1674-8034.2015.12.007
接受日期:2015-11-09
韩引萍, 张玉婷, 刘建莉, 等. 颅内血管周细胞瘤与孤立性纤维瘤的影像与病理对照. 磁共振成像, 2015, 6(12): 917-921.
ACKNOWLEDGMENTS This work was part of project supported by the scientific research project of Gansu Province(No. GSWST2012-01) and science and technology project of Lanzhou(No. 2011-2-250).
