抗原负载的DC-CIK联合化疗治疗晚期恶性黑色素瘤的临床研究
2015-09-26刘洋刘林嶓
刘洋,刘林嶓
(郑州大学第一附属医院整形外科河南郑州450052)
抗原负载的DC-CIK联合化疗治疗晚期恶性黑色素瘤的临床研究
刘洋,刘林嶓
(郑州大学第一附属医院整形外科河南郑州450052)
目的:研究抗原负载的DC-CIK过继免疫疗法联合化疗对晚期恶性黑色素瘤的临床疗效。方法:选取郑州大学第一附属医院收治的60例晚期恶性黑色素瘤患者,28例行抗原负载的DC-CIK联合化疗(A组),32例行单纯化疗(B组),对两组患者治疗后免疫功能、生活质量、中位生存期及无进展生存期进行比较。结果:A组治疗后外周血中CD3+,CD3+/CD4+,CD3+/CD8+,CD4+/CD8+和CD16+/CD56+细胞比值无明显变化,(>0.05);B组治疗后外周血中T细胞亚群比例较之前显著下降,(<0.05)。A组行细胞回输结束后,QOL评分改善比例为57.1%,与B组改善率31.2%而言,(<0.05)比较差异有统计学意义;A组患者的无进展生存期(月)较B组患者长(16vs9,<0.05),A组与B组患者的总生存期,比较差异无统计学意义(>0.05)。结论:抗原负载的DC-CIK细胞联合化疗治疗晚期恶性黑色素瘤安全有效,在提高患者免疫功能、减轻化疗不良反应、延长无进展生存期和改善患者生活质量方面具有重要作用。
树突状细胞;细胞因子诱导的杀伤细胞;恶性黑色素瘤;化疗
黑色素瘤是一种临床上发病率增长最快的恶性肿瘤之一,年增长率为3%~5%,虽然在我国发病率较低,但近年来成倍增长,每年新发病例约2万例,它已经成为严重危及我国人民健康的疾病之一[1],截止目前,恶性黑色素瘤(malignant melanoma,MM)的治疗方法有手术、放疗、化疗、辅助治疗,其中手术治疗依然是最主要治疗方法,但术后存在的微小转移灶往往成为复发的主要因素[2]。树突状细胞(dendritic cells,DC)联合细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK)过继性细胞免疫治疗(adoptivecellular immunotherapy,ACI)可以在不损伤机体免疫系统结构和功能的前提下,直接杀伤肿瘤细胞。DC已被证明是目前所发现的功能最强大的(antigen presenting cells,APC),它可以促进细胞毒性T淋巴细胞和辅助性T淋巴细胞的生成,参与机体的免疫反应[3]。CIK是一个强大的抗肿瘤活性细胞群,并通过发挥自身的细胞毒性和分泌细胞因子而杀伤肿瘤细胞,并可清除患者体内微小残余病灶。DC识别抗原、激活获得性免疫系统,与CIK联合确保了一个高效的免疫系统。本研究应用抗原负载的DC-CIK联合化疗治疗Ⅲ~Ⅳ期MM28例(A组),对比单纯化疗组32例(B组),评价联合组治疗MM的临床疗效。
1 资料和方法
1.1研究对象及入选标准
选取郑州大学第一附属医院收治的60例MM晚期患者(根据国际抗癌联盟(UICC)YNM分期为Ⅲ~Ⅳ期),并均经病理确诊。根据患者自愿选择治疗方案,分为抗原负载的DC-CIK联合化疗组(A组)28例,32例为单纯化疗组(B组)。治疗前均向患者或家属告知病情、详细诊疗方案及有可能出现的不良反应,签署治疗知情同意书。入组标准:①术前未接受放化疗;②卡式评分>60分;预计生存期>6个月;③心、肝、肾等脏器功能无明显异常。
1.2主要试剂与仪器
试剂:自体外周血淋巴细胞分离液购自天津瀚洋生物制药科技有限责任公司,重组人纤维蛋白(RetroNectin)购自北京宝日生物工程有限公司,抗CD3单克隆抗体购自美国BD公司,细胞培养液RPMI1640购自友康基业生物科技(北京)有限公司,胎牛血清购自HyClone公司,IL-2购自山东泉港药业有限公司,IFN-γ、IL-1α购自美国BD公司,400目细胞筛购自北京欣经科公司。仪器:流式细胞仪(美国BD公司)、细胞培养箱(Thermo公司)。
1.3抗原负载的DC-CIK细胞的培养与制备
首先,患者空腹8h以上,抽取外周血60ml加入肝素钠抗凝并均匀注入含淋巴细胞分离液,并经过离心纯化得到得到外周血单核细胞(PBMC),将获得的PBMC加含庆大霉素的生理盐水并低温离心洗涤2次,取含5%自体血浆的GTT-551(TaKra)无血清培养基30ml,将计数为1×107外周血单核细胞悬浮于其上,取经RetroNectin和抗mCD3Ab包被好的75cm2的细胞培养瓶一组,倾倒里面的液体,再分别用GTT-551和PBS液冲洗1次,培养当天在培养基中加入IFN-γ及IL-2,并取30ml转至RN包被的培养瓶中,将培养瓶放置培养箱中,恒温培养,将GTT-551培养基中加入1000 U/ml的IL-2及2%的自体血浆配置成CIK细胞扩瓶培养液,培养至第8天或者第9天时获得CIK细胞。其次,收集贴壁2 h后PBMNC中的贴壁成分作为前体细胞,以2×106个/ml浓度加入含GM-CSF 1 000U/ml,IL-4 1 000 U/ml的AIM-V,5%C02,37℃培养,每3d半量换液1次。培养细胞至第5天,加入肿瘤抗原液刺激,至第7天加入TNF-α,第8天收获的细胞为负载肿瘤抗原的DC,然后将CIK细胞和负载抗原的DC细胞混合继续培养3d获得肿瘤抗原负载的DC-CIK细胞
1.4治疗方案
所有患者手术治疗原则均按照中国黑色素瘤诊疗指南(2011版)实施。术后治疗方案为:
A组联合方案:达卡巴嗪(DTIC广东岭南制药有限公司,国药准字H20055753),300mg/m2,并50g/L葡萄糖溶液500mL稀释后静脉滴注,每日一次,连用5d为1个周期,一般间歇3周重复给药,连用2个周期。联合治疗组患者均为化疗前采集外周静脉血,每次化疗后回输抗原负载的DC-CIK细胞,每次连续回输3d,并在每次细胞回输后辅助IL-2,100万IU,皮下注射,强化细胞疗效。
B组单纯化疗方案:DTIC,方法、药物剂量及周期均同A组。两组患者化疗期间均辅助止吐、退热、促进造血等对症及支持治疗。
1.5疗效评价
1.5.1免疫功能评价:根据T细胞亚群检测评价患者免疫功能,包括CD3+、CD3+/CD4+、CD3+/CD8+、CD4+/CD8+和CD16+/CD56+的变化,细胞回输前及治疗结束后10天,用流式细胞仪检测外周血中上述指标。
1.5.2生活质量评价:应用Karnofsky评分(Quality of life,QOL)[4]变化,以治疗后KPS增加≥10分为QOL改善,变化<10分为QOL稳定,减少≥10分为QOL降低。细胞回输过程中,观察患者有无过敏、休克等不良反应。
1.5.3远期疗效评价:无进展生存期(progression free survival,PFS)指从随机分组开始到肿瘤进展或死亡的时间;总生存期(overall survival,OS)为治疗开始至患者死亡或最后一次随访时间。
1.6统计学处理
采用SPSS17.0统计软件包进行数据处理,计量资料以均数±标准差(±)表示,两组二分类资料比较用2检验;生存资料采用Kaplan-Meier法及log-rank检验,检验水准为α=0.05。
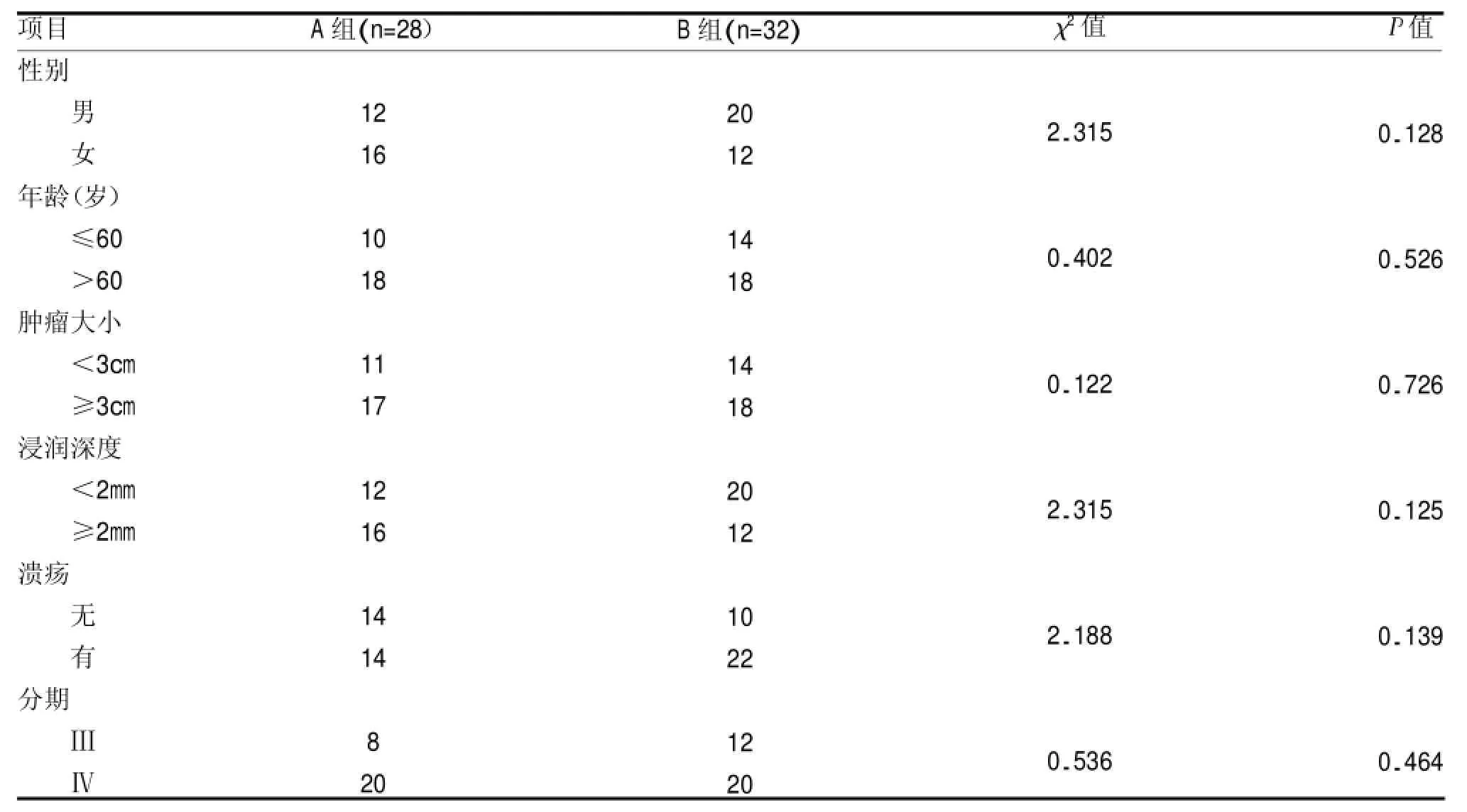
表1 A组和B组之间的临床特征比较
2 结果
2.1临床资料
经统计学检验,治疗组和对照组患者的一般资料比较具有可比性,见表1。
表2 两组患者治疗前后外周血肿T淋巴细胞亚群变化(±,%)
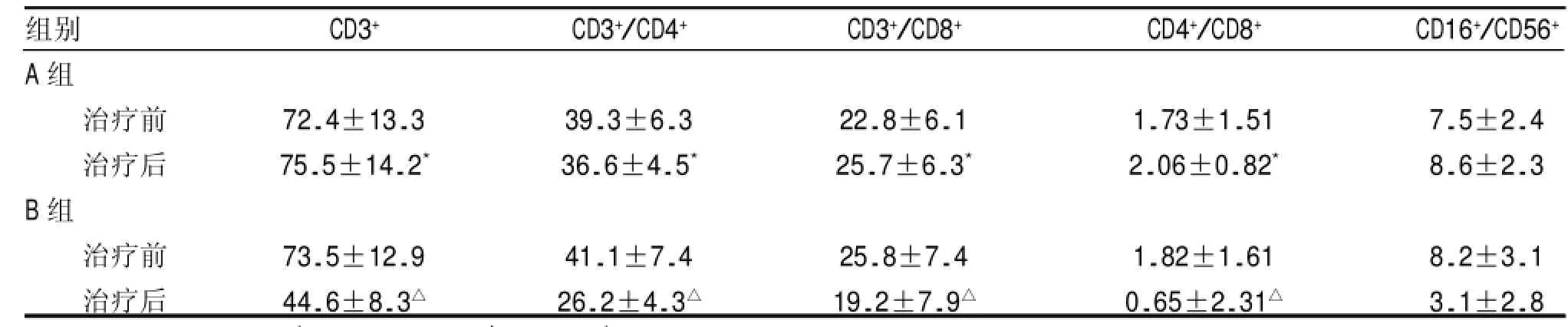
表2 两组患者治疗前后外周血肿T淋巴细胞亚群变化(±,%)
*<0.05vs联合治疗前;△<0.05vs单纯化疗前
组别A组CD3+CD3+/CD4+CD3+/CD8+CD4+/CD8+CD16+/CD56+治疗前治疗后B组治疗前治疗后72.4±13.3 75.5±14.2*39.3±6.3 36.6±4.5*22.8±6.1 25.7±6.3*1.73±1.51 2.06±0.82*7.5±2.4 8.6±2.3 73.5±12.9 44.6±8.3△41.1±7.4 26.2±4.3△25.8±7.4 19.2±7.9△1.82±1.61 0.65±2.31△8.2±3.1 3.1±2.8

表3 两组患者治疗前后生活质量改变情况
2.2 T细胞亚群变化
A组抗原负载的DC-CIK细胞回输联合DTIC化疗后CD3+、CD3+/CD4+、CD3+/CD8+、CD4+/CD8+和D16+/CD56+细胞比值无明显变化,(>0.05);B组单纯化学治疗后外周血中T细胞亚群比例较治疗之前显著下降,(<0.05);且治疗后A组T淋巴细胞亚群测定值大于B组,(<0.05)(表2)。由此可见化疗组降低了患者的免疫功能,而抗原负载的DC-CIK的细胞回输可以改善患者的免疫功能。
2.3生活质量改变
A组行细胞回输结束后,QOL评分改善比例为57.1%,与B组改善率31.2%而言,比较差异有统计学意义(=-2.370,=0.018)见表3。
2.4两组晚期MM患者中位PFS及中位OS评价
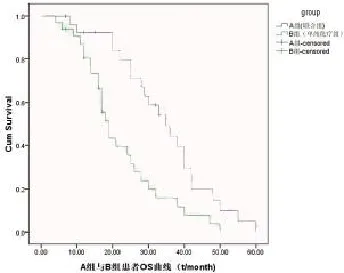
A组患者术后细胞回输联合化疗后,中位无进展生存期(月)明显高于B组(16vs9),(2=8.100,=0.004)差异有统计学意义。见图1。A组患者中位生存时间(月)明显高于B组(38vs18),差异无统计学意义(2=3.107,=0.078),见图2。

图1a 组与B组PFS曲线
3 讨论
晚期MM患者预后差,研究发现它的发病与免疫逃逸与免疫耐受密切相关,其中调节性T淋巴细胞与免疫逃逸最为密切。Sasada[5]等研究发现,与正常人相比,肿瘤病人外周血中调节性T淋巴细胞明显较高;Beyer M[6]等认为肿瘤患者预后情况与肿瘤患者局部调节性T淋巴细胞数量密切相关;李花等[7]的研究证实经DC诱导CIK后,解除了调节性T淋巴细胞对CIK的抑制功能,使外周血中的调节性T细胞数量减少的同时,也显著增强了杀伤肿瘤细胞的活性。而化疗也可以减少调节性T淋巴细胞的数量,从而改善机体的免疫抑制状态[8]。
DC是人体内功能强大的抗原提呈细胞,可以激活初始T淋巴细胞,引发抗原特异性的免疫应答。它的抗肿瘤机制主要由以下几点:①成熟的DC细胞能够捕获不同类型的抗原,加工处理后,通过细胞表面表达的MHC分子及表面标志白细胞分化抗原CD1分子途径,启动T细胞能力,从而抵制肿瘤的免疫逃逸[9];②DC细胞通过分泌细胞因子和趋化因子选择性的趋化T细胞,并将趋化的T细胞定向迁徙至肿瘤部位;③在肿瘤周围,DC细胞与T细胞之间会相互产生作用,同时滤泡型DC细胞会保留一些抗原,可使DC分泌一些促进T细胞生长增殖的生存因子,从而延长效应T细胞在肿瘤部位的杀伤时间;④DC细胞可分泌细胞因子如(IL-12、IFN-1)等从而抑制肿瘤血管形成[10]。
CIK细胞是人外周血单个核细胞在体外用多种细胞因子共同诱导培养获得的一群异质细胞,其表面标记CD3CD56为双阳性,兼具有T淋巴细胞强大的抗瘤活性与NK细胞的非MHC限制性杀瘤特点[9]它的抗肿瘤作用机制为以下三种[11-13]:①直接杀伤: CIK细胞可以通过不同的机制识别肿瘤细胞,释放颗粒酶/穿孔素等毒性颗粒,导致肿瘤细胞裂解;②CIK细胞可以释放大量IL-2、IL-10、TNF-α等多种细胞因子,通过抑制肿瘤细胞生存及调节机体免疫系统杀伤肿瘤细胞;③CIK细胞通过跨膜糖蛋白从而诱导肿瘤细胞凋亡。
诸多研究表明DC与CIK细胞共同培养后产生的细胞比同源CIK细胞的增殖活性更强,并能加强CIK细胞的抗肿瘤活性。两者共同培养后,可使IL-2、IL-12、IFN-γ等细胞因子分泌增加,反过来细胞因子又可加快CIK细胞的增殖速度[14]。当DC分泌大量的IL-12,促使CIK细胞高表达CD56+,进一步提高CIK细胞的毒性和抗肿瘤作用。另外DC可以在一定程度上抑制调节性T淋巴细胞活性,进而增强CIK细胞的杀伤性,因此DC-CIK联合治疗是目前临床上应用最有效的过继性免疫治疗的方法之一[15]。
程霞等[16]指出当肿瘤负荷低于1×106时,免疫治疗可能获得比较好的疗效。术后辅助化疗后,体内对化疗敏感的残存肿瘤细胞,部分得到清除,但也损害了机体免疫功能,此时如再适当的辅助生物细胞回输治疗,可清除术后微小病灶的同时修复受损的免疫功能[17],本次的研究也证实了这一点,A组治疗后外周血中CD3+、CD3+/CD4+、CD3+/CD8+、CD4+/CD8+和CD16+/CD56+细胞比值无明显变化,(>0.05);B组治疗后外周血中T细胞亚群比例较之前显著下降。另外石永进等[18]研究发现:有关细胞因子诱导的杀伤细胞降低乳腺癌耐药细胞系对阿霉素的耐受效应指出CIK与化学治疗联合应用可提高耐药肿瘤细胞对化学治疗药物的敏感性,并减轻化学治疗所带来的不良反应。肿瘤细胞MHCⅠ类分子及共刺激分子是效应T细胞识别、杀伤肿瘤细胞的重要途径。化疗药物可诱导肿瘤细胞MHCⅠ类分子的表达[19],从而介导更为有效的DC-CIK细胞杀伤肿瘤细胞的能力[20]。
本研究建立在抗原负载的DC上,利用DC提呈抗原的能力来完成对肿瘤的选择,从而诱导出针对肿瘤抗原的T细胞克隆,协同杀伤肿瘤细胞,产生更大的抗肿瘤效应。
王忠成[21]等对抗原负载的DC-CIK与抗原负载的DC对B16恶性黑色素瘤荷瘤鼠的治疗作用对比分析后认为抗原负载的DC-CIK和DC有明显的抗肿瘤作用。刘希春[22]等用NVD修饰胃癌细胞抗原后,再用特异性DC-CIK细胞进行杀伤,取得了前所未有的治疗效果,杀伤率达到83.4%。任鹏涛等[23]指出单纯应用CIK细胞组和未进行特异性抗原负载的DC-CIK两组的抑瘤率以及细胞杀伤试验中细胞杀伤情况均低于特异性抗原负载的DC-CIK。这是因为肿瘤细胞总蛋白中包含有丰富的MHC抗原表位成分,进过特异性抗原致敏的DC细胞的摄取、加工和递呈后,可诱导针对该特异性抗原的特异性细胞毒性T淋巴细胞,发挥有效的抗肿瘤效应。所以通过特异性抗原负载的DC和同期激活的CIK细胞混合培养,来进一步提高效应细胞的产量、增强抗肿瘤细胞毒性、增加细胞因子的分泌能力、促进肿瘤细胞凋亡,从而为临床提供一种安全、有效的肿瘤免疫治疗途径。本研究结果显示,A组治疗结果显示中位PFS (16vs9)上明显比B组长,过敏、休克、腹泻、皮疹以及白细胞降低等不良反应的发生率也较低,且A组患者QOL评分改善比例为57.1%,与B组改善率31.2%而言也得到了很大的提高(<0.05),但该治疗模式仍需要临床上大样本的研究来进一步证实。另有研究发现特异性抗原致敏的DC-CTL细胞较DC-CIK细胞而言有更强大的杀伤B16黑色素瘤细胞的能力并诱导肿瘤细胞凋亡[24],其机制仍需进一步探索,希望在不久的将来能为临床肿瘤的过继免疫治疗提供更好的治疗方式。
[1]CSCO黑色素瘤专家委员会.中国黑色素瘤诊治指南(2011版)[J].临床肿瘤学杂志,2012,18(2):159-171.
[2]Rastrelli M,Tropea S,Pigozzo J,et al.Melanoma m1:diagnosis and therapy[J].In Vivo,2014,28(3):273-285.
[3]Tuyaerts S,Van Meirvenne S,Bonehill,A,et al Expression of human GITRL on myeloid dendritic cells enhances their immunostimulatory function but does not abrogate the suppressive effect of CD4+CD25+regulatory T cells[J]. Leukoc Biol,2007,82(1):93-105.
[4]谭诗生,李杭,罗健,等.欧洲癌症研究与治疗组织研制的生活质量核心调查问卷第3版中文版生活质量调查问卷测评[J].中国组织工程研究与临床康复,2006,10(4):23-27.
[5]Sasada T,Kimura M,Yoshida Y,et al.CD4+CD25+regulatory T cellsinpatientswithgastrointestinalmalignancies:Possible inevolvement of regulatory T cell in disease progression[J].Cancer,2003,98(5):1089-1099.
[6]Beyer M,Schultze JL.Regulatory T cells:major players in the tumor microenvironment[J].Curr Pharm Des,2009,15(16):1879-1892.
[7]李花.DC联合CIK治疗NSCLC的基础和临床研究[D].天津医科大学,2008.
[8]Dudley ME,Wunderlich JR,Yang JC,et al.Adoptive cell transferherapyfollowingnon-myeloablativebut lymphodepleting chemotherapy for the treatment of patients withrefractory metastatic melanoma[J].JClinOncol,2005,23(10):2346-2357.
[9]周菁,张伟.树突状细胞联合细胞因子诱导的杀伤细胞抗肿瘤效应研究[J].国际呼吸杂志,2006,26(11):851-853.
[10]Schmidt-Wolf IG,Lefterova P,Johnston V,et al.Sensitivity of multidrug-resistant tumor cell lines to immunologic effector cells[J].Cell Immunol,1996,169(1):85-90.
[11]MehtaBA,Schmidt-WolfIG,WeissmanIL,etal.Two pathways of exocytosis of cytoplasmic granule contents and target cell killing by cytokine-induced CD3+CD56+killer cells[J].Blood,1995,86(9):3493-3499.
[12]Hoyle C,Bangs CD,Chang P,et al.Expansion of Philadelphia chromosome-negative CD3+CD56+cytotoxic cells from chronicmyeloidleukemiapatients:Invitroandinvivoefficacy inseverecombinedimmunodeficiencydiseasemice[J].Blood,1998,92(9):3318-3327.
[13]Verneris MR,Kornacker M,Mail nder V,et al.Resistance of exvivo expanded CD3+CD56+T cells to Fas-mediated apoptosis[J].Cancer Immunol Immunother,2000,49(6):335-345.
[14]M¨aenA,ZiskeC,Seh6ttkerB,etal.Interactionsbetweendendritic cells and cytokine-induced killer cells lead to an activation of bothpopulations[J].Immunother,2001,24(6):502-510.
[15]Peqqs KS,Quezada SA,Allison JP.Cancer immunotherapy:co-stimulatory agonists and co-inhibitory antagonists[J]. Clin Exp Immunol,2009,157(1):9-19.
[16]程霞,张晓实,彭瑞清,等.肿瘤负荷对CIK/IL-2临床疗效的影响[J].中国肿瘤临床,2005,(15):847-848,855.
[17]Jiang J,Xu N,Wu C,et al.Treatment of advanced gastric cancerbychemotherapycombinedwithautologous cytokine-induced killer cells[J].Anticancer Res,2006,26 (3B):2237-2242.
[18]石永进,虞积仁,朱平,等.细胞因子诱导的杀伤细胞降低乳腺癌耐药细胞系对阿霉素的耐受效应[J].北京大学学报:医学版,2001,33(5):415-418.
[19]OhtsukasaS,OkabeS,YamashitaH,etal.Increased expression of CEA and MHC class I in colorectal cancer cell lines exposed to chemotherapy drugs[J].J Cancer Res Clin Oncol,2003,129(12):719-726.
[20]FonsattiE,NicolayHJ,SigalottiL,etal.Functional up-regulation of human leukocyte antigen class I antigens expressionby5-aza-2'-deoxycytidineincutaneous melanoma:immunotherapeutic implications[J].Clin Cancer Res,2007,13(11):3333-3338.
[21]王忠成,王钰.抗原负载的DC与DC-CIK抗肿瘤作用的比较分析[J].解剖科学进展,2011,17(4):335-338.
[22]刘希春,江海涛,毛伟征.负载抗原DC-CIK细胞对NDV修饰抗原胃癌细胞杀伤作用[J].齐鲁医学杂志,2010,25 (5):377-379,382.
[23]任鹏涛,张苑,阎庆辉,等.特异性抗原致敏的DC-CIK细胞对B16黑色素瘤多途径抑瘤作用的研究[J].河北医药,2012,30(20):3057-3060.
[24]任鹏涛,张苑,蔡建辉,等.特异性抗原致敏的DC-CIK与DC-CTL细胞对黑色素瘤抑瘤作用的比较[J].天津医科大学学报,2011,17(2):173-176.
编辑/张惠娟
Clinical study on DC-CIK loaded with antigen combined with chemotherapy in the treatment of end-stage malignant melanoma
LIU Yang,LIU Lin-bo
(Department of Plastic Surgery,The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,Hennan,China)
Objective To evaluate the therapeutic effect of dendritic cells-cytokine icduced killers cells (DC-CIK)loaded with antigen chemotherapy in the treatment of end-stage malignant melanoma(MM). Methods 60 MM patients were selected from the First Affiliated Hospital of Zhengzhou University.28 of them were treated by DC-CIK loaded with antigen with chemotherapy(A group),and another 32 were treated by chemotherapy only(B group).The immune function,quality of life(QOL),the medianprogression-free survival(mPFS)and overall survival(OS)of the patients were compared between the two groups after the treatment.Results There was no obvious change of the ratio of CD3+,CD3+/CD4+, CD3+/CD8+,CD4+/CD8+and CD16+/CD56+in the peripheral blood of group A(>0.05),while T cell subsets decreased significantly after the treatment of group B,and obviously lower than that of group A(<0.05). 57.1%of patients in group A were improved in their quality of life,significantly higher than that of B group,which was 31.2%(<0.05).The median progression-free survival(mPFS)of group A was longer than that of group B(16 months vs 9 months,<0.05),while the median overall survival(OS)of the two groups had no significant difference(>0.05).ConclusionsTreatment with DC-CIK adoptive immunotherapy combined with chemotherapy can improve effectively the immune function and reduced the side effects of chemotherapy,prolong the PFS,and improve QOL of end-stage MM patients.
dendritic cells(DC);cytokine induced killer cells(CIK);malignant melanoma;chemotherapy
R739.5
A
1008-6455(2015)02-0025-06
刘林嶓,主任医师、教授、主任(病区负责人);研究方向:体表肿瘤、病理性瘢痕、皮肤软组织损伤、美容外科等;通联:河南省郑州市中原区建设东路1号郑州大学第一附属医院整形外科,邮编:450052
2014-11-22
2015-01-05
