民族药蔓菁对肺炎链球菌和流感病毒感染小鼠的保护作用△
2015-09-25李张宇万波王张张颖李博桑勤白成阳任志丽缪舒益唐光曦
李张宇,万波,王张*,张颖,李博,桑勤,白成阳,任志丽,缪舒益,唐光曦
(1.太极集团有限公司,重庆 401147;2.成都中医药大学,四川 成都 611137)
·基础研究·
民族药蔓菁对肺炎链球菌和流感病毒感染小鼠的保护作用△
李张宇1,万波2,王张2*,张颖1,李博2,桑勤1,白成阳2,任志丽2,缪舒益2,唐光曦2
(1.太极集团有限公司,重庆 401147;2.成都中医药大学,四川 成都 611137)
目的:研究民族药蔓菁的在体抗菌、抗病毒作用,进而揭示其治疗“肺燥咳嗽”的机制。方法:按照传统方法制备蔓菁膏,观察其低、中、高3个剂量[剂量分别为250、500、1000 mg(浸膏)·(kg·d)-1]对金黄色葡萄球菌、肺炎链球菌、流感病毒感染致小鼠死亡及肺指数的影响。结果:蔓菁膏3个剂量对金黄色葡萄球菌感染小鼠均没有明显的保护作用,但对小鼠小肠炎性病变具有一定的缓解作用;蔓菁膏3个剂量均可降低肺炎链球菌致小鼠感染死亡率(由90%降至15%~30%),中剂量效果最佳(死亡率为15%);蔓菁膏低、高剂量还能减轻流感病毒性小鼠肺炎的充血水肿实变并降低肺指数,其肺指数抑制率分别为29.23%、28.38%,低剂量效果最佳,中剂量没有明显的作用。结论:蔓菁膏对肺炎链球菌和流感病毒感染小鼠具有保护作用,量效关系不成线性,为其临床应用于治疗“肺燥咳嗽”提供参考。
蔓菁;肺炎链球菌;金黄色葡萄球菌;流感病毒;小鼠;肺燥咳嗽
蔓菁为十字花科植物芜菁BrassicarapaL.的块根,有藏族、维吾尔族、普米族药用历史[1]。藏药名为妞玛、熊麻,制成蔓菁膏,治“龙”病、“培根”病和中毒等[2];维吾尔药名为查木古尔、恰玛古尔,治体虚阳痿、营养不良、肺燥咳嗽等[3]。急性气管支气管炎是由病毒(腺病毒、流感病毒、呼吸道合胞病毒、副流感病毒)或细菌(流感嗜血杆菌、肺炎链球菌、链球菌、葡萄球菌)等病原体感染所致的支气管黏膜炎症,症见咳嗽、咯痰[4]。本文拟通过研究蔓菁的在体抗菌、抗病毒作用,进而揭示蔓菁治疗“肺燥咳嗽”的机制。
1 材料与仪器
1.1 药物
蔓菁样品采自四川省松潘县红土乡,经成都中医药大学张艺研究员鉴定为十字花科植物芜菁BrassicarapaL.的块根。将其切片后,于60 ℃烘干,加10倍量水,煎煮4次,每次1 h,第一次加水后浸泡1 h,合并提取液,滤过,浓缩,即得蔓菁膏[5],每克浸膏含1.55 g原生药材。用蒸馏水配置成质量浓度分别为12.5、25、50 mg(浸膏)·mL-1的溶液。双黄连口服液,由哈药集团三精制药股份有限公司生产,用蒸馏水配置成浓度为0.5 mL(口服液)·mL-1的溶液。头孢拉定胶囊,由江苏亚邦强生药业有限公司生产,用蒸馏水配置成质量浓度为16.67 mg·mL-1的溶液。利巴韦林片,由四川美大康药业股份有限公司生产,用蒸馏水配置成质量浓度为3.75 mg·mL-1的溶液。
1.2 动物
SPF级KM种小鼠,488只,雌雄各半,体重(20±2)g,由成都达硕生物科技有限公司提供,实验动物生产许可证号:SCXK(川)2013-24。
1.3 菌株和病毒株
金黄色葡萄球菌临床分离株MSSA05-4和肺炎链球菌临床分离株S-1,均由成都中医药大学附属医院提供;鼠流感病毒FM1株,由四川大学华西基础医学院提供。
1.4 试剂和仪器
鸡胚(10日龄鸡胚,质量要求:禽流感抗体阴性);牛肉膏、蛋白胨(北京奥博星生物技术有限公司,批号分别为20031015,20070102);pH计(PHS-3C型,上海精密科学仪器有限公司,编号:023443);Forma Orbital Shake(Thermo Electron Corporation,Model:481,S/N:101596-160);WH-2微型旋涡混合仪(上海泸西分析仪器厂);立式自动电热压力蒸汽灭菌器(LDZX-40BI型,上海申安医疗器械厂);生化培养箱(KXB-150型,成都科析仪器成套公司);净化工作台(SW-CJ-1F型,苏州安泰空气技术有限公司);电子分析天平[AB204-N型,梅特勒-托利多仪器(上海)有限公司]。
2 方法
2.1 金黄色葡萄球菌感染小鼠模型
2.1.1 菌株毒力测试 金黄色葡萄球菌临床分离株MSSA05-4接种于平板培养基,并制备肉汤培养基(液体)和琼脂培养基(固体),然后在超净工作台上进行肉汤培养基接种、细菌计数,并计算菌落浓度。取小鼠36只,雌雄各半,随机分成6组(5个细菌浓度组,一个空白对照组),每组6只。考虑到细菌毒力不够,或小鼠本身对该菌不敏感,本实验采用5%干酵母配制菌悬液而降低小鼠的抵抗力。取6支试管(实际用5支并标号10-1、10-2、10-3、10-4、10-5),各加入4.5 mL5%干酵母0.9%氯化钠溶液,高温灭菌10 min后,以0.5 mL细菌原液与4.5 mL的5%干酵母溶液混合,配制成10-1、10-2、10-3、10-4、10-55个不同浓度的菌悬液,各5 mL,完毕后置于冰箱4 ℃保藏。腹腔注射时,先用碘酒消毒后,5个浓度组分别注射5个浓度的菌悬液,空白对照组注射5%的干酵母0.9%氯化钠溶液,每只小鼠均腹腔注射0.5 mL。仔细观察并记录小鼠在48 h内的反应情况和死亡数[6]。
2.1.2 在体抗菌实验 小鼠随机分组,连续灌胃给药3 d,每天1次,给药体积均为20 mL·(kg·d)-1。末次给药后30 min,根据菌株毒力测试结果选用使80%~100%小鼠死亡的金黄色葡萄球菌的干酵母悬液(菌落浓度为9.2×105CFU·mL)0.5 mL,给小鼠腹腔注射,造成感染(空白对照组注射等量干酵母0.9%氯化钠溶液)。感染后6 h再给药1次,观察和记录各组小鼠感染后7 d内的反应情况以及死亡数。
2.2 肺炎链球菌感染小鼠模型
2.2.1 菌株毒力测试 同2.1.1[7]。
2.2.2 在体抗菌实验 分组和给药同2.1.2。末次给药后30 min,根据菌株毒力测试结果选用使80%~100%小鼠死亡的肺炎链球菌的干酵母悬液(菌落浓度为6.3×106CFU·mL-1)0.5 mL,给小鼠腹腔注射,造成感染(空白对照组注射等量干酵母0.9%氯化钠溶液)。感染后6 h再给药1次,观察和记录各组动物感染后7 d内的反应情况以及死亡数。
2.3 流感病毒感染小鼠模型
2.3.1 病毒扩增 将流感病毒液解冻,0.9%氯化钠溶液100倍稀释,无菌条件下尿囊腔接种,0.2 mL/胚,36~37 ℃生化培养箱培养,24 h照蛋,弃死亡鸡胚,存活鸡胚继续孵育,每隔6 h照蛋1次,死亡鸡胚0~4 ℃冷藏保存。3 d后,将所有鸡胚置0~4 ℃冷藏12~24 h,无菌条件下收集鸡胚尿囊液,经无菌检验合格后,冷冻保存备用[8]。
2.3.2 病毒的血凝效价(HA) 以试管稀释法将病毒液做对倍系列稀释,加入0.7%鸡红细胞悬液混匀,室温静置0.5~1 h,待阴性对照管管底形成红细胞沉积点,观察,以出现血凝阳性的最高病毒稀释度的倒数作为病毒血凝价。最后测得病毒血凝价为512。
2.3.3 小鼠的半数致死量(LD50) 用0.9%氯化钠溶液对病毒液做10-1、10-2、10-3、10-4、10-5稀释,每项稀释度滴鼻50 μL,感染小鼠10只,对照组滴鼻等量0.9%氯化钠溶液。感染后,每天记录小鼠发病死亡数,观察14 d,计算LD50[9]。测得病毒对小鼠LD50为10-3.75,即病毒液的毒价为103.75LD50·mL-1。
2.3.4 感染病毒 小鼠随机分组后预防性灌胃给药3 d,每天1次,给药体积均为20 mL·(kg·d)-1。末次给药后0.5~1 h进行病毒感染,感染病毒量为20 LD50·0.05 mL-1,即病毒液做14倍稀释,每鼠滴鼻感染0.05 mL,空白对照组用等量0.9%氯化钠溶液滴鼻。感染后再连续给药4 d,末次给药后1 h处死小鼠。剪开胸腔取出全肺,计算肺指数和抑制率,肺指数(%)=[肺重(g)/体重(g)]×100%;肺指数抑制率(%)=[(模型对照组平均肺指数-实验组平均肺指数)/模型对照组平均肺指数]×100%。
2.4 统计方法
运用SPSS 17.0 for windows软件提供的单因素方差分析或非参数检验方法对计量资料和计数数据的组间差异进行显著性检验。
3 结果
3.1 对金黄色葡萄球菌感染小鼠的影响
3.1.1 细菌计数 本实验取用10-7两个培养皿生长菌落数的平均值为计量值,结果为:[(91+93)/2]×107×10=9.2×109CFU·mL-1,即为菌原液的菌落浓度。见表1。

表1 金黄色葡萄球菌计数结果
3.1.2 菌株毒力测试结果 10-4稀释浓度的菌液(即菌落浓度为9.2×105CFU·mL-1)致死率为85.7%,符合致死率在80%~100%之间试验菌液感染要求,确定为本次实验感染的菌落浓度。见表2。
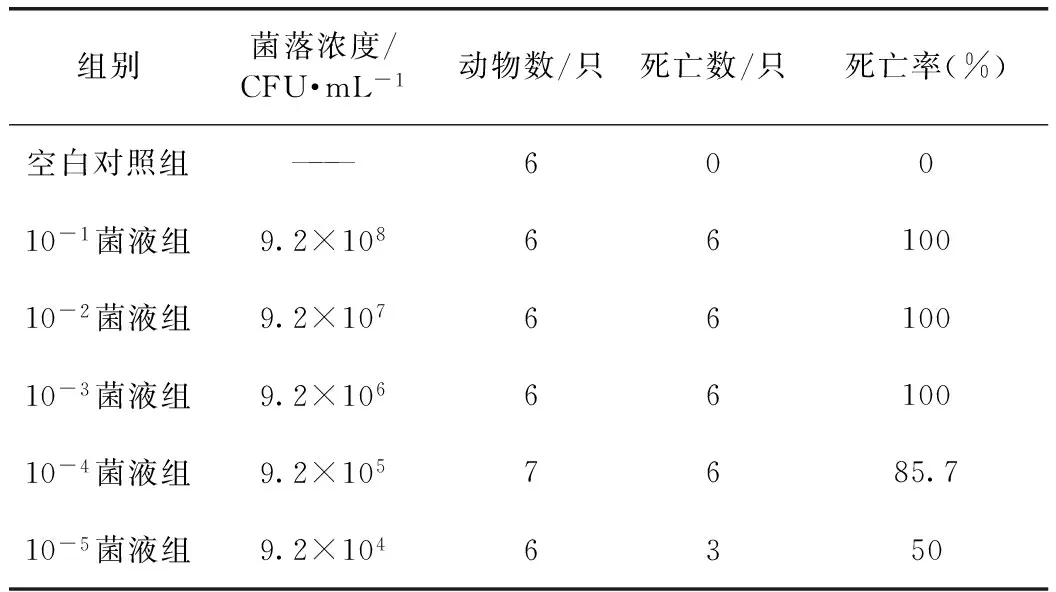
表2 金黄色葡萄球菌致小鼠死亡的菌落浓度预试结果
3.1.3 在体抗菌实验结果 蔓菁3个剂量对金黄色葡萄球菌感染小鼠没有明显的保护作用,但对小鼠小肠炎性病变具有一定的缓解作用。一般反应情况:各实验组小鼠在感染当天腹腔注射后1 min左右,均出现典型的扭体反应(包括空白对照组),感染后小鼠活动减少,几乎不进食,见蜷卧、弓背等现象。感染后第2天,小鼠出现集中死亡,死亡小鼠肛门有黑色排泄物粘附,存活小鼠大多见排稀便现象,小鼠束毛、形态萎靡。感染后第3天,存活小鼠的进食量开始增加,健康状况有恢复迹象,3 d之后小鼠鲜有死亡。感染后第7天,处死小鼠,所有存活小鼠体重均有不同程度的减轻。尸解发现,模型对照组小鼠小肠全段坏死,而在其他给药组,只有十二指肠段坏死,且肺部未见明显的异常病变。见表3。
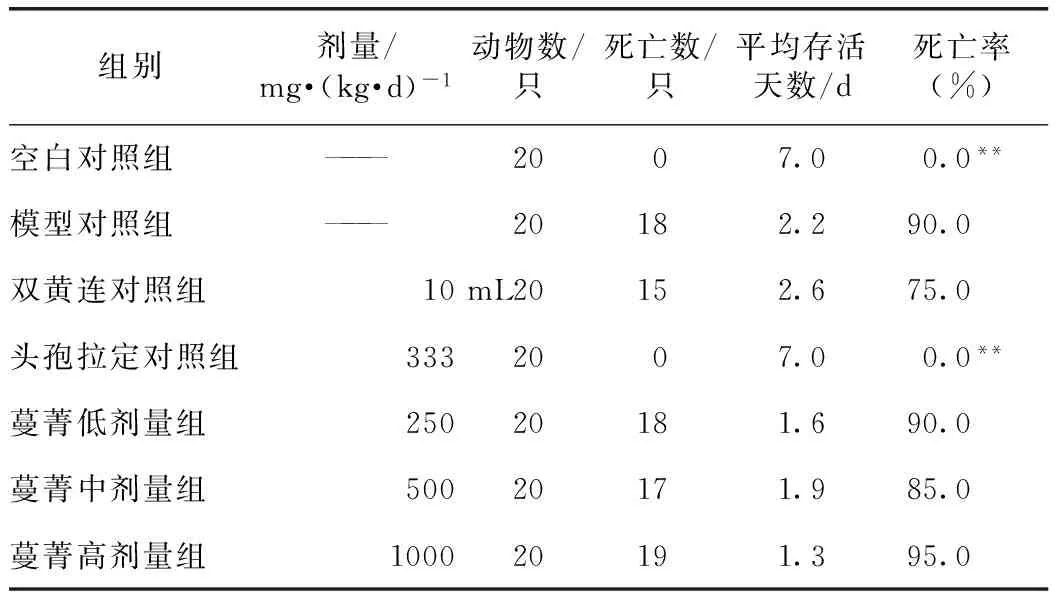
表3 蔓菁对金黄色葡萄球菌感染小鼠的影响实验结果
注:与模型对照组比较,*P<0.05,**P<0.01;蔓菁的剂量以蔓菁浸膏计。下同。
3.2 对肺炎链球菌感染小鼠的作用
3.2.1 细菌计数 本实验取用10-8两个培养皿生长菌落数的平均值为计量值,结果为:[(62+64)/2]×108×10=6.3×1010CFU·mL-1,即为菌原液的菌落浓度。见表4。
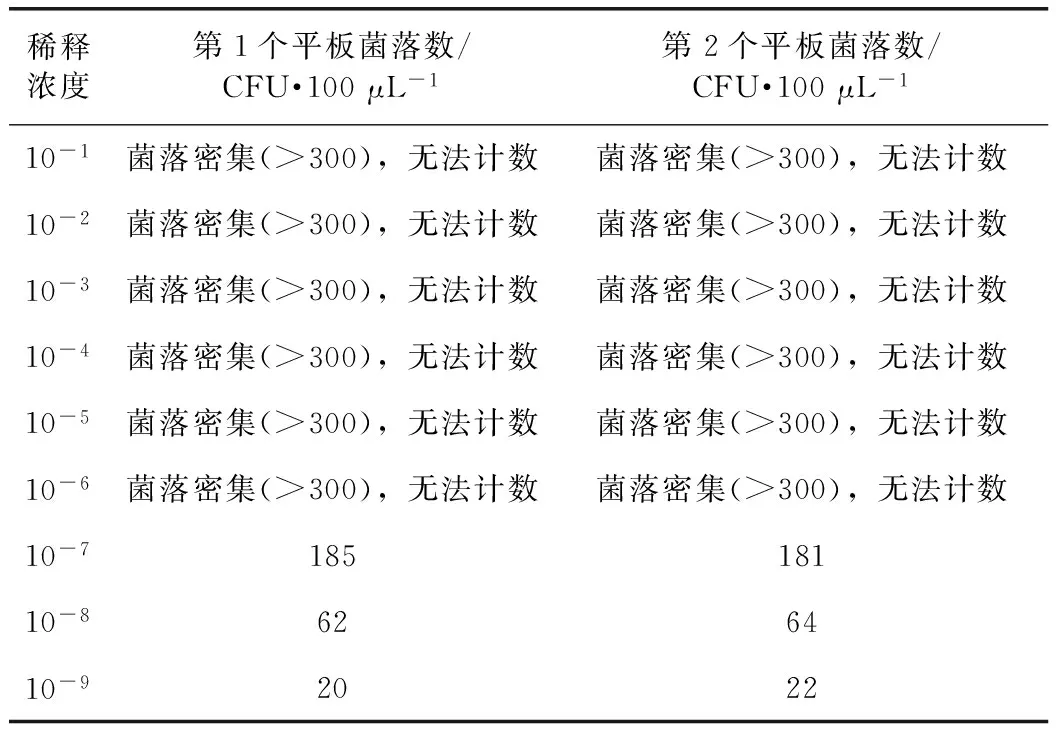
表4 肺炎链球菌计数结果
3.2.2 菌株毒力测试结果 10-4稀释浓度的菌液(即菌落浓度为6.3×106CFU·mL-1)致死率为85.7%,符合致死率在80%~100%之间试验菌液感染要求,确定为本次实验感染的菌落浓度。见表5。
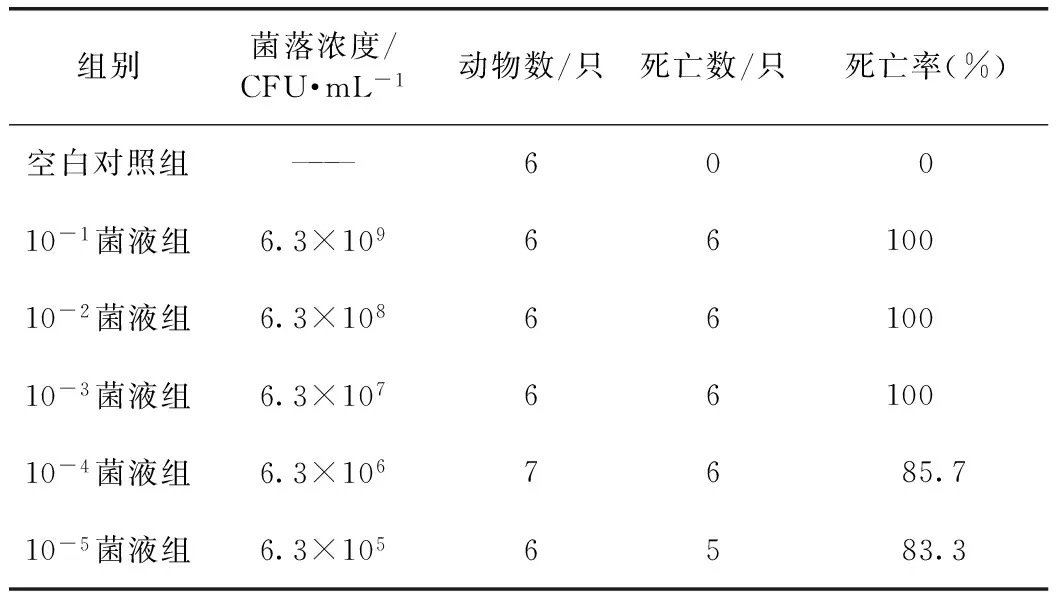
表5 肺炎链球菌致小鼠死亡的菌落浓度预试结果
3.2.3 在体抗菌实验结果 蔓菁膏3个剂量均可降低肺炎链球菌致小鼠感染死亡率(由90%降至15%~30%),中剂量效果最佳(死亡率为15%)。一般反应情况:各实验组小鼠在感染当天腹腔注射后1 min左右,与注射金黄色葡萄球菌后的反应有区别,未出现典型的扭体反应,动物在感染后数分钟出现中枢神经系统兴奋的症状,明显狂躁、抽搐、步态不稳、竖尾,之后兴奋症状消失,但活动减少,几乎不进食,见蜷卧、弓背等现象。感染后第2天,小鼠出现集中死亡,存活小鼠则形态萎靡。感染后3 d,存活小鼠进食开始增加,健康状况见有恢复迹象,3 d之后小鼠鲜有死亡。感染后7 d,处死小鼠,所有存活小鼠体重均有不同程度的减轻。尸解发现,模型对照组小鼠的肺部有明显的炎性病变,而其他给药组小鼠的肺部病变则不明显。见表6。
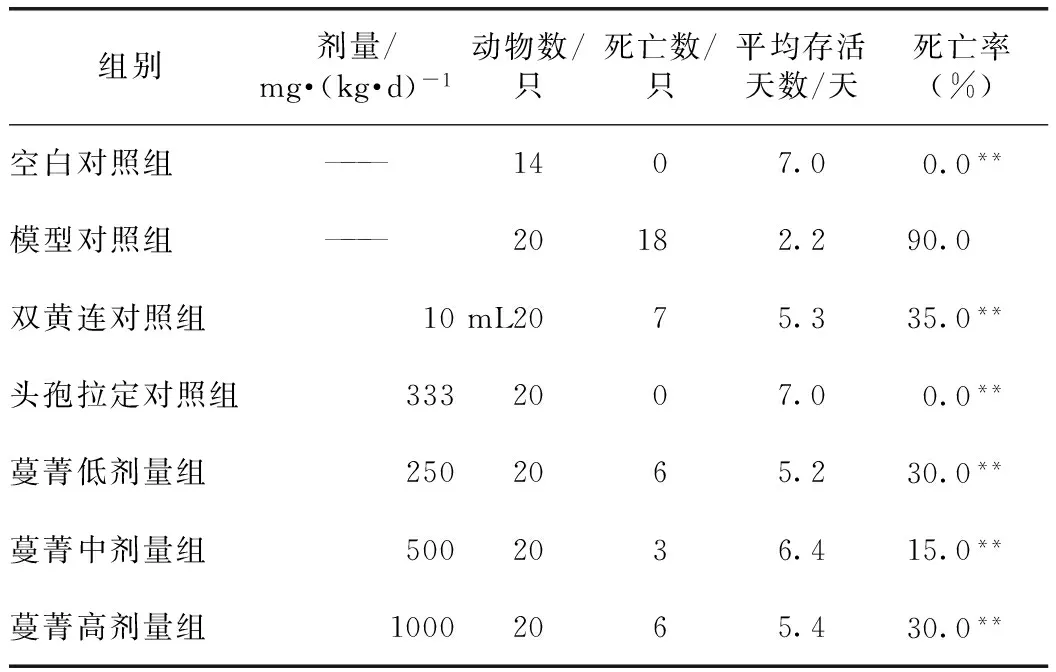
表6 蔓菁对肺炎链球菌感染小鼠的保护作用实验结果
3.3 对流感病毒感染小鼠的保护作用
蔓菁膏低、高剂量还能减轻流感病毒性小鼠肺炎的充血水肿实变并降低肺指数,低、高剂量组的肺指数抑制率分别为29.23%、28.38%,低剂量效果最佳,中剂量没有明显的作用。见表7。

表7 蔓菁对流感病毒性小鼠肺炎的保护作用实验结果
4 讨论
4.1 蔓菁的现代研究进展
蔓菁的原植物芜菁BrassicarapaL.为2年生草本,人工栽培历史悠久,原产欧洲,现亚洲和美洲均有栽培。国内广泛种植,如西藏拉萨市近郊、山南地区各县均有分布,四川省主要栽培在凉山州、甘孜州、阿坝州等高寒民族山区,新疆南部亦有广泛种植[10]。蔓菁具有抗缺氧[11]、提高免疫[12]、抗衰老[13]等药理作用。蔓菁主要含黄酮类[14](槲皮素、山柰酚-3-O-芸香糖苷等)、多糖类[15]、挥发油类[16](软脂酸、硬脂酸、油酸、亚油酸、亚麻酸及芥酸等)、氨基酸类[17](苏氨酸、缬氨酸、脯氨酸、蛋氨酸、甘氨酸、亮氨酸、苯丙氨酸、酪氨酸、丙氨酸、胱氨酸、色氨酸、异亮氨酸等)等化学成分。
《中华人民共和国卫生部药品标准》1995年版(藏药·第一册)[18]和《西藏自治区藏药材标准》[19]均收载有蔓菁膏,前者仅有“蔓菁膏为十字花科植物芜菁(蔓菁)的根熬制的浸膏”的简单描述,后者对蔓菁膏进行了鉴别项下的薄层鉴别和检查项下的水分测定。《中华人民共和国卫生部药品标准》1998年版(维吾尔药分册)[20]将芜菁子的质量标准收入正文,主要对其进行了鉴别项下的显微鉴别和薄层鉴别。本课题组开展了蔓菁膏的质量标准提高研究,建立了TLC、水分、总灰分、水中不溶物、含量测定等质量控制方法[21],并被收录入即将出版的《四川省藏药材标准》中。
4.2 蔓菁在体抗病原微生物作用的特点
药物的体内抗菌、抗病毒试验不仅能反映药物对细菌的直接作用,还能反映药物对机体反应性的影响,特别是对非特异性抵抗力的影响,但是中药直接对抗病原微生物导致动物死亡的作用较弱[22],主要表现为调节炎症和免疫反应,作用靶点不仅为机体免疫系统[23]。
蔓菁膏对肺炎链球菌小鼠具有保护作用,可明显降低肺炎链球菌致小鼠感染死亡率,这在中药和民族药的在体抗病原微生物研究中还是不多见的;蔓菁膏能减轻流感病毒感染导致的小鼠肺炎充血水肿实变,保护作用有限,为其临床应用于治疗“肺燥咳嗽”提供了药理学依据;蔓菁膏对金黄色葡萄球菌感染小鼠的保护作用不明显。
蔓菁膏3个剂量的量效关系不成线性,可能与剂量设置数较少有关。蔓菁膏3个剂量均可降低肺炎链球菌致小鼠感染死亡率(由90%降至15%~30%),中剂量效果最佳(死亡率为15%),低剂量和高剂量者均为30%;蔓菁膏低、高剂量还能减轻流感病毒性小鼠肺炎的充血水肿实变并降低肺指数,低、高剂量组的肺指数抑制率分别为29.23%、28.38%,低剂量效果最佳,中剂量没有明显的作用(11.50%)。
4.3 蔓菁在体抗病原微生物作用的药效物质基础分析
1969年,世界权威科学杂志“Nature”首次发文阐述了香菇多糖的抗肿瘤作用。随后,中药中多糖的免疫调节、抗肿瘤、降血糖、降血脂、抗氧化、抗衰老、抗病毒、保护胃肠系统等多种生物学活性逐渐被证实,如枸杞多糖、灵芝多糖、灰树花多糖、银耳多糖、熟地多糖、麦冬多糖等[24]。
本课题组测得蔓菁多糖含量的平均值为28.22%[21],故推测蔓菁膏治疗急性支气管炎的机制可能主要不是抗病原微生物,而与调节免疫、抗炎、镇咳、祛痰、缓解支气管痉挛等药理作用有关[25],其药效物质基础可能为蔓菁多糖。因此,结合血清药物化学方法,开展蔓菁膏及其多糖的止咳、抗炎、调节免疫等研究,有望揭示其药效物质基础和作用机制。
[1] 国家中医药管理局《中华本草》编委会.中华本草:藏药卷[M].上海:上海科学技术出版社,2002:349.
[2] 嘎务多吉.晶镜本草[M].北京:民族出版社,1995.
[3] 新疆维吾尔自治区食品药品监督管理局.新疆维吾尔自治区中药维吾尔药饮片炮制规范[M].乌鲁木齐:新疆人民卫生出版社,2010.
[4] 叶任高,陆再英.内科学:第六版[M].北京:人民卫生出版社,2004:13.
[5] 王宇,游佳莉,陈一龙,等.均匀设计法优化藏药蔓菁膏提取工艺的研究[J].世界科学技术—中医药现代化,2014,16(1):167-170.
[6] 赵瑞利,韩文瑜,韩俊友,等.新型牛蛙抗菌肽Temporin-La对金黄色葡萄球菌感染模型小鼠的治疗效果[J].中国生物制品学杂志,2013,26(8):1143-1150.
[7] 雷娜,李艳,何芳雁,等.解表方通过调节黏膜免疫保护上呼吸道感染模型小鼠的研究[J].中国实验方剂学杂志,2013,19(18):174-177.
[8] 晁伟平,牛亚奇,李友林.重楼克感滴丸对流感病毒FM1感染小鼠的保护作用[J].中华中医药杂志,2012,27(9):2451-2453.
[9] 林忠嗣.银翘散及其君臣药对急性流感病毒感染小鼠的Bcl-2与TGF-β相关性的研究[D].沈阳:辽宁中医药大学,2006.
[10] 李巧娟,肖春霞,张宏亮.维药恰玛古的研究现状[J].新疆中医药,2010,28(6):81-83.
[11] 谢玥,马超,蒋思萍,等.西藏芫根提取物对小鼠抗缺氧作用的初步研究[J].四川动物,2009,28(6):853-856.
[12] 孙艳,安熙强,马媛,等.恰玛古蜜膏对小鼠免疫功能的影响[J].中国医药导报,2010,7(6):20-22.
[13] 马龙,屈卫东,邓淑文,等.新疆芜菁抗衰老作用的实验研究[J].新疆医学院学报,1998,21(1):34-37.
[14] 孙莲,马彦玲,巴图尔,等.芜菁子化学成分的研究[J].华西药学杂志,2012,27(1):54-56.
[15] 孙莲,马合木提,曾玲力,等.柱前衍生化HPLC测定新疆芜菁多糖中的单糖[J].华西药学杂志,2010,25(2):171-172.
[16] 马彦玲,孙莲,张慧,等.气相色谱法测定芜菁子油脂中6种脂肪酸的含量[J].新疆医科大学学报,2010,33(11):1296-1298.
[17] 孙莲,张煊,王岩,等.柱前衍生化RP-HPLC测定芜菁子中的12种游离氨基酸[J].华西药学杂志,2008,23(4):490-491.
[18] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准:藏药(第一册)[S].北京:中华人民共和国卫生部,1995,341.
[19] 西藏自治区食品药品监督管理局.西藏自治区藏药材标准[S].拉萨:西藏人民出版社,2012:91-92.
[20] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准:维吾尔药分册[S].北京:中华人民共和国卫生部,1998,36.
[21] 王宇.藏药蔓菁提高缺氧耐受力的保健食品开发及质量控制初步研究[D].成都:成都中医药大学,2014.
[22] 李耿,彭绍忠,袁少华,等.众生丸在小鼠体内抗H5N1亚型禽流感病毒的实验研究[J].世界科学技术—中医药现代化,2009,11(3):365-370.
[23] 柴玉爽,孟甄,兰嘉琦,等.人参皂苷抗金葡菌肺感染的作用[J].世界科学技术—中医药现代化,2011,13(3):509-517.
[24] 崔换天,边育红,王丽.中药多糖对免疫功能调节的研究进展[J].中国现代中药,2013,15(4):286-2190.
[25] 孙涛.川贝母止嗽颗粒治疗急性支气管炎的作用机理研究[D].成都:成都中医药大学,2011.
ProtectiveEffectofEthnomedicineBrassicarapaonMiceInfectedwithStreptococcusPneumoniaeandInfluenzaVirus
LIZhangyu1,WANBo2,WANGZhang2*,ZHANGYing1,LIBo2,SANGQin1,BAIChengyang2,RENZhili2,MIAOShuyi2,TANGGuangxi2
(1.TaijigroupCo.,Ltd.,Chongqing401147,China;2.ChengduUniversityofTraditionalChineseMedicine,Chengdu611137,China)
Objective:To study the antibacterial and antiviral effect of the ethnomedicineBrassicarapainvivo,and reveal its effective mechanism to treat acute bronchitis.Methods:Brassicarapawas extracted according to the traditional method,the protective effect ofB.rapaextract was studied in low,middle and high dose [250、500、1000 mg(extract)·(kg·d)-1] on mice infected with Staphylococcus aureus,Streptococcus pneumoniae and influenza virus.Results:B.rapaextract was not able to protect the mice infected with Staphylococcus aureus,but had a certain role in the mitigation of animal enteritis lesions.Brassicarapaextract,in low,middle and high dose could reduce the mortality of the mice from 90% to 15%~30%,and the mortality of the middle dose was the best(15%).B.rapaextract in low and high dose reduced congestion and edema in real variable and pulmonary index on the mice infected with influenza virus,and the lung index inhibition rate were 29.23%,28.38%,respectively.There was no significant effect in the middle dose.Conclusion:B.rapahas the protective effect on mice infected with Streptococcus pneumoniae and influenza virus,but the dose effect relationship is not linear,and the result provides scientific basis forB.rapaused for treatment of “lung dryness cough”.
Brassicarapa;Streptococcuspneumoniae;Staphylococcusaureus;influenza virus;mice;lung dryness cough
10.13313/j.issn.1673-4890.2015.3.006
2014-10-27)
四川省食品药品监督管理局科研项目(301-377);四川省中医药管理局科技专项(2012-G-029);成都中医药大学科技发展基金(CGZH201201)
*
王张,男,硕士研究生导师,研究方向:民族药药理学;Tel:(028)61800160,E-mail:wzcqcd@163.com
