藏药郎庆阿塔对肝纤维化大鼠肝脏TGF-β1、α-SMA和瘦素受体的影响△
2015-09-25景欣悦丁永芳黄一平彭蕴茹
景欣悦,丁永芳,黄一平,彭蕴茹*
(1.南京中医药大学 第二临床医学院,江苏 南京 210023;2.南京中医药大学 附属中西医结合医院,江苏 南京 210028;3.江苏省中医药研究院,江苏 南京 210028)
·基础研究·
藏药郎庆阿塔对肝纤维化大鼠肝脏TGF-β1、α-SMA和瘦素受体的影响△
景欣悦1,丁永芳2,3,黄一平2,3,彭蕴茹2,3*
(1.南京中医药大学 第二临床医学院,江苏 南京210023;2.南京中医药大学 附属中西医结合医院,江苏 南京210028;3.江苏省中医药研究院,江苏 南京210028)
目的:研究藏药郎庆阿塔对肝纤维化大鼠肝脏TGF-β1、α-SMA和瘦素受体的影响。方法:以复合因素造成大鼠肝纤维化模型,模型大鼠经郎庆阿塔干预后,以免疫组化法检测肝组织中TGF-β1和α-SMA的表达水平,以荧光定量PCR(Q-PCR)法检测肝组织瘦素受体mRNA的水平。结果:由免疫组化实验结果发现郎庆阿塔能明显降低肝纤维化大鼠肝组织中TGF-β1和α-SMA的表达水平(P<0.01),Q-PCR结果表明郎庆阿塔能明显降低肝纤维化大鼠肝组织中瘦素受体mRNA的表达。结论:藏药郎庆阿塔具有明显减少肝纤维化大鼠肝脏TGF-β1、α-SMA和瘦素受体表达的作用。
藏药;郎庆阿塔;肝纤维化
肝纤维化是当前医学界急需解决的一个难题,目前临床上尚缺乏有效的治疗药物,而民族医药特别是藏医藏药在此疾病治疗领域显示出了很好的疗效。藏药“郎庆阿塔”是西藏那曲县藏医世家名人那本朗次仁祖传的经验方,此药至今已有580多年的历史,由牛黄、西红花、五灵脂、余甘子、印度獐牙菜等10余味药组成,具有清热解毒、舒肝利胆的功效,几百年来当地藏医将其用于肝病治疗效果显著[1-5],而近几十年来当地藏医在临床应用中发现其对肝纤维化具有很好的临床疗效。本课题组前期已从实验的角度证实了郎庆阿塔具有显著的抗肝纤维化作用[6-7],而本文进一步研究其对肝纤维化模型大鼠肝脏肝纤维化相关转化生长因子β1(TGF-β1)、α-平滑肌肌动蛋白(α-SMA)和瘦素受体的影响,以期为其临床应用及今后的新药研发提供科学依据。
1 材料
1.1动物
Wistar大鼠,♀♂各半,清洁级,购于上海斯莱克实验动物有限责任公司,合格证号:SCXK(沪)2007-0005。饲养环境为清洁级,饲养合格证号:SYXK(苏)2007-0026。
1.2供试品
郎庆阿塔(浸膏):含生药2.6055g·mL-1,批号:20110608,江苏省中医药研究院中药制剂研究室提供。
1.3阳性对照药及试剂
复方鳖甲软肝片(内蒙古福瑞中蒙药科技股份有限公司,0.5g/片,批准文号:国药准字Z19991011,批号:20110204);四氯化碳(CCl4)分析纯(南京化学试剂有限公司,批号:20101212);转化生长因子β1(TGF-β1)单克隆抗体(R&D Systems公司);α-平滑肌肌动蛋白(α-SMA)单克隆抗体(Santa Cruz公司);抗兔/鼠通用型免疫组化检测试剂盒(Dako公司);First Strand cDNA Synthesis Kit(Fermentas公司);SYBR Green qPCRMaster Mix(2X)(promega公司);Trizolpeagent[英潍捷基(INVITROGEN)公司];PCR扩增用引物(上海生工生物工程技术服务有限公司)。
1.4仪器
FEJ-2000B型电子天平(福州福日电子有限公司);PB303-N型电子分析天平(梅特勒-托利多仪器有限公司);HypercenterXP型组织脱水机(英国Shandon公司);Histocentre2型包埋机,(英国Shandon公司);MICROM-340E型切片机(德国Zeiss公司);BX51型显微镜(日本Olympus公司),StratageneMX3000P荧光定量PCR仪。
2 方法
2.1肝纤维化大鼠模型的建立及分组给药方法
清洁级Wistar大鼠104只,体重150~180g,雌雄各半,取14只作为正常对照组(不造模),其余90只按文献方法采用复合因素制备大鼠肝纤维化模型[6-8]。造模6周末随机处死12只造模大鼠,通过肝组织病理检查(H-E染色及Masson染色观察肝组织内纤维化程度)及血清肝功能指标来检查肝纤维化模型成功率。将造模大鼠按ALT、AST指标随机分为5组,即模型对照组,阳性药复方鳖甲软肝片组,郎庆阿塔给药高、中、低剂量组,另设正常对照组。各组大鼠于分组后即日(第7周)开始灌胃给药。郎庆阿塔高、中、低剂量组灌胃给予郎庆阿塔药液11.4、5.7、2.85g生药·kg-1,阳性药组则灌胃给予复方鳖甲软肝片0.55g·kg-1,正常及模型组均灌胃给予等容积的蒸馏水,所有大鼠灌胃容积均为10mL·kg-1,每日1次,连续灌胃给药7周。除正常对照组外,其余各组大鼠每周仍皮下注射1次40%CCl4/橄榄油溶液,剂量为0.3mL·(100g)-1,继续维持造模4周。
2.2观测指标
2.2.1肝脏组织中TGF-β1和α-SMA的表达 取肝右叶同一部位组织标本放入10%中性磷酸福尔马林液中固定,石蜡包埋切片,进行α-SMA、TGF-β1免疫组织化学染色。石蜡切片脱水,微波修复,3%H2O2灭活内源性过氧化物酶,滴加一抗,4℃过夜,滴加二抗,37℃孵育0.5h,所有切片同时DAB显色,苏木素复染,脱水、透明、封片。在全自动图像分析系统上,采用HPIAS-2000型图像分析软件进行半定量分析,每组取10只大鼠,每只大鼠取一张切片,随机选取每张切片5个视野,400倍放大,以细胞浆呈明显黄色(棕黄色)作为阳性细胞,测定每个视野下阳性反应的平均光密度、阳性反应面积和所有细胞总面积,计算阳性面积率(阳性面积率=单位面积中阳性反应的总面积/单位面积中细胞的总面积×100%)。以每例5个视野的平均光密度、阳性面积率的平均值作为该例的测量值。
2.2.2肝脏组织中瘦素受体mRNA的表达 采用实时荧光定量 PCR(Real-time Q-PCR)法。采用TrizoL法提取肝组织总RNA,逆转录合成 cDNA;瘦素受体引物由Primer premier5.0software软件自行设计,由南京生兴生物公司合成。引物序列见表1。使用Stratagene MX3000P实时荧光定量PCR仪进行实时定量扩增。SYBR反应体系25μL。反应条件:95℃、10min,1个循环;95℃、15s,60℃、30s,40个循环;72℃、30s。采用实时荧光定量 PCR仪自带软件计算获得产物的 Ct值。溶解曲线如图1所示,引物特异性较好,采用相对定量2-△△Ct法计算瘦素受体mRNA相对表达量。
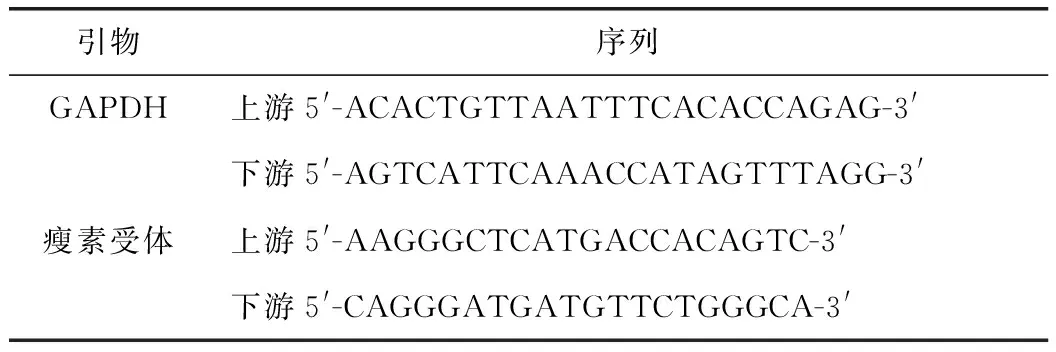
表1 内参基因及目的基因引物序列
图1 Q-PCR溶解曲线
2.3数据统计

3 结果
3.1肝脏组织H-E染色结果
由图2H-E染色结果可见,正常对照组大鼠肝脏组织未见明显病理学改变,肝细胞以中心静脉向周围放射状排列,肝细胞无异型,间隙中见散在枯否细胞(见图2A),造模6周模型组大鼠肝组织小叶结构被破坏,可见胶原纤维组织增生、穿插,将肝组织分割为大小不等的圆形或椭圆形假小叶,并见大量炎症细胞浸润(见图2B)。表明模型组大鼠已形成明显的肝纤维化病变。

注:A. 正常对照组;B. 模型组造模6周。图2 大鼠肝组织H-E染色图(×200)
3.2肝脏组织TGF-β1和α-SMA的免疫组化检查结果
为了清楚显示染色情况,通过光镜观察免疫组化切片(见图3、图4)。TGF-β1阳性细胞为棕黄色,呈胞浆表达,正常对照组仅在中央静脉周围有轻微表达,模型组表达明显增强,主要分布在中央静脉周围、肝包膜附近及纤维组织增多的区域,在肝窦内间质细胞及汇管区炎症细胞胞浆内,部分胆管上皮细胞、肝细胞胞浆也有表达,与增生的纤维组织分布相一致。而阳性对照组和高剂量组TGF-β1阳性细胞也仅见轻微表达(图见3C、3D)。如表2所示,与正常组比较,模型组大鼠肝组织中TGF-β1表达水平显著升高(P<0.01)。与模型组比较,各给药组对造模大鼠肝组织中增加的TGF-β1表达水平有明显抑制作用(P<0.01)。
镜下可见,α-SMA在胞浆表达,正常对照组只表达于小动脉及小静脉,在胆管无表达。模型组α-SMA主要表达于汇管区及纤维间隔,且呈长椭圆形或梭形(见图4)。实验表明模型组α-SMA免疫组织化学染色表达明显升高,显著高于正常组(P<0.01)。郎庆阿塔颗粒各给药组、阳性药鳖甲软肝片组的α-SMA免疫组织化学染色表达与模型组比较明显减少(P<0.01)。
表2 郎庆阿塔对肝纤维化模型大鼠肝脏组织TGF-β1和α-SMA表达的影响
注:与模型对照组比较,*P<0.05,**P<0.01。

注:A.正常对照组;B.模型组;C.阳性药组;B.高剂量组。图3 大鼠肝组织TGF-β1免疫组化图(×200)

注:A.正常对照组;B.模型组;C.阳性药组;B.高剂量组。图4 大鼠肝组织α-SMA免疫组化图(×200)
3.3瘦素受体mRNA的表达

注:与正常对照组比较,***P<0.001;与模型对照组比较,#P<0.05,##P<0.01。图5 大鼠肝组织中瘦素受体的mRNA表达
各组大鼠肝组织瘦素受体mRNA表达如图5所示,模型组大鼠肝脏瘦素受体mRNA水平显著升高(P<0.001)。郎庆阿塔颗粒高、中剂量给药组、阳性药鳖甲软肝片组大鼠肝脏瘦素受体mRNA水平与模型组比较显著降低(P<0.05,P<0.01)。
4 讨论
肝纤维化的形成是一个多因素、多细胞参与的复杂过程,其中一些细胞因子的作用日益受到人们关注。TGF-β1被认为是目前致肝纤维化最重要的细胞因子之一,与肝纤维化的发生机制有密切关系[9-10]。TGF-β1在肝纤维化形成过程中可促进胶原基因表达,促进细胞外基质(extracellular matrix,ECM)合成与沉积,并且抑制其降解;同时,TGF-β1也是引起肝星状细胞(hepatic stellate cell,HSC)激活并促进其表达ECM最有力的细胞因子,在促进HSC活化时起中心作用[11]。研究表明,肝纤维化发生过程中,多种致病因子启动了肝纤维化的形成,使间质细胞、炎症细胞等对TGF-β1合成增加,TGF-β1使HSC活化、增殖,HSC又可分泌大量TGF-β1,这种自分泌的正反馈机制使TGF-β1加强HSC合成胶原,从而导致肝纤维化的持续发展[12-14]。因此,抑制TGF-β1的表达对于肝纤维化的治疗至关重要。本课题组前期已成功建立了大鼠肝纤维化模型,造模大鼠血清ALT及AST水平显著升高,病理组织学检查可见胶原纤维组织增生、穿插,将肝组织分割为大小不等的圆形或椭圆形小叶,并见大量炎性细胞浸润。Masson染色示肝组织内大量纤维组织增生,表明造模大鼠有明显肝纤维化病变,模型适用于研究药物的抗肝纤维化作用。从实验的角度证实郎庆阿塔具有显著的抗肝纤维化作用[6-7],肝血生化的分析结果表明,郎庆阿塔可显著降低肝纤维化大鼠血清ALT、AST、ALP、T-BIL水平及肝纤维化四项指标(HA、LN、PIIINP及CIV)[6],并能明显降低肝纤维化大鼠肝组织中异常增高的羟脯氨酸水平及I型胶原mRNA表达水平[6-7],病理组织学检查发现郎庆阿塔对肝纤维化大鼠肝纤维组织增生有显著改善作用[7]。本文研究发现,与模型大鼠相比,给予郎庆阿塔处理的大鼠其肝脏组织中TGF-β1的表达显著降低。
目前研究显示,HSC的激活与增生是肝纤维化发生的中心环节,激活后的HSC进一步转化为肌成纤维细胞,合成大量细胞外基质并沉积在肝组织,最终导致肝纤维化的形成。激活的HSC表达α-SMA,因此,α-SMA被认为是HSC活化的标志[15-16]。本研究表明,郎庆阿塔处理肝纤维化大鼠肝脏组织中α-SMA的表达明显降低,与模型组相比差异有统计学意义。
瘦素主要是由脂肪组织分泌,通过与瘦素受体结合调节中枢及外周组织重要的生理功能。正常肝组织不表达瘦素,而有瘦素受体的表达[17],通过与肝细胞瘦素受体结合,参与调节葡萄糖的产生、转运、代谢,脂肪的分解合成及胰岛素信号的调控[18]。研究表明,瘦素及瘦素受体与肝纤维化的发生密切相关。Sakaida等[19]采用瘦素受体缺陷大鼠模型,连续8周注射猪血清建立大鼠肝纤维化模型,发现瘦素受体缺陷的雄性Zucker(fa/fa)大鼠肝脏羟脯氨酸含量较杂合子大鼠(fa/-)显著降低,Zucker(fa/fa)大鼠α-SMA的mRNA也显著低于对照组。证明瘦素参与了肝脏纤维化的发生。本研究发现,模型组大鼠肝组织瘦素受体mRNA表达明显升高,说明瘦素确实参与了肝纤维化的进程。郎庆阿塔处理组大鼠肝组织瘦素受体mRNA表达明显降低。
由于肝纤维化发生与发展过程极为复杂,是由多因素、多环节共同作用的结果,因此,只针对单一环节的治疗药物难以达到满意疗效,这也是目前肝纤维化临床治疗的难点,而在这方面,传统医药则展现了良好的治疗前景。近年来,藏医药治疗肝纤维化的作用不断得到临床和实验研究证实。郎庆阿塔作为治疗肝病的藏药经验方,有着深厚的临床基础,但关于其作用机理仍未得到阐明。本研究证实,郎庆阿塔处理可降低肝纤维化大鼠模型肝纤维化相关因子TGF-β1、α-SMA和瘦素受体的表达,但其抗肝纤维作用机制是否直接通过抑制这些肝纤维化相关因子,还需要进一步实验的研究和探讨。
[1] 高玉萍,王宁萍.藏药松石丸对大鼠实验性肝纤维化的影响[J].中国实验方剂学杂志,2005,11(5):47-48.
[2] 更登.藏药久美70味松石丸对实验性大鼠肝硬化的影响[J].中国民族民间医药杂志,2002(54):39-41.
[3] 冯海莲,王宁萍.七十味松石丸对大鼠实验性肝硬化的影响[J].中成药,2005,27(6):741-742.
[4] 卓玛,兰科加.藏药十八味大象红花散治疗肝硬化36例临床分析[J].中国民族医药杂志,2007(3):21,44.
[5] 德庆白珍.复方藏药达堆治疗肝硬化的临床试验[J].中国循证医学杂志,2004,4(2):129-131.
[6] 彭蕴茹,丁永芳,罗宇慧,等.藏药郎庆阿塔治疗肝纤维化的实验研究[J].中国实验方剂学杂志,2012,18(11):189-194.
[7] 薛娟,彭蕴茹,丁永芳,等.藏药郎庆阿塔对肝纤维化大鼠胶原代谢的影响[J].中国实验方剂学杂志,2012,18(24):260-265.
[8] 高爱梅,平洁,汪晖.吲哚-3-原醇对复合因素所致肝纤维化大鼠的治疗作用及部分机制研究[J].中国药理学通报,2011,27(6):764.
[9] Brenner DA.Molecular pathogenesis of liver fibrosis[J].Trans Am ClinClimatolAssoc,2009,120:361-368.
[10] Popov Y,Schuppan D,Popov Y,et al.Targeting liver fibrosis:strategies for development and validation of antifibrotic therapies[J].Hepatology,2009,50(4):1294-1306.
[11] Friedman SL.Mechanisms of hepatic fibrogenesis[J].Gastroenterology,2008,134(6):1655-1669.
[12] Jiao J,Friedman SL,Aloman C.Hepatic fibrosis[J].CurrOpinGastroenterol,2009,25(3):223-229.
[13] Ghiassi-Nejad Z,Friedman SL.Advances in antifibrotic therapy[J].Expert Rev GastroenterolHepatol,2008,2(6):803-816.
[14] Friedman SL.Hepatic fibrosis -- overview[J].Toxicology,2008,254(3):120-129.
[15] Mallat A,Lotersztajn S.Liver fibrosis:from pathophysiology to therapeutic openings[J].GastroenterolClinBiol,2009,33(8-9):789-798.
[16] Tsukada S,Parsons CJ,Rippe RA.Mechanisms of liver fibrosis[J].ClinChimActa,2006,364(1-2):33-60.
[17] 甘立霞.瘦蛋白信号转导及瘦蛋白抵抗机制[J].生命的化学,2011,3l(5):656-661.
[18] 刘芹,李云,甘立霞.瘦素在肝脏中的生理功能及其在肝脏疾病中的作用[J].现代医药卫生,2012,28(6):876-879.
[19] Sakaida I,Jinhua S,Uchida K,et al.Leptin receptor-deficient Zucker(fa/fa)rat retards the development of pig serum-induced liver fibrosiswithKupfercelldysfunction[J].Life Sci,2003,73(19):2491-2501.
EffectofLangQingATaonTGF-β1,α-SMAandOB-RofCollageninRatHepaticFibrosisModel
JINGXinyue1,DINGYongfang2,3,HUANGYiping2,3,PENGYunru2,3*
(1.No.2ClinicalMedicalCollege,NanjingUniversityofChineseMedicine,Nanjing210023,China;2.AffiliatedJiangsuProvincialHospitalofIntegratedTraditionalChineseandWesternMedicine,NanjingUniversityofChineseMedicine,Nanjing210023,China;3.JiangsuProvincialAcademyofTraditionalChineseMedicine,Nanjing210028,China)
Objective:To study the effect of Lang Qing A Ta(LQAT)on TGF-β1,α-SMA and OB-R of collagen in rat hepatic fibrosis model.Methods:Composite factors were used to induce the hepatic fibrosis models in rats and the model rats were orally treated with corresponding decoctions. The levels of TGF-β1andα-SMA in livers were measured by immunohistochemisty.The mRNA expression of leptin receptor was detected with real-time Q-PCR.Results:LQAT decoction could remarkably decrease the levels of TGF-β1andα-SMA in livers of hepatic fibrosis rats.The mRNA expression of OB-R in the rat liver tissues of the LQAT treatment groups was significantly decreased as compared with that of the model group.Conclusion:The therapeutic effect of LQAT decoction on hepatic fibrosis was correlated closely with inhibiting HSC activation and mRNA expression of OB-R in the rat liver tissues.
Tibetan medicine;Lang Qing A Ta;hepatic fibrosis
江苏省中医药局项目(LZ13081)
*
彭蕴茹,研究员,研究方向:中药药理;Tel:(025)52362105,E-mail:pengyunru@126.com
10.13313/j.issn.1673-4890.2015.12.007
2015-10-14)
