微波及碱性溶液改性活性炭对丙酮吸附性能的影响
2015-09-24梁鑫李立清刘峥李海龙马卫武姚小龙
梁鑫,李立清,刘峥,李海龙,马卫武,姚小龙
微波及碱性溶液改性活性炭对丙酮吸附性能的影响
梁鑫,李立清,刘峥,李海龙,马卫武,姚小龙
(中南大学 能源科学与工程学院,湖南 长沙,410083)
对商业活性炭分别经过600,700和800 ℃微波辐照加热处理,以及NaOH,Na2CO3和NaHCO3溶液浸渍处理。采用比表面积及孔径分析仪、Boehm滴定、傅里叶转换红外光谱(FTIR) 对活性炭的物化性质进行表征,并且在10 ℃以丙酮为吸附质进行固定床吸附实验。研究结果表明:微波改性后,活性炭的比表面积、总孔容小幅度减小,但微孔比表面积显著增大;随着温度升高,表面酸性基团大量分解,碱性基团逐渐形成;碱性溶液改性后,比表面积和孔容均减小;改性溶液碱性越强,表面碱性基团总量越大,酸性基团完全被去除;丙酮吸附量与活性炭微孔孔容具有良好的线性相关性,吸附量与活性炭表面碱性基团的含量成反比;Langmuir方程和Freundlich方程均能较好地描述丙酮在活性炭上的吸附,Langmuir方程更加适合;吸附能与活性炭表面含氮官能团总量成正比。
改性活性炭;吸附;丙酮;微波;碱性溶液
丙酮是常见于医药、塑料、橡胶、制革、油漆等化工生产过程的挥发性有机化合物(VOCs)之一,在常温下极易挥发,人体长时间接触会引起急、慢性中毒。由于VOCs在大气中广泛存在以及对人体的有害性,对其进行控制引起了广泛关注。活性炭(AC)是一种具有很大比表面积的多孔吸附材料,被广泛应用于VOCs的去除[1−2]。活性炭的物化性质对其吸附性能有很大的影响,因此,通过改性提高活性炭的吸附性能受到很多学者的关注。热处理和化学处理能改变活性炭的表面化学特性[3],同时也是有效调节孔结构的方法,因此被广泛利用。微波加热属于内加热,升温迅速,微波场中无温度梯度存在,受热均匀;微波能量靠偶极子转动和离子传导,加热效率高,在活性炭热改性研究中逐渐得到重视。很多通过微波改性使得活性炭对某种污染物吸附量增大的研究已被报道[4−5]。同时也有学者对比研究了微波加热和传统加热对活性炭吸附行为的影响,发现微波改性活性炭具有更大的微孔孔容及更大的吸附容量[6]。利用碱性溶液改性活性炭的研究较少[7],但碱性溶液改性活性炭能影响活性炭的物化性质,也是一种可行的方法。然而,很少有学者对比研究高温微波辐照改性和碱性溶液浸渍改性对活性炭吸附VOCs的影响。为此,本文作者选用商业煤基颗粒活性炭为原料,分别采用不同温度下微波辐照改性1 mol/L NaOH,Na2CO3和NaHCO3溶液浸渍改性,借助比表面积及孔径分析仪、Boehm滴定、FTIR对活性炭的物化性质进行表征,进行丙酮的固定床吸附实验,从多种角度探讨2种改性方法对活性炭本身及其吸附丙酮性能的影响,以便为活性炭在VOCs控制领域的多功能设计及新性能开发提供参考。
1 实验
1.1 活性炭改性
1.1.1 微波辐照改性
称取50 g商业活性炭(RS-5型,河南长葛利民活性炭有限公司)进行预处理:将活性炭置烧杯中采用电子万用炉用水煮沸30 min(煮沸);煮沸后的活性炭用去离子水洗涤4~5次(漂洗);漂洗后的活性炭置真空干燥箱(DZF型,北京市永光明医疗仪器厂)中于 110 ℃干燥12 h(烘干)。所得样品为未改性活性炭,记为AC-1。称取10 g AC-1置于微波高温烧结炉(WZ3/2.45型,长沙隆泰科技有限公司)中,在流量为600 mL/min的高纯度N2气氛下进行微波辐照,微波频率为2.45 GHz,在600,700和800 ℃这3个温度点下加热30 min,冷却后在真空干燥箱中于恒温 110 ℃干燥24 h,所得样品分别记为AC-600,AC-700和AC-800。
1.1.2 碱性溶液改性
分别利用1 mol/L NaOH,Na2CO3和NaHCO3200 mL浸泡10 g AC-1,将装有碱性溶液和活性炭的碘量瓶在集热式恒温加热磁力搅拌器(DF-101S型,河南省予华仪器有限公司)中水浴恒温50 ℃下处理12 h,随后用去离子水漂洗4~5次,然后在真空干燥箱中恒温110 ℃下干燥24 h,所得样品分别记为AC-NaOH,AC-Na2CO3和AC-NaHCO3。
1.2 活性炭测试
1.2.1 孔结构表征
活性炭样品的比表面积及孔结构参数采用低温氮气吸附法进行测定。利用比表面积及孔径分析仪SA3100 (BECKMAN COULTER, USA) 测定77 K下高纯N2在活性炭上的吸附等温线。BET比表面积BET由标准BET法得到;微孔孔容micro和微孔比表面积micro由t-Plot方法计算得到;中孔孔容meso和大孔孔容macro基于BJH法计算得到,总孔容total由相对压力为0.981 4时的液氮吸附量换算成液氮体积得到;孔径分布是基于BJH方法通过分析吸附或脱附等温线分支得到。
1.2.2 表面官能团表征
利用Boehm滴定定量测得活性炭表面总酸性基团、总碱性基团、羧基以及酚羟基的含量;采用傅里叶转换红外光谱仪NEXUS670 (Nicolet, USA) 表征活性炭表面特定结构的官能团;通过EDAX元素分析仪测试AC-1的质量分数。
1.3 吸附实验
固定床吸附实验装置如图1所示,该装置由配气系统、恒温系统、固定吸附床和测试系统组成。室内空气经过硅胶干燥器干燥后,一部分直接进入混合器,另一部分穿过微型喷淋区和恒温水箱恒温区(DC1015型,上海天平仪器公司)得到饱和有机蒸汽。将干燥空气和饱和有机蒸汽在混合器中混合,调节阀门改变有机气体浓度,混合气体用真空泵吸取并泵入固定床进行吸附,尾气经净化后排放。固定床吸附柱进气质量浓度和出气质量浓度由气相色谱仪(SP-6890型,山东鲁南瑞虹化工仪器公司)测定,待出气质量浓度与进气质量浓度相同并保持30 min左右时,则认为吸附已达平衡[8]。在每次实验中,将4 g活性炭样置于内径为1.1 cm石英管吸附柱,吸附温度用恒温水箱保持在 10 ℃。AC-1,AC-600,AC-700和 AC-800的进气质量浓度均取12.17,17.49,50.95,77.94和107.22 g/m3;AC-NaOH,AC-Na2CO3和AC-NaHCO3的进气质量浓度均取9.51,19.01,38.02,76.04和190.11 g/m3。这些不同进气质量浓度即不同相对压力/0下(其中平衡压力可以通过克拉伯龙方程由进气浓度转换而来),利用电子天平称质量法(JA1203N型,上海精密科学仪器有限公司)得出不同质量浓度下7种活性炭对丙酮(分析纯AR, 衡阳市凯信化工试剂有限公司)的吸附量,从而得到丙酮的等温吸附线。
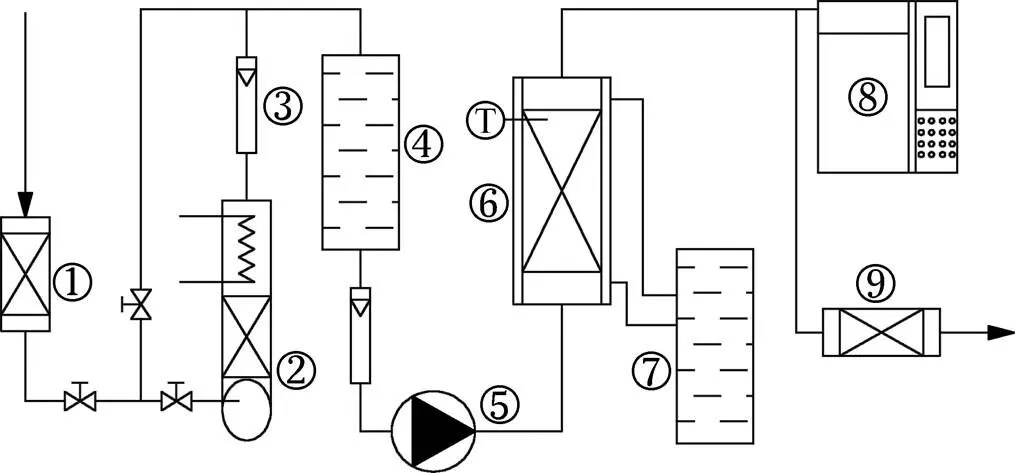
①—干燥器;②—有机气体发生器;③—流量计;④—混合器;⑤—真空泵;⑥—固定吸附床;⑦—恒温水箱;⑧—气相色谱仪;⑨—尾气处理
2 结果与讨论
2.1 AC-1的元素分析
表1所示为AC-1的元素质量分数分布情况,它含有C,O,Al,Si,Nb,Ca和Fe共7种元素,其中碳元素的质量分数为83.53 %。据文献[9],煤基活性炭中含有一定质量分数的氧化物成分,例如Al2O3,SiO2,Nb2O5,CaO和Fe2O3,以及氢氧化物与金属盐如Ca(OH)2和CaCO3等,这些物质组成活性炭的灰分,灰分附着在活性炭的孔隙中,影响活性炭的孔隙结构,从而影响到活性炭的吸附行为。

表1 AC-1的元素分析(质量分数)
微波改性后,表面含氧官能团以CO或者CO2的形式分解[3],采用碱性溶液浸渍活性炭,则可溶解某些碱溶性氧化物,将氧化物变为可溶性盐类,经水洗去除,从而使活性炭的灰分降低,提高吸附活性,可能的反应如下:
SiO2+OH−→SiO32-+H2O
Al2O3+OH−→AlO2-+ H2O
2.2 改性对物理结构的影响
2.2.1 比表面积及孔容
表2所示为活性炭的比表面积及孔容测试结果。由表2可知:AC-1的比表面积、总孔容均最大,分别为971.74 m2/g和0.517 5 mL/g,AC- Na2CO3的比表面积和总孔容均为最小,分别为757.23 m2/g和0.367 0 mL/g。微波改性之后,BET比表面积和总孔容随着温度的增加先减小后增大,BET比表面积和总孔容由大至小的活性炭为AC-1,AC-800,AC-600和AC-700,但微孔比表面积由大至小的活性炭顺序与之刚好相反,AC-700具有最大的微孔比表面积773.67 m2/g,比AC-1大156.27 m2/g。而且与AC-1相比,AC-700微孔孔容占总孔容的比例micro/total由72%升至83%,这说明在600~700 ℃范围内,形成了很多新的微 孔[10]。当温度为700~800 ℃时,微孔比表面积和微孔孔容又降低。这可能是由于一部分较小孔径微孔被堵塞,同时,中孔孔容和大孔孔容也有一定程度降低,这可能是某些炭骨架的塌陷引起。
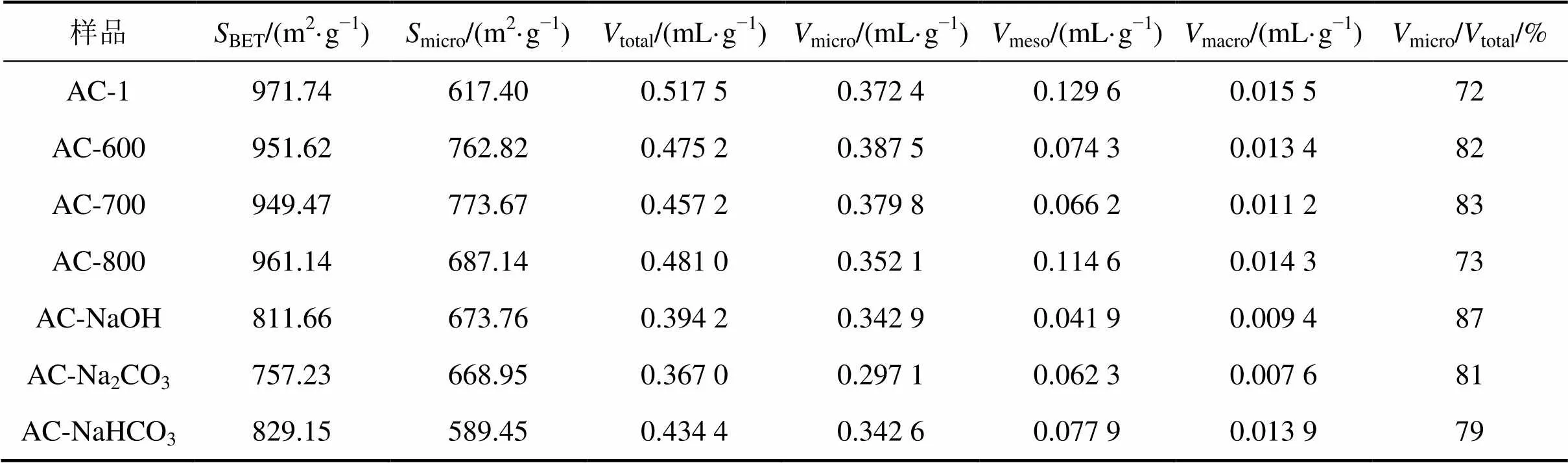
表2 活性炭的孔结构参数
碱性溶液改性之后,BET比表面积、总孔容、中孔孔容、大孔孔容均明显减小,其原因可能是碱性溶液与活性炭表面物质反应生成某些盐类物质(如硅酸盐、偏铝酸盐)对孔道造成堵塞,也有可能是改性溶液本身残留在活性炭孔道表面,干燥后析出的结晶固体局部堵死某些孔道。微孔孔容较小幅度减小,微孔孔容占总孔容的百分比则不同程度地增大,这可能是堵塞一部分孔道的同时,碱性溶液与炭表面物质反应生成的气体打开了一部分原有的封闭微孔。
2.2.2 孔径−孔容分布曲线
活性炭的孔径−孔容分布对其吸附性能有很大影响,微孔是吸附质的主要驻留场所,中孔、大孔则主要起通道作用[11]。图2所示为活性炭的孔径−孔容分布曲线。由图2可知:孔径分布范围较广,为0.45~182.00 nm,7种活性炭均以微孔分布为主,只存在少量中孔、大孔。主要孔容的孔径分布范围如表3所示。
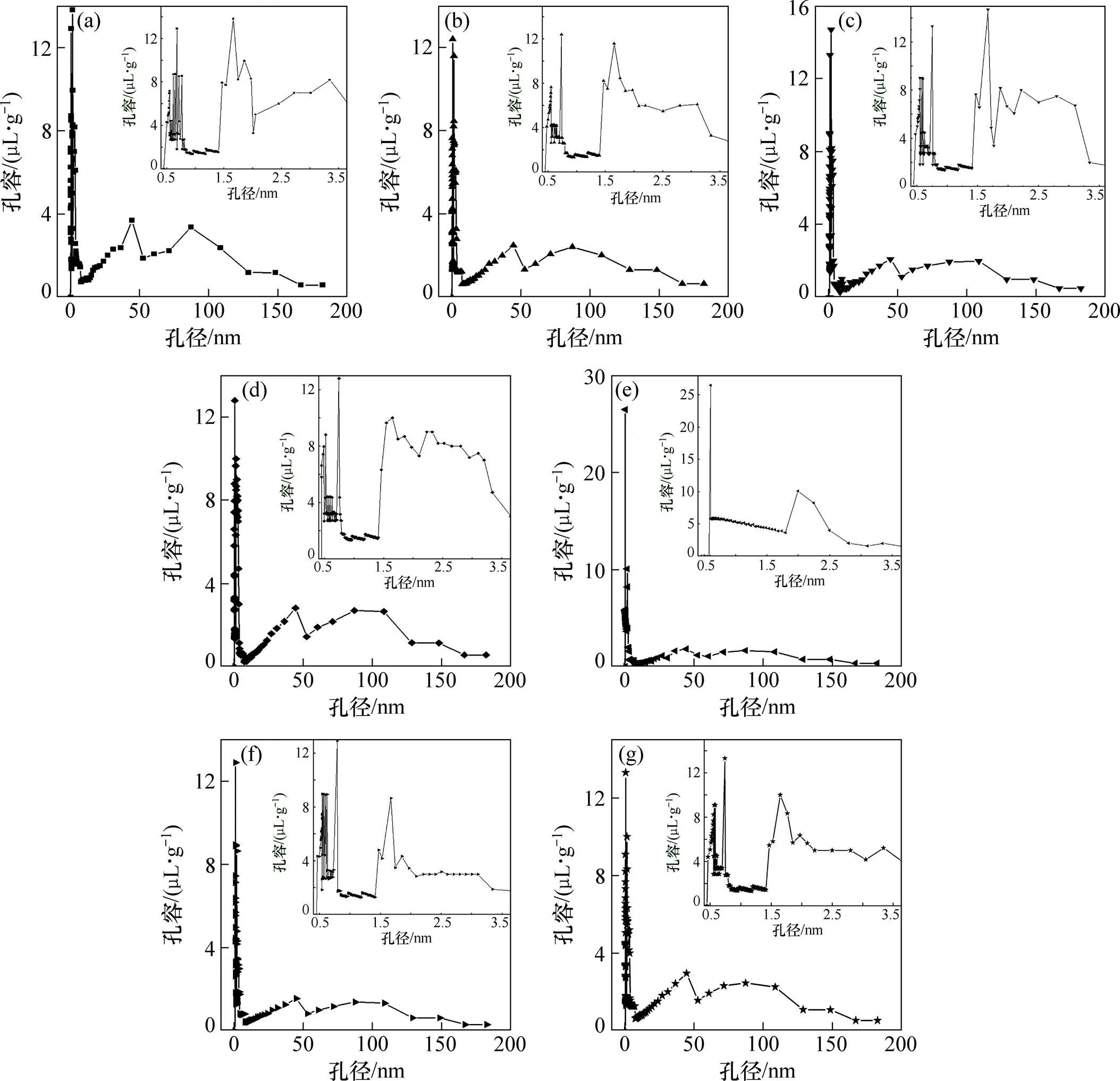
样品:(a) AC-1;(b) AC-600;(c) AC-700;(d) AC-800;(e) AC-NaOH;(f) AC-Na2CO3;(g) AC-NaHCO3
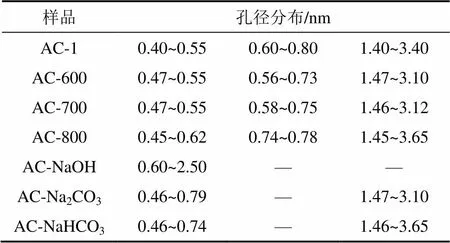
表3 主要孔容的孔径分布
微波改性后,大、中孔段孔径−孔容分布曲线与AC-1的曲线基本相似,但AC-600,AC-700和AC-800在0.6~0.7 nm孔径段的孔容与AC-1的孔容相比明显减小。碱性溶液改性后,大、中孔段孔径−孔容分布同样变化不大,AC-Na2CO3,AC-NaHCO3与AC-1在0.55~0.75 nm孔径段的孔容有较明显差别。与其他6种样品相比,AC-NaOH在0.6~1.6 nm孔径段的孔容分布非常均匀,平均孔容约为0.005 mL/g,并且AC-NaOH中不存在孔径在0.6 nm以下的微孔。
2.3 改性对表面官能团的影响
2.3.1 Boehm滴定
表4所示为Boehm滴定结果。从表4可见:微波改性后,酚羟基量、羧基量逐渐减小,温度越高,酸性基团分解量越大,AC-600和AC-700酸性基团总量分别为AC-1的40.8%和17.7%;当温度到达800 ℃时,酸性基团完全分解。温度升高,碱性基团则逐渐形成[12],含有碱性基团总量的样品由大至小的顺序为AC-800,AC-700,AC-600和AC-1,当温度为800 ℃时,碱性基团总量增大到约为未改性活性炭的2.6倍。有研究表明活性炭的碱性特征主要来源于芳香烃内非离域化的π电子,含氧官能团从活性炭表面去除之后,这种碱性特征就会加强[13],所得到的结果也与文献 [14]中的结果相同。碱性溶液改性后,表面酸性基团与碱性溶液完全反应,活性炭表面酸性基团、酚羟基、羧基的量均为0 mmol/g。含有碱性基团总量的样品由大至小的顺序为:AC-NaOH,AC-Na2CO3和AC-NaHCO3,改性溶液碱性越强,碱性基团总量越大。
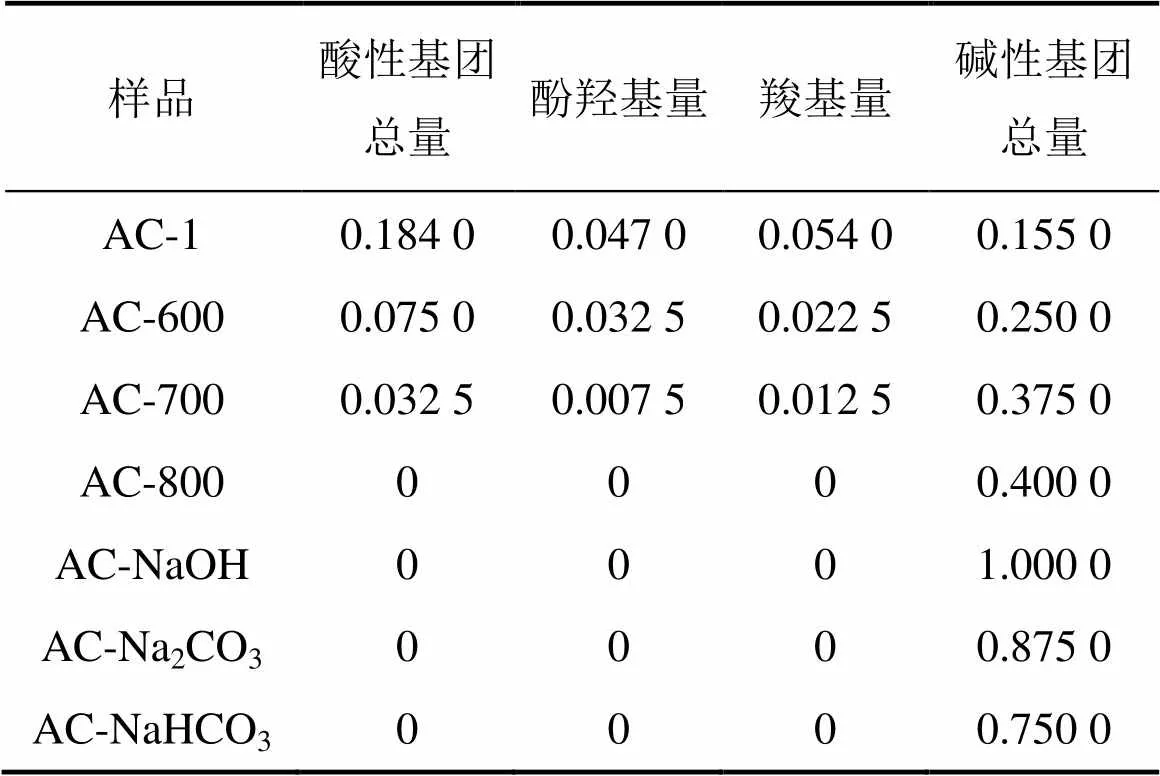
表4 活性炭的Boehm滴定结果
2.3.2 FTIR
图3所示为傅里叶转换红外光谱(FTIR)的测试结果。由图3可知:在某些相同波数范围内,改性活性炭和原始活性炭均出现明显的吸收峰,同时,改性活性炭在不同波数处出现新的吸收峰。这表明改性后既保留了原有的某些基团,又产生了新的基团。由图3(a)可见:在2 845~2 975 cm−1处存在吸收峰,表明存在—C—H键的伸缩振动,包括甲基、亚甲基、次甲基的对称与非对称伸缩振动;AC-1,AC-600和AC-700在1 620~1 670 cm−1处均存在吸收峰,表明存在—C=C—的伸缩振动,碳碳双键由1个σ键和1个π键组成,π键比σ键活泼,容易在高温下被破坏,AC-800无此峰,这说明800 ℃碳碳双键已经被破坏;AC-1,AC-600和AC-700在3 200~3 670 cm−1处存在宽而尖锐的吸收峰,表明存在—O—H的伸缩振动,而AC-800在此波数段表现为双峰,说明—O—H在800 ℃已完全分解;在3 200 cm−1和3 350 cm−1处的双峰显示伯酰胺氢键的缔合,由—N—H的伸缩振动引起,双峰的峰比单峰的峰弱,这是因为羟基形成的氢键比氨基形成的氢键强。随着温度升高,1 680~ 1 750 cm−1波数段的峰强明显减小,表明活性炭表面羰基—C=O、羧基—COOH、酯键—COO的数量逐渐减小。1 030~1 230 cm−1波数段的吸收峰表明存在脂肪胺C-N的伸缩振动。由图3(b)可见:存在1 060~1 150 cm−1处的吸收峰,表明存在—C—O—C—的不对称伸缩振动;存在2 845~2 975 cm-1处的吸收峰,表明存在—C—H键的伸缩振动;AC-1,AC-NaOH和AC-NaHCO3在3 200~3 670 cm−1处存在宽而尖锐的吸收峰,表明存在—O—H的伸缩振动,而AC-Na2CO3在3 200~3 550 cm−1波数段则出现羟基缔合现象。
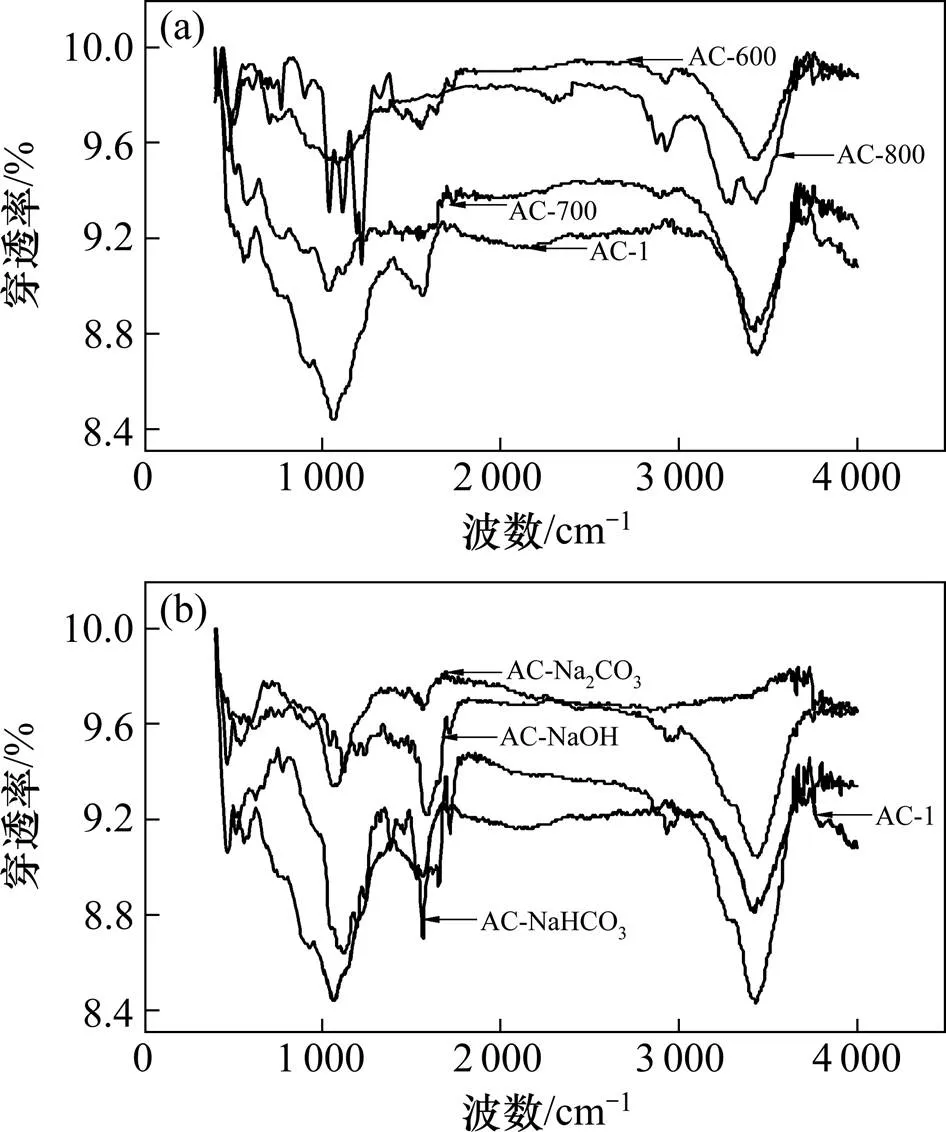
样品:(a) AC-1, AC-600, AC-700, AC-800;(b) AC-1, AC-NaOH, AC-Na2CO3, AC-NaHCO3
2.4 吸附性能
2.4.1 孔参数对吸附性能的影响
图4所示为丙酮饱和吸附量与活性炭样孔结构参数的关系。测定饱和吸附量时,AC-1及微波辐照改性活性炭AC-600,AC-700和AC-800的进气质量浓度为107.22 g/m3,碱性溶液改性活性炭AC-NaOH,AC-NaHCO3和AC-Na2CO3的进气质量浓度为190.11 g/m3。由图4(b)和4(d)可知:丙酮饱和吸附量与活性炭总孔容、微孔比表面积的线性相关系数较低,线性相关性不明显,但总体趋势是随着总孔容和微孔比表面积的增大吸附量增大,这与Gao等[15]的研究结果一致。由图4(a)和4(c)可知:吸附量与BET比表面积、微孔孔容则具有良好的线性关系,线性相关系数2接近0.800,因此,增大活性炭的BET比表面积和微孔孔容是提高吸附量的一个有效方法。
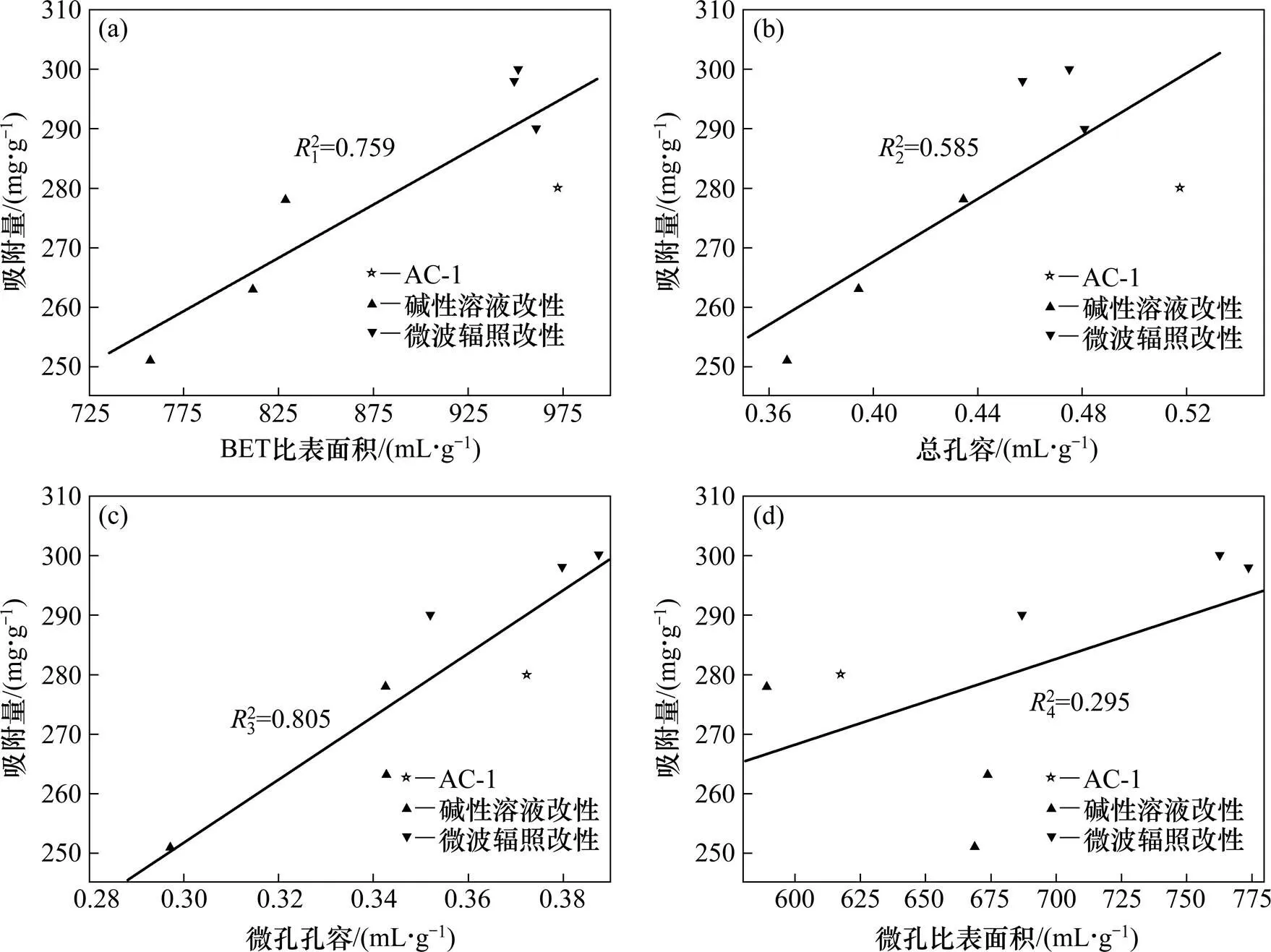
(a) BET比表面积;(b) 总孔容;(c) 微孔孔容;(d) 微孔比表面积
2.4.2 表面官能团对吸附性能的影响
图5所示为丙酮饱和吸附量与活性炭表面碱性官能团总量之间的关系。从图5可见:随着碱性官能团总量增加,吸附量呈递减的趋势。这是因为活性炭经过碱性溶液改性后,表面酸性官能团减少,碱性官能团增多,使得活性炭表面极性降低,非极性增强,这有利于提高对非极性或弱极性物质的吸附容量,降低对极性物质的吸附容量。丙酮为极性分子,故活性炭对丙酮的吸附量减小,这表明用碱性溶液改性活性炭去吸附非极性类的VOCs分子,可能会取得很好的效果。然而,微波改性后,碱性基团稍有增加,但吸附量增大,可能主要是因为微波改性后微孔孔容增加促进了吸附量增加,物理吸附起着主要作用。
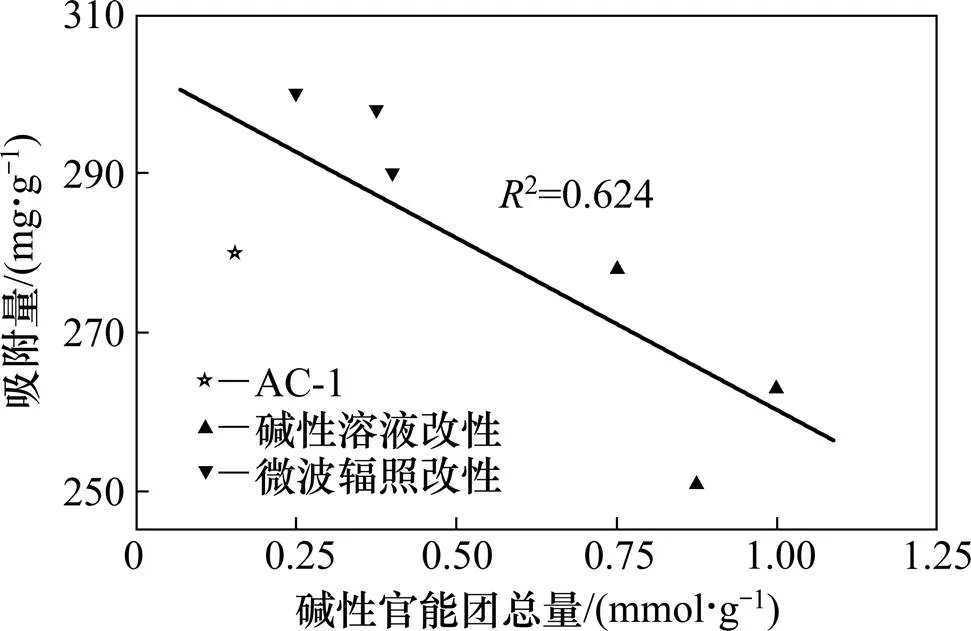
图5 饱和吸附量和碱性官能团总量的关系
2.4.3 等温吸附线
图6所示为7种活性炭吸附丙酮的吸附等温线,根据国际纯粹与应用化学联合会 (IUPAC)分类法,其均属于Ⅰ型吸附等温线。微波改性后,吸附量随着温度升高而降低,吸附量由大到小的活性炭为AC-600,AC-700,AC-800和AC-1;碱性溶液改性后,吸附量均略有降低,吸附量由大至小的活性炭为AC-1,AC-NaHCO3,AC-NaOH和AC-Na2CO3。
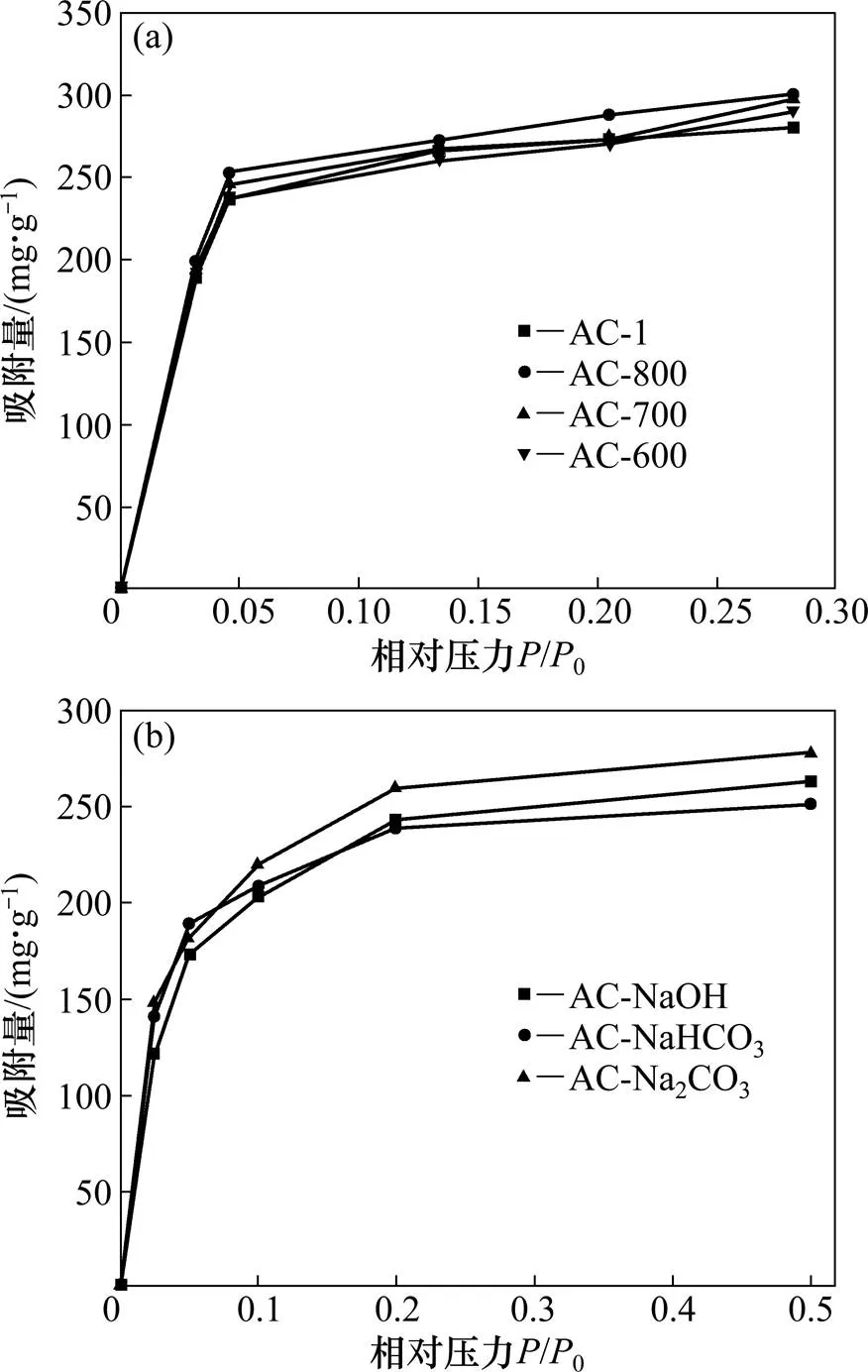
样品:(a) AC-1, AC-600, AC-700, AC-800;(b) AC-NaOH, AC-Na2CO3, AC-NaHCO3
Langmuir模型可以很好地描述吸附等温线在低压区的特点,不适合高压区。因为在较高分压下,吸附不能被认为是单分子层吸附,且同时要考虑毛细凝聚现象。Langmuir方程的线性形式可表示为
其中:e为平衡吸附量,mg/g;max为单分子层饱和吸附量,mg/g;e为被吸附气体的平衡质量浓度,g/m3;L为Langmuir常数,m3/g,与吸附能有关。由e/e对e作直线,可以通过计算直线的斜率和截距计算出max和L。
Freundlich方程的线性形式可表示为
其中:e为平衡吸附量,mg/g;ρ为被吸附气体的平衡质量浓度,g/m3;f为Freundlich常数,它被认为是相对吸附容量,当e等于1时,f与e相等。f为表征吸附剂吸附强度的常数。由lne对lne作直线,可以通过计算直线的斜率和截距计算f和f。Langmuir方程和Freundlich方程对等温吸附实验数据的拟合参数见表5。
由表5可知:Langmuir方程拟合的相关系数2均大于0.996,表明丙酮在活性炭上的吸附等温线能较好地用Langmuir模型来预测;Freundlich方程拟合的相关系数2均比Langmuir方程小,这说明吸附并不是发生在非均匀固体表面[16]。据文献[17],一般认为当0.1<f<1.0时,有利于吸附,位于0.1~0.5这个区间时容易吸附,且f越小,吸附越容易进行;而当f>1.0时,吸附作用力变弱,不利于吸附,此时f都位于0.1~0.3,并且微波改性炭样的f均比碱性溶液改性炭样的小,这说明丙酮更容易在微波改性炭样上形成吸附,从而导致吸附量增加。Freundlich常数f还是吸附线性偏差的1个度量,用来验证吸附的类型,一般认为f等于1时,吸附是线性的,若f小于1,则说明吸附是一个物理吸附过程,若f大于1,则说明吸附是一个化学吸附过程。这里最大的f为 0.252 1,表明丙酮在这7种活性炭上均以物理吸附为主,吸附时起主要作用的是范德华力而不是化学键 力[18]。Langmuir方程和Freundlich方程均能较好的描述丙酮在活性炭上的吸附,Langmuir方程更加适合。
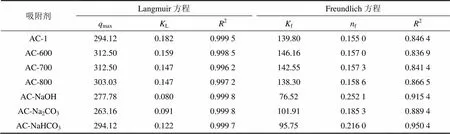
表5 丙酮的Langmuir方程和Freundlich方程的拟合参数
2.5 吸附能
D-R方程的数学表达形式为[19]
=0exp[−(/(0))2]=0exp[−(/)2] (3)
式(3)可简化变形为
ln=ln0−2.303(/)2ln2(0/) (4)
式中:为相对压力/0下吸附质的平衡吸附容量,mL/g;0为微孔极限吸附容量,mL/g;为吸附势=ln(0/),kJ/mol;为与吸附质有关的吸附亲和系数;0和分别为标准吸附质苯和所用吸附质的特征吸附能,kJ/mol;0和分别为饱和蒸汽压和平衡压力,Pa;为通用气体常数,J·mol−1·K−1;为热力学温度,K。丙酮在活性炭上的吸附能见表6。

表6 丙酮在活性炭上的吸附能
利用活性炭样的氮吸附等温线数据,通过D-R方程,ln对ln2(0/)的线性拟合图如图7所示。由式(4)可知,直线的斜率为−2.303(/(0))2。据文献[20],N2的亲和系数为0.33,由此可求得AC-1,AC-600,AC-700,AC-800,AC-NaOH,AC-Na2CO3和AC-NaHCO3的特征吸附能0分别为14.65,18.18,17.01,18.75,26.34,23.23和28.11 kJ/mol。同理,丙酮的亲和系数为0.85[20],根据=0可计算出活性炭对丙酮的吸附能,见表6。表6中2为线性回归相关系数,其值为0.985~0.998,表明回归效果较好。吸附能位于12.82~17.64 kJ/mol之间,相对较小,可以推断丙酮在活性炭上的吸附过程以物理吸附为主。Mangun等[21]认为活性炭表面含氮官能团越多,吸附能越大,活性炭在氮气氛围下进行微波改性后,经图3(a)所示的FTIR验证,AC-600,AC-700和AC-800表面生成含氮官能团,故微波改性活性炭的吸附能大于未改性活性炭的吸附能,经过碱性溶液改性后,吸附能也有一定提高,其原因有待进一步研究。

样品:(a) AC-1, AC-600, AC-700, AC-800;(b) AC-NaOH, AC-Na2CO3, AC-NaHCO3
3 结论
1) 微波辐照加热改性后,活性炭的总比表面积和孔容较小幅度减小,但微孔比表面积显著增大,形成许多新的微孔。随着温度升高,酸性基团大量分解,碱性基团逐渐形成。
2) 碱性溶液浸渍改性后,比表面积和孔容均减小。酸性基团被完全去除,溶液碱性越强,产生的碱性基团总量越大。
3) 丙酮吸附量与活性炭微孔孔容具有良好的线性相关性,吸附量随着微孔孔容的增大而增大。随着活性表面碱性基团的增加,丙酮吸附量呈现递减趋势。
4) 对丙酮的吸附量由大至小的活性炭顺序为AC-600,AC-700,AC-800,AC-1,AC-NaHCO3,AC-NaOH和AC-Na2CO3,说明微波改性是一种提高吸附量的方法。
5) Langmuir方程和Freundlich方程均能较好地描述丙酮在活性炭上的吸附,Langmuir方程更加适合。
6) 活性炭对丙酮的吸附能均较小,活性炭表面含氮官能团越多,吸附能越大。
[1] Cazetta A L, Vargas A M M, Nogami E M, et al. NaOH-activated carbon of high surface area produced from coconut shell: Kinetics and equilibrium studies from the methylene blue adsorption[J]. Chemical Engineering Journal, 2011, 174(1): 117−125.
[2] LIU Wenxia, GUAN Baohong, YU Jie. Adsorption characteristics of carbon tetrachloride from aqueous solution onto polyacrylonitrile-based activated carbon fiber[J].Journal of Central South University of Technology, 2010, 17(5): 972−978.
[3] Figueiredo J L, Pereira M F R, Freitas M M A, et al. Modification of the surface chemistry of activated carbons[J]. Carbon, 1999, 37(90): 1379−1389.
[4] LIU Qingsong, ZHENG Tong, LI Nan, et al. Modification of bamboo-based activated carbon using microwave radiation and its effects on the adsorption of methylene blue[J]. Applied Surface Science, 2010, 256(10): 3309−3315.
[5] Foo K Y, Hameed B H. Textural porosity, surface chemistry and adsorptive properties of durian shell derived activated carbon prepared by microwave assisted NaOH activation[J]. Chemical Engineering Journal, 2012, 187(1): 53−62.
[6] HUANG Lihui, SUN Yuanyuan, WANG Weiliang, et al. Comparative study on characterization of activated carbons prepared by microwave and conventional heating methods and application in removal of oxytetracycline (OTC)[J]. Chemical Engineering Journal, 2011, 171(3): 1446−1453.
[7] LI Lin, LIU Suqin, LIU Junxin. Surface modification of coconut shell based activated carbon for the improvement of hydrophobic VOC removal[J]. Journal of Hazardous Materials, 2011, 192(2): 683−690.
[8] 李立清, 梁鑫, 石瑞, 等. 酸改性活性炭对甲苯、甲醇的吸附性能[J]. 化工学报, 2013, 64(3): 970−979.
LI Liqing, LIANG Xin, SHI Rui, et al. Adsorption of toluene and methanol onto activated carbons with acid modification[J]. CIESC Journal, 2013, 64(3): 970−979.
[9] 张丽丹, 赵晓鹏, 马群, 等. 改性活性炭对苯废气吸附性能的研究[J]. 新型炭材料, 2002, 17(2): 41−44.
ZHANG Lidan, ZHAO Xiaopeng, MA Qun, et al. Study of the adsorption of benzene-containing off-gases on a modified active carbon[J]. New Carbon Materials, 2002, 17(2): 41−44.
[10] Chingombe P, Saha B, Wakeman R J. Surface modification and characterisation of a coal-based activated carbon[J]. Carbon, 2005, 43(15): 3132−3143.
[11] 刘伟, 李立清, 姚小龙, 等. 活性炭孔隙结构在其丙酮吸附中的作用[J]. 中南大学学报(自然科学版), 2012, 43(4): 1574−1583.
LIU Wei, LI Liqing, YAO Xiaolong, et al. Role of pore structure of activated carbon in adsorption for acetone[J]. Journal of Central South University (Science and Technology), 2012, 43(4): 1574−1583.
[12] Carrott P J M, Nabais J M V, Carrott M M L R, et al. Thermal treatments of activated carbon fibres using a microwave furnace[J]. Microporous and Mesoporous Materials, 2001, 47(2/3): 243−252.
[13] Leonyleon C A, Solar J M, Calemma V, et al. Evidence for the protonation of basal plane sites on carbon[J]. Carbon, 1992, 30(5): 797−811.
[14] Wibowo N, Setyadhi L, Wibowo D, et al. Adsorption of benzene and toluene from aqueous solutions onto activated carbon and its acid and heat treated forms: Influence of surface chemistry on adsorption[J]. Journal of Hazardous Materials, 2007, 146(1/2): 237−242.
[15] GAO Fen, ZHAO Donglin, LI Yan, et al. Preparation and hydrogen storage of activated rayon-based carbon fibers with high specific surface area[J]. Journal of Physics and Chemistry of Solids, 2010, 71(4): 444−447.
[16] Yurdakoc M, Seki Y, Karahan S, et al. Kinetic and thermodynamic studies of boron removal by Siral 5, Siral 40, and Siral 80[J]. Journal of Colloid and Interface Science, 2005, 286(2): 440−446.
[17] Sarkar M, Majumdar P. Application of response surface methodology for optimization of heavy metal biosorption using surfactant modified chitosan bead[J]. Chemical Engineering Journal, 2011, 175: 376−387.
[18] Vimonses V, LEI Shaomin, Jin B, et al. Kinetic study and equilibrium isotherm analysis of Congo Red adsorption by clay materials[J]. Chemical Engineering Journal, 2009, 148(2/3): 354−364
[19] Chen S G, Yang R T. Theoretical basis for the potential theory adsorption isotherms. The Dubinin-Radushkevich and Dubinin-Astakhov equations[J]. Langmuir, 1994, 10(11): 4244−4249.
[20] Wood G O. Affinity coefficients of the Polanyi/Dubinin adsorption isotherm equations: A review with compilations and correlations[J]. Carbon, 2001, 39(3): 343−356.
[21] Mangun C L, Debarr J A, Economy J. Adsorption of sulfur dioxide on ammonia-treated activated carbon fibers[J]. Carbon, 2001, 39(11): 1689−1696.
Effect of microwave and alkaline solution modification activated carbons on adsorption properties of actone acetone
LIANG Xin, LI Liqing, LIU Zheng, LI Hailong, MA Weiwu, YAO Xiaolong
(School of Energy Science and Engineering, Central South University, Changsha 410083, China)
The commercial activated carbons were irradiated with microwave at 600, 700 and 800 ℃ and impregnated with sodium hydroxide, sodium carbonate and sodium bicarbonate respectively. Specific surface area and pore size analyzer, Boehm titration and Fourier transformed infrared spectroscopy (FTIR) were used to study the physicochemical properties of the activated carbons. The fixed-bed adsorption experiments were conducted at 10 ℃ using acetone as adsorbate. The results show that after microwave modification, the specific surface area and total pore volume of activated carbons decrease slightly, but the micropore specific surface area increases remarkably. With the increase of temperature, large number of surface acidic functional groups resolve and surface basic functional groups are formed gradually. Both the specific surface area and pore volume decrease when the alkaline solutions are modificated. With the increase of alkaline of solutions, surface basic functional groups increase remarkably and surface acidic functional groups are removed completely. The relationship between the adsorption capacity of acetone and the micropore volume of activated carbons is linear, the adsorption capacity is inversely proportional to the contents of surface basic functional groups of activated carbon. Both the Langmuir equation and Freundlich equation can describe the adsorption of acetone onto activated carbons, and the Langmuir equation is more suitable. The adsorption energy is proportional to the contents of surface nitrogen groups of activated carbon.
modified activated carbon; adsorption; acetone; microwave; alkaline solution
O613.71
A
1672−7207(2015)02−0742−09
2014−02−20;
2014−04−22
国家自然科学基金资助项目(20976200,51206192);国家科技支撑项目(2015BAL04B02);APEC科技产业合作基金项目(313001022)(Projects (20976200, 51206192) supported by the National Natural Science Foundation of China; Project (2015BAL04B02) supported by the National Science and Technology Support Program; Project (313001022) supported by the APEC Scientific and Technological Cooperation Projects Fund)
李立清,博士,教授,从事空气污染控制研究;E-mail:liqingli@hotmail.comge
10.11817/j.issn.1672-7207.2015.02.050
(编辑 陈灿华)
