牛磺酸对顺铂所致H22荷瘤小鼠免疫器官及淋巴细胞损伤的保护作用
2015-09-22郭杰王蓓戎瑞雪曹志然
郭杰,王蓓*,戎瑞雪,曹志然*
(河北大学基础医学院,河北保定071000)
牛磺酸对顺铂所致H22荷瘤小鼠免疫器官及淋巴细胞损伤的保护作用
郭杰,王蓓*,戎瑞雪,曹志然*
(河北大学基础医学院,河北保定071000)
目的:研究牛磺酸对顺铂化疗荷瘤小鼠免疫器官和淋巴细胞损伤的保护作用。方法:H22荷瘤小鼠随机分为5组:模型对照组、顺铂(1.5mg/(kg·d))化疗组、顺铂+高剂量(640mg/(kg·d))牛磺酸组、顺铂+中剂量(320mg/(kg·d))牛磺酸组和顺铂+低剂量(160mg/(kg·d))牛磺酸组,末次用药24h后眼球放血处死小鼠,测定小鼠体质量、瘤质量、脾脏指数、胸腺指数以及血清白细胞介素-2(interleukin-2,IL-2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-γ(interferon-γ,IFN-γ)水平,胸腺依赖性淋巴细胞(thymus dependent lymphocyte,T细胞)、骨髓依赖性淋巴细胞(bone marrow dependent lymphocyte,B细胞)增殖能力的变化情况。结果:顺铂化疗组小鼠体质量和瘤质量均明显低于模型对照组,抑瘤率为36%,顺铂+中、高剂量牛磺酸组小鼠的体质量显著高于顺铂化疗组,抑瘤率分别达到51%和68%;顺铂化疗组小鼠的脾脏质量和脾脏指数明显低于模型对照组,而顺铂+各剂量牛磺酸组小鼠的脾脏质量和脾脏指数均高于顺铂化疗组;顺铂化疗组小鼠的胸腺质量和胸腺指数明显低于模型对照组,顺铂+高剂量牛磺酸组小鼠的胸腺质量和胸腺指数明显高于顺铂化疗组;顺铂化疗组小鼠血清IL-2、IFN-γ和TNF-α的分泌水平明显低于模型对照组(P<0.01);而顺铂+各剂量牛磺酸组血清IL-2、IFN-γ和TNF-α的水平均高于顺铂化疗组;顺铂可明显抑制荷瘤小鼠对丝裂原刺激的T细胞和B细胞的增殖,顺铂+高剂量牛磺酸组小鼠的T细胞刺激指数明显高于顺铂化疗组(P<0.05);而顺铂+低、中剂量牛磺酸组小鼠的B细胞刺激指数则高于顺铂化疗组。结论:牛磺酸可协同顺铂发挥抑制肿瘤的作用,其机制与保护顺铂导致的动物免疫器官和淋巴细胞功能损伤有关。
牛磺酸;肿瘤;化疗;免疫功能
牛磺酸又名牛胆酸、胆素、牛胆碱,化学名为2-氨基乙磺酸,是体内含量最丰富的含磺酸基β-氨基酸,以游离形式存在于人体各组织中,但不参与蛋白质的合成[1]。牛磺酸参与机体的多种生物学功能,具有抗炎、抗氧化、抗肿瘤、免疫调节等作用[2-4]。有大量研究表明牛磺酸可通过促进胎儿的发育,促进人脑细胞的生长发育、增殖分化及延缓衰老,促进超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧物酶(glutathione peroxidase,GSH-Px)的活性、增强清除自由基的功能,稳定细胞膜等多种机制发挥对细胞的保护作用[5-9]。顺铂(cisplatin)是目前临床运用广泛、疗效可靠的抗肿瘤药物之一,但是其在抗肿瘤的同时会造成机体免疫功能的损伤,从而影响肿瘤的治疗效果[10]。鉴于牛磺酸对细胞具有保护功能,因此本实验采用H22荷瘤小鼠模型,应用牛磺酸联合顺铂,观察牛磺酸对顺铂化疗小鼠的肿瘤抑制及免疫功能的影响,为牛磺酸在肿瘤辅助治疗方面的应用提供实验依据。
1 材料与方法
1.1动物与瘤株
昆明种小鼠40只,5周龄,体质量(22±2)g,雌雄兼用,购自河北医科大学实验动物中心,实验动物合格证号:901027,使用许可证号:SCXK(G2008-1-003);H22小鼠肝癌肿瘤细胞株由河北医科大学基础医学院免疫教研室惠赠,本实验室传代保存。
1.2试剂与仪器
牛磺酸、二甲基亚砜(dimethyl sulfoxide,DMSO)北京Solarbio公司;RPMI1640培养基美国Gibco公司;胎牛血清杭州四季青生物工程材料有限公司;四甲基偶氮唑盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)美国Amresco公司;伴刀豆凝集素A(concanavalin A,Con A)、细菌脂多糖(lipopolysaccharides,LPS)美国Sigma公司;青霉素钠华北药业股份有限公司;硫酸链霉素深圳华药南方制药有限公司;顺铂南京制药厂有限公司;小鼠白细胞介素-2(interleukin-2,IL-2)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)检测试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA检测试剂盒、干扰素-γ(interferon-γ,IFN-γ)ELISA检测试剂盒深圳达科为生物技术公司。
CKX41SF倒置显微镜日本Olympus公司;HF90二氧化碳培养箱上海力申科学仪器有限公司。
1.3方法
1.3.1荷瘤小鼠模型的制备
常规复苏冻存的H22细胞,调整细胞浓度为2×106个/mL,取1mL接种在小鼠腹腔内,10d后无菌操作取小鼠腹水,台盼蓝染色,光学显微镜下记数,活细胞比例为93%,调整细胞浓度为1×107个/mL,取0.2mL接种于小鼠右前肢外侧皮下,建立实体型荷瘤鼠模型。
1.3.2实验动物分组和处理
小鼠接种肿瘤细胞后24h随机分为5组,每组8只:模型对照组、顺铂化疗组、顺铂+低剂量牛磺酸组、顺铂+中剂量牛磺酸组、顺铂+高剂量牛磺酸组。除模型对照组外,其余4组给予顺铂1.5mg/kg(以体质量计,下同)腹腔注射,1次/d,共7d;顺铂+牛磺酸低、中、高剂量组组同时分别给予160、320、640mg/kg牛磺酸温水溶液灌胃,1次/d,共10d。模型对照组小鼠给予相同体积的生理盐水腹腔注射和温蒸馏水灌胃。在末次给药24h后,称量小鼠体质量后眼球放血处死小鼠,进行指标检测。
1.3.3小鼠血清细胞因子分泌水平的测定
分离小鼠血清,采用ELISA法测定小鼠血清中IL-2、TNF-α、IFN-γ水平,按试剂盒说明书进行操作。
1.3.4抑瘤率测定
剥离荷瘤小鼠的肿瘤组织,拭去表面血迹和组织液,电子天平称质量,按照公式(1)计算抑瘤率。

1.3.5脾脏指数和胸腺指数测定
无菌操作剥离小鼠脾脏和胸腺,电子天平称质量后,按照公式(2)、(3)计算脾脏指数和胸腺指数。

1.3.6荷瘤小鼠脾脏T细胞、B细胞增殖能力测定
无菌操作制备脾脏细胞悬液,用RPMI1640完全培养液调整细胞浓度为5×106个/mL,以90μL/孔加入96孔培养板中,每组均设Con A组(T细胞增殖实验,终质量浓度为5μg/mL)、LPS组(B细胞增殖实验,终质量浓度为10μg/mL)和无血清培养液对照组,每组3个复孔。将96孔板置于培养箱中培养68h后,换为无血清培养液,加入5mg/mL的MTT15μL,继续培养4h,培养结束后弃去上清液,每孔加DMSO150μL,振荡5min,酶标仪490nm波长处读取光密度(OD490nm)值,按照公式(4)、(5)计算T细胞和B细胞的刺激指数(stimulation index,SI)。

1.4数据统计学分析
所有数据统计均使用SPSS16.0软件包进行。采用单因素方差分析和t检验,检验水平α=0.05,P<0.05表示有显著性差异;检验水平α=0.01,P<0.01表示有极显著性差异。
2 结果与分析
2.1牛磺酸对顺铂化疗荷瘤小鼠体质量和抑瘤率的影响
实验动物模型建立后,荷瘤率为100%。由表1可知,顺铂化疗组小鼠体质量和瘤质量均极显著低于模型对照组(P<0.01),抑瘤率为36%,提示顺铂在抑制肿瘤生长的同时可降低小鼠的体质量。顺铂+中、高剂量牛磺酸组小鼠的体质量明显高于顺铂化疗组,且瘤质量显著低于顺铂化疗组(P<0.05),抑瘤率分别达到51%和68%,表明牛磺酸可改善顺铂化疗荷瘤动物的一般状况,并可协同顺铂抑制肿瘤细胞的生长。
表1 牛磺酸联合顺铂对荷瘤小鼠体质量和抑制肿瘤作用的影响Table1Effect of taurine combined with cisplatin on body mass and tumor growth inhibition in tumor-bearing miiccee
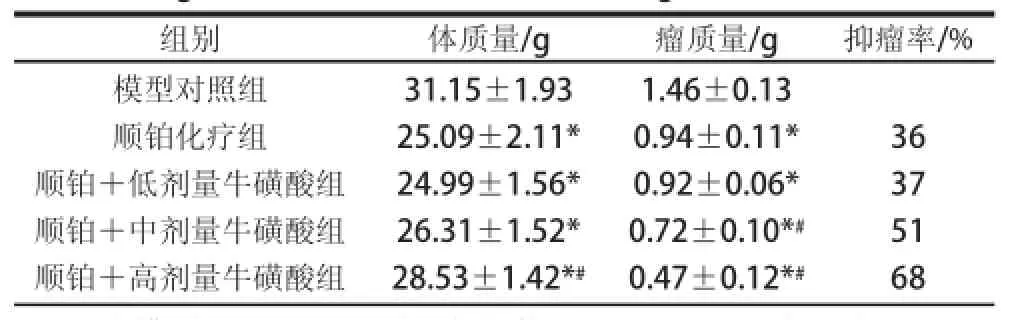
表1 牛磺酸联合顺铂对荷瘤小鼠体质量和抑制肿瘤作用的影响Table1Effect of taurine combined with cisplatin on body mass and tumor growth inhibition in tumor-bearing miiccee
注:*.与模型对照组相比,差异极显著(P<0.01);#.与顺铂化疗组相比,差异显著(P<0.05)。下同。
组别体质量/g瘤质量/g抑瘤率/%模型对照组顺铂化疗组顺铂+低剂量牛磺酸组顺铂+中剂量牛磺酸组顺铂+高剂量牛磺酸组31.15±1.93 25.09±2.11* 24.99±1.56* 26.31±1.52* 28.53±1.42*#1.46±0.13 0.94±0.11* 0.92±0.06* 0.72±0.10*#0.47±0.12*#36 37 51 68
2.2牛磺酸对顺铂化疗荷瘤小鼠脾脏质量和脾脏指数的影响
表2牛磺酸联合顺铂对荷瘤小鼠脾脏质量和脾脏指数的影响Table2Effect of taurine combined with cisplatin on spleen mass and spleen index of tumor-bear

表2牛磺酸联合顺铂对荷瘤小鼠脾脏质量和脾脏指数的影响Table2Effect of taurine combined with cisplatin on spleen mass and spleen index of tumor-bear
组别脾脏质量/mg脾脏指数/(mg/g)模型对照组顺铂化疗组顺铂+低剂量牛磺酸组顺铂+中剂量牛磺酸组顺铂+高剂量牛磺酸组153.52±20.17 79.68±15.13* 93.44±8.14*#97.38±15.21*#109.02±11.34*#4.93±0.89 3.18±0.76* 3.74±0.59*#3.70±0.87*#3.82±0.81*#
由表2可知,顺铂化疗组小鼠的脾脏质量和脾脏指数极显著低于模型对照组(P<0.01),而顺铂+各剂量牛磺酸组小鼠的脾脏质量和脾脏指数均高于顺铂化疗组(P<0.05),但仍低于模型对照组(P<0.01),表明顺铂可损伤小鼠的脾脏,而牛磺酸对顺铂导致的小鼠脾脏损伤有一定保护作用。
2.3牛磺酸对顺铂化疗荷瘤小鼠胸腺质量和胸腺指数的影响
表3牛磺酸联合顺铂对荷瘤小鼠胸腺质量和胸腺指数的影响Table3Effect of taurine combined with cisplatin on thymus mass and thymus index of tumor-bear
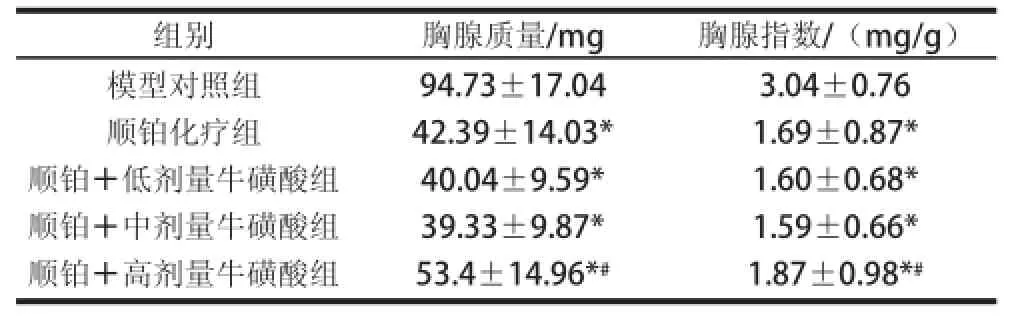
表3牛磺酸联合顺铂对荷瘤小鼠胸腺质量和胸腺指数的影响Table3Effect of taurine combined with cisplatin on thymus mass and thymus index of tumor-bear
组别胸腺质量/mg胸腺指数/(mg/g)模型对照组顺铂化疗组顺铂+低剂量牛磺酸组顺铂+中剂量牛磺酸组顺铂+高剂量牛磺酸组94.73±17.04 42.39±14.03* 40.04±9.59* 39.33±9.87* 53.4±14.96*#3.04±0.76 1.69±0.87* 1.60±0.68* 1.59±0.66* 1.87±0.98*#
由表3可知,顺铂化疗组小鼠的胸腺质量和胸腺指数极显著低于模型对照组(P<0.01),顺铂+高剂量牛磺酸组小鼠的胸腺质量和胸腺指数明显高于顺铂化疗组(P<0.05),表明高剂量牛磺酸可拮抗顺铂对小鼠胸腺的损伤作用。
2.4牛磺酸对顺铂化疗荷瘤小鼠血清细胞因子分泌水平的影响
表 4 牛磺酸联合顺铂对荷瘤小鼠血清中IL-2、IFN- 、TNF- 分泌水平的影响Table 4 Effect of taurine combined with cisplatin on the secretio n of IL-2, IFN- and TNF- in serum of tumor-bear
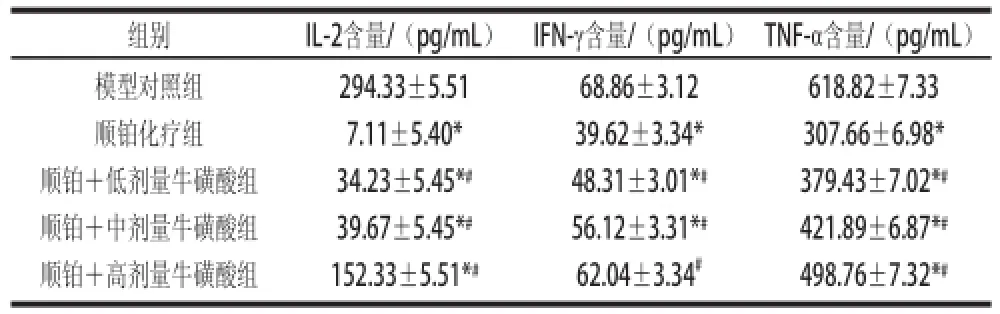
表 4 牛磺酸联合顺铂对荷瘤小鼠血清中IL-2、IFN- 、TNF- 分泌水平的影响Table 4 Effect of taurine combined with cisplatin on the secretio n of IL-2, IFN- and TNF- in serum of tumor-bear
组别IL-2含量/(pg/mL)IFN-γ含量/(pg/mL)TNF-α含量/(pg/mL)模型对照组顺铂化疗组顺铂+低剂量牛磺酸组顺铂+中剂量牛磺酸组顺铂+高剂量牛磺酸组294.33±5.51 7.11±5.40* 34.23±5.45*#39.67±5.45*#152.33±5.51*#68.86±3.12 39.62±3.34* 48.31±3.01*#56.12±3.31*#62.04±3.34#618.82±7.33 307.66±6.98* 379.43±7.02*#421.89±6.87*#498.76±7.32*#
由表4可知,顺铂化疗组小鼠血清IL-2、IFN-γ和
TNF-α的分泌水平极显著低于模型对照组(P<0.01);而顺铂+各剂量牛磺酸组小鼠血清IL-2、IFN-γ和TNF-α
的水平均高于顺铂化疗组(P<0.05),其中以顺铂+高剂量牛磺酸组作用最明显,但顺铂+各剂量牛磺酸组的这几种细胞因子水平仍低于模型对照组,提示牛磺酸可部分拮抗顺铂导致的细胞因子分泌水平下降。
2.5牛磺酸对顺铂化疗荷瘤小鼠脾脏T细胞和B细胞增殖能力的影响
表5牛磺酸联合顺铂对荷瘤小鼠T细胞、B细胞增殖能力的影响(Table 5 Effect of taurine combined with cisplatin on the proliferation of cells and B cells in tumor-be

表5牛磺酸联合顺铂对荷瘤小鼠T细胞、B细胞增殖能力的影响(Table 5 Effect of taurine combined with cisplatin on the proliferation of cells and B cells in tumor-be
组别T细胞刺激指数B细胞刺激指数模型对照组顺铂化疗组顺铂+低剂量牛磺酸组顺铂+中剂量牛磺酸组顺铂+高剂量牛磺酸组1.76±0.17 1.02±0.06* 1.08±0.06* 1.07±0.08* 1.19±0.27*#1.20±0.09 0.66±0.06* 0.86±0.08*#0.82±0.07*#0.71±0.09*
由表5可知,顺铂可明显抑制荷瘤小鼠对丝裂原刺激的T细胞和B细胞的增殖,顺铂化疗组小鼠的T细胞、B细胞刺激指数极显著低于模型对照组(P<0.01),顺铂+高剂量牛磺酸组小鼠T细胞刺激指数明显高于顺铂化疗组(P<0.05);而顺铂+低、中剂量牛磺酸组小鼠的B细胞刺激指数则高于顺铂化疗组(P<0.05),而顺铂+高剂量牛磺酸组B细胞刺激指数又有所下降,表明牛磺酸可拮抗顺铂对T细胞和B细胞功能的损伤作用,但T细胞和B细胞所需的有效剂量不同。
3讨论
牛磺酸广泛存在于机体的多种组织和细胞中,其中以眼睛、心肌、中枢神经系统及免疫系统中含量丰富。研究表明牛磺酸对机体的多种生理功能均具有重要的调节作用。近年来其在肿瘤辅助治疗方面的应用引起研究者的广泛关注[11-13]。
恶性肿瘤是目前危害人类健康的重大疾病,化疗是目前常用的治疗手段之一。顺铂是临床运用广泛、疗效可靠的治疗实体瘤的抗肿瘤药物之一。有研究表明,顺铂有免疫抑制效应,可导致小鼠淋巴器官萎缩,NK细胞活性明显下降,T淋巴细胞和B淋巴细胞减少,损伤机体的免疫功能,从而影响到肿瘤的治疗效果[14]。顺铂的毒副作用主要与其在细胞内产生大量的反应性氧中间产物(超氧阴离子自由基、羟自由基等)消耗氧化型谷胱甘肽和影响抗氧化酶活性等有关,使细胞内的氧化功能失衡,导致细胞内过氧化脂质堆积、线粒体功能障碍和脱氧核糖核酸(deoxyribonucleic acid,DNA)损伤[15-16],具有广泛的细胞毒性,故在杀死肿瘤细胞的同时往往造成肾脏、骨骼肌、免疫器官及免疫细胞的损伤,从而降低对肿瘤的治疗效果。
机体免疫系统的监视功能在肿瘤发生、发展中发挥重要作用。在抗肿瘤免疫中以T细胞介导的细胞免疫为主,T细胞活化后大量增殖并分化为效应性T细胞,CD4+T细胞分化为Th1辅助细胞(T helper type1cell),通过分泌IL-2、TNF-α、IFN-γ等细胞因子作用于其他免疫细胞发挥抗肿瘤作用;CD8+T细胞分化为细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)来特异性杀伤肿瘤细胞。而B细胞介导的体液免疫不是抗肿瘤免疫的重要效应因素,相反在某些情况下,肿瘤特异性抗体反而会干扰特异性T细胞对肿瘤细胞的杀伤作用,这种具有促进肿瘤生长的抗体被称为“增强性抗体”,此外,抗体还可使肿瘤的黏附特性改变或丧失,从而促进肿瘤细胞的转移[17-18]。机体的免疫功能和肿瘤的发生发展密切相关,当机体免疫功能低下或缺陷时易患肿瘤,同时肿瘤也会产生很多物质以抑制和削弱机体的抗肿瘤免疫功能,建造适合肿瘤自身发展的微环境,因此免疫功能的强弱与肿瘤的发生发展互为因果,肿瘤患者往往存在免疫功能的异常[19-20]。因此提高肿瘤患者的免疫功能是肿瘤治疗的一个重要方面[21]。牛磺酸是淋巴细胞中含量最高的游离氨基酸,占淋巴细胞中自由氨基酸的50%。但淋巴细胞本身不能合成牛磺酸,主要由细胞外摄入到细胞内,因此细胞外的牛磺酸浓度对于细胞的保护起到重要作用。牛磺酸对细胞的保护作用机制主要是作为过氧化物清除剂,清除细胞内的自由基,从而减轻顺铂等化疗药物对细胞的氧化损伤作用。本研究的结果表明顺铂可明显降低荷瘤小鼠的脾脏指数和胸腺指数、T细胞和B细胞的增殖能力以及IL-2、IFN-γ和TNF-α的分泌水平,而顺铂联合不同剂量的牛磺酸后可明显改善顺铂对荷瘤动物免疫功能的损伤作用。值得注意的是,中、高剂量的牛磺酸对免疫器官指数、T细胞增殖能力以及IL-2、IFN-γ和TNF-α分泌水平的作用最显著,但高剂量的牛磺酸对B细胞增殖能力反而起一定抑制作用,与石友斐等[22]的报道基本一致,至于牛磺酸是否通过抑制“增强性抗体”的产生而发挥抗肿瘤作用还有待进一步研究证实。
此外,有研究表明牛磺酸还可直接抑制肿瘤细胞的增殖。薛美兰等[23]研究表明牛磺酸可抑制二甲基苯蒽诱发的大鼠乳腺癌,其作用机制与增强机体免疫、抗氧化、促进DNA损伤修复和抑制肿瘤细胞增殖等有关。Luckert等[24]研究表明来源于牛磺酸的衍生物——牛磺罗定在体外选择性地抑制人神经母细胞瘤SK-N-BE(2)-M17和SK-N-SH细胞系的增殖,而对正常脐静脉内皮细胞则没有抑制作用。Zhang Xiali等[25]研究表明牛磺酸可诱导人结肠癌细胞系凋亡,其作用机制与调节p53正向凋亡调节因子基因PUMA(p53-upregulated modulator of apoptosis)有关。本研究结果表明,顺铂联合牛磺酸在小鼠体内可明显抑制肿瘤的生长,其机制是否与其直接抑制肿瘤细胞的增殖有关还有待进一步研究。
综上所述,牛磺酸可改善顺铂对机体免疫功能的损伤作用,并具有一定的直接抗肿瘤作用,可以考虑用作肿瘤病人的饮食添加剂,可作为肿瘤辅助治疗的手段。
[1]BOUCKENOOGHE T,REMACLE C,REUSENS B.Is taurine a functional nutrient?[J].Current Opinion in Clinical Nutrition&Metabolic Care,2006,9(6):728-733.
[2]WANG Caiyun,LI Lei,GUAN Hong,et al.Effects of taurocholic acid on immunoregulation in mice[J].International Immunopharmacology,2013,15(2):217-222.
[3]曾得寿,黄冠庆,高振华,等.牛磺酸对动物免疫功能的影响[J].饲料工业,2007,28(5):20-23.
[4]张霞丽,万福生.牛磺酸的抗肿瘤作用[J].肿瘤,2012,32(4):308-310.
[5]YU Jisun,KIM A K.Effect of taurine on antioxidant enzyme system in B16F10melanoma cells.Chapter51[M]//AZUMA J,SCHAFFER W S,ITO T.Taurine7.New York:Springer New York,2009:491-499.
[6]杜引娣,刘培贤.牛磺酸的研究现状与前景[J].临床医药实践杂志,2004,13(1):6-7.
[7]吕秋凤,胡建民,王振勇,等.牛磺酸的研发现状[J].饲料工业,2004,25(12):20-22.
[8]华浩明,伊藤崇志,邱志刚,等.牛磺酸对心血管系统作用及机理的研究进展[J].中国中药杂志,2005,30(9):653-657.
[9]王丽娟,王勇.牛磺酸药理作用的研究进展[J].天津药学,2004,16(5):46-48.
[10]赵树泉,梁富程,王晓谦,等.中西医对抑制顺铂毒副作用的研究进展[J].实用癌症杂志,26(5):546-548.
[11]李金芳,周荫庄,屠淑洁.牛磺酸对细胞的保护功能[J].首都师范大学学报:自然科学版,2006,27(1):63-66.
[12]KIM C,CHA Y N.Taurine chloramine produced from taurine under inflammation provides anti-inflammatory and cytoprotective effects[J].Amino Acids,2014,46(1):89-100.
[13]ZHANG Yiyin,GU Kangsheng.DNA repair capacity in peripheral blood lymphocytes predicts efficacy of platinum-based chemotherapy in patients with gastric cancer[J].Asian Pacific Journal of Cancer Prevention,2013,14(9):5507-5512.
[14]de CARVALHO MARONI L,de OLIVEIRA SILVEIRA A C,LEITE E A,et al.Antitumor effectiveness and toxicity of cisplatin-loaded long-circulating and pH-sensitive liposomes against Ehrlich ascitic tumor[J].Experimental Biology and Medicine,2012,237(8):973-984.[15]KHABOUR O F,ALZOUBI K H,MFADY D S,et al.Tempol protects human lymphocytes from genotoxicity induced by cisplatin[J].International Journal of Clinical and Experimental Medicine,2014,7(4):982-988.
[16]VACCHELLI E,ARANDA F,OBRIST F,et al.Trial watch:immunostimulatory cytokines in cancer therapy[J].Oncoimmunology,2014,3:e29030.doi:10.4161/onci.29030.
[17]孔琦,朱家胜,芮景.Th1/Th2偏移与肿瘤免疫研究进展[J].现代肿瘤医学,2010,18(8):1653-1655.
[18]毛建平,陈立军,临床肿瘤免疫治疗研究进展[J].国际药学研究杂志,2013,40(2):127-135.
[19]FRANSEN M F,OSSENDORP F,ARENS R,et al.Local immunomodulation for cancer therapy:providing treatment where needed[J].Oncoimmunology,2013,2(11):e26493.doi:10.4161/ onci.26493.
[20]NEARY P M,HALLIHAN P,WANG J H,et al.The evolving role of taurolidine in cancer therapy[J].Annals of Surgical Oncology,2010,17(4):1135-1143.
[21]FRY T J,MACKALL C L.T-cell adoptive immunotherapy for acute lymphoblastic leukemia[J].ASH Education Program Book,2013:348-353.doi:10.1182/asheducation-2013.1.348.
[22]石友斐,李培峰,李金莲,等.牛磺酸对有丝分裂原刺激小鼠免疫细胞功能的影响[J].山东农业大学学报:自然科学版,2007,38(3):331-336.
[23]薛美兰,张华荣,姜长青,等.牛磺酸抑制二甲基苯蒽诱发大鼠乳腺癌及其机制研究[J].营养学报,2008,30(1):57-60.
[24]LUCKERT C,ESCHENBURG G,ROTH B,et al.Taurolidine specifically inhibits growth of neuroblastoma cell lines in vitro[J].Journal of Pediatric Hematology/Oncology,2014,36(4):e219-e223.
[25]ZHANG Xiali,TU Shuo,WANG Yibing,et al.Mechanism of taurineinduced apoptosis in human colon cancer cells[J].Acta Biochimica et Biophysica Sinica,2014.doi:10.1093/abbs/gmu004.
Protection of Taurine against Cisplatin-Induced Damage of Immune Organs and Lymphocytes in H22Tumor-Bearing Mice
GUO Jie,WANG Bei*,RONG Ruixue,CAO Zhiran*
(School of Basic Medicine,Hebei University,Baoding071000,China)
Objective:To determine the protective effect of taurine on immune function of tumor-bearing mice subjected to cisplatin chemotherapy.Methods:The H22tumor-bearing mice were randomly divided into five groups:tumor model group,cisplatin chemotherapy group(1.5mg/(kg·d),cisplatin plus high-dose taurine(640mg/(kg·d)group,cisplatin plus middle-dose taurine(320mg/(kg·d)group,and cisplatin plus low-dose taurine(160mg/(kg·d)group.At24hours after the last administration,all the mice were killed by eye bleeding.Then we observed the changes in body weight,tumor mass,spleen index,thymus index,serum interleukin-2(IL-2)level,tumor necrosis factor-α(TNF-α),interferon-γ(IFN-γ),and the proliferation of thymus dependent lymphocytes(T cells)and bone marrow dependent lymphocytes(B cells).Results:The body weights and tumor mass of the mice from cisplatin chemotherapy group were significantly lower than those from tumor model group,and the tumor inhibition rate of cisplatin chemotherapy group was36%.While the body weights of the mice from cisplatin plus middle-dose taurine group and cisplatin plus high-dose taurine group were both significantly higher than those from cisplatin chemotherapy group,and the tumor inhibition rate were51%and68%,respectively.Moreover,the spleen mass and spleen index of the mice from cisplatin group were significantly lower than those from tumor model group,while the spleen mass and spleen index of the mice from cisplatin plus various dosage taurine groups were significantlyhigher than those from cisplatin treatment group.The thymus mass and thymus index of the mice from cisplatin treatment group were significantly lower than those from tumor model group,and the thymus mass and thymus index of the mice from cisplatin plus high-dose taurine group were significantly higher than those from cisplatin treatment group.The serum interleukin-2,IFN-γand TNF-αlevels of the mice from cisplatin treatment group were significantly lower than those from tumor model group(P <0.01).In addition,compared with the cisplatin treatment group,the serum interleukin-2,IFN-γand TNF-αlevel of the mice from cisplatin plus various dosage taurine groups were higher.What’s more,cisplatin treatment could obviously inhibit the proliferation of T cells and B cells.The stimulation index of T cells from cisplatin plus highdose taurine group was obviously higher than that from cisplatin chemotherapy group(P <0.05),while the stimulation index of B cells from both cisplatin plus low-dose and middle-dose taurine groups were obviously higher than that from cisplatin chemotherapy group.Conclusion:Taurine could exert a synergistic effect with cisplatin to inhibit tumor growth,which was achieved by protecting the damage of immune organs and lymphocytes caused by cisplatin chemotherapy.
taurine;tumor;chemotherapy;immune function
2014-07-17
保定市科技局资助项目(11ZF010);河北大学青年基金项目(2008Q069)
郭杰(1983—),男,讲师,学士,研究方向为免疫药理。E-mail:g_man@qq.com
王蓓(1978—),女,讲师,硕士,研究方向为免疫药理。E-mail:wp780203@163.com曹志然(1963—),女,教授,硕士,研究方向为免疫药理。E-mail:13933220632@163.com
R392.5;R977.4
A
1002-6630(2015)05-0200-05
10.7506/spkx1002-6630-201505038
