微囊藻毒素对凡纳滨对虾免疫相关酶活力的影响
2015-09-21陈妍妍李长玲黄翔鹄
陈妍妍,李长玲,黄翔鹄
(广东海洋大学水产学院,广东 湛江 524088)
微囊藻毒素对凡纳滨对虾免疫相关酶活力的影响
陈妍妍,李长玲,黄翔鹄
(广东海洋大学水产学院,广东 湛江 524088)
通过毒性注射实验,探究微囊藻毒素(MC-LR)对凡纳滨对虾(Litopenaeus Vannamei)肝脏免疫相关酶活力的影响。结果表明,注射MC-LR后,凡纳滨对虾肝胰脏组织的超氧化歧化酶、谷胱甘肽过氧化酶、过氧化物酶、酸性磷酸酶、碱性磷酸酶和溶菌酶的酶活力呈先增大后减小的变化趋势。超氧化歧化酶、谷胱甘肽过氧化酶和过氧化物酶活力在对虾注射MC-LR 4 h后达到峰值,比对照组分别增加了15.62%、18.76%和32.86%,随后酶活力逐渐减小;而酸性磷酸酶和碱性磷酸酶酶活力在对虾注射MC-LR 2 h后即显著增加,比对照组分别增加了25.02%和37.99%,随后酶活力逐渐减小;溶菌酶在对虾注射MC-LR后8 h达到最大值,比对照组增加了33.57%,随后酶活力逐渐减小。MC-LR能显著影响凡纳滨对虾的免疫相关酶活力(P < 0.05),引起凡纳滨对虾的应激反应和抑制它们的免疫相关酶活力。
微囊藻毒素(MC-LR);凡纳滨对虾;免疫酶
蓝藻水华在虾池中频频发生已成为当前对虾养殖面临的突出问题。蓝藻水华大量消耗水中的氧气,释放羟胺、硫化物和有毒气体[1],并产生多种蓝藻毒素(cyanotoxins),微囊藻毒素(microcystins, MCs)为其中最为常见和毒性较大的肝毒素之一[2]。有资料显示,在珠江三角洲的虾池,以铜绿微囊藻为优势种的养殖水体可致使对虾发病[3]。一定浓度颤藻能显著降低凡纳滨对虾幼虾的存活率[4]。Gonçalves-soares等[5]报道,凡纳滨对虾经MCs注射处理后,体内过氧化氢酶和谷胱甘肽S-转移酶活力和相应的基因表达量均出现了上升的趋势,以抵抗由MCs 诱导的氧化应激作用。另外,MC-LR也能影响凡纳滨对虾抗菌肽基因的表达,对免疫功能造成损伤[6]。目前,关于MCs对凡纳滨对虾免疫酶活力影响的报道还较少。
肝胰脏作为甲壳动物重要的免疫器官,是MCs侵害的主要器官之一,它的功能正常发挥与机体免疫功能息息相关[7-8]。本研究通过往凡纳滨对虾注射微囊藻毒素(WC-LR),研究其对凡纳滨对虾肝胰脏的超氧化歧化酶(SOD)、谷胱甘肽过氧化酶(GSH-PX)、过氧化物酶(POD)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和溶菌酶(LZM)酶活力的影响,以期从免疫酶活力的变化来探讨WC-LR对凡纳滨对虾的毒性作用,为对虾健康养殖提供一定的参考依据。
1 材料与方法
1.1实验材料
凡纳滨对虾幼虾购于粤海饲料集团东海岛良种基地,在广东海洋大学东海岛海洋生物研究基地室外对虾养殖池暂养,一个月后随机挑选规格相似、健康有活力的对虾作为实验对象。
微囊藻毒素标准品(MC-LR)购于台湾Express (Express Technology Co.Ltd)公司,纯度≥95%。毒性实验前将标准品充分溶解于磷酸盐缓冲液(PBS)。
1.2实验方法
1.2.1注射剂量 MC-LR 的注射剂量参考GONÇALVES-SOARES等[5]和李智等[6]的实验,预实验测定凡纳滨对虾注射剂量为每kg体质量50 μg MC-LR时,72 h的死亡率为0;而注射剂量为每kg体质量200 μg MC-LR时,72 h的死亡率为100%。故将MC-LR注射剂量设置为每kg体质量100 μg MC-LR,对照组注射等体积的PBS缓冲液。在对虾腹部第二对游泳足中央的血窦处进行注射。
1.2.2实验方法本实验在室内进行,采用300 L的玻璃钢桶进行毒性胁迫实验,海水经沙滤和消毒处理,以确保没有杂质和其他微藻影响实验对象。实验期间连续充气,水温29±2 ℃。
在正式实验前,实验用虾在室内暂养7 d,每天定时投喂人工饲料2次及更新一部分水体。然后挑选体质量为5.1±0.4 g对虾作为试验用虾,设置1处理组(注射MC-LR)和1个对照组(注射等体积PBS 溶液) ,每组3个平行,每个平行30尾对虾。
1.2.3采集样品于注射时间0 h、2 h、4 h、8 h、16 h、24 h、48 h和72 h,分别从各个实验桶内随机挑选3尾对虾,迅速取出肝胰脏放进1.8 mL的冻存管,置于液氮罐中保存,进行酶活力检测。
1.2.4酶活力检测准确称取肝胰脏质量,按质量(g) ∶体积(mL) = 1∶9的比例加入质量分数为0.86%冷生理盐水,在冰水浴中匀浆 1 min,以3 500 r/min 离心 10 min,制备成质量浓度为0.1 g/mL的组织匀浆,以测定肝胰脏组织匀浆中超氧化歧化酶、谷胱甘肽过氧化酶、过氧化物酶、酸性磷酸酶、碱性磷酸酶和溶菌酶的酶活力,测定方法采用南京建成生物工程研究所相应的检测试剂盒。
1.3数据统计
采用 SPSS19.0 软件进行单因素方差分析(oneway ANOVA) 和t 检验。使用OriginPro 8.5 进行图表绘制。
2 结果与分析
2.1WC-LR对凡纳滨对虾超氧化歧化酶活力的影响
WC-LR对凡纳滨对虾超氧化歧化酶活力的影响如图1所示。WC-LR对对虾超氧化歧化酶活力有显著性影响,对虾注射MC-LR后4 h内,超氧化物歧化酶呈现上升的趋势,并达到最大值,为123.08 U/mg,比对照组增加了15.62% (F = 24.01, P <0.01)。4 h后,处理组的超氧化歧化酶活性逐步降低,至72 h时达最低值,差异具统计学意义(F = 115.08, P <0.01)。

图1 MC-LR对凡纳滨对虾超氧化歧化酶活力的影响Fig. 1 Effects of MC-LR on activity of superoxide dismutase of L. vannamei
2.2WC-LR对凡纳滨对虾谷胱甘肽过氧化酶活力的影响
WC-LR对凡纳滨对虾谷胱甘肽过氧化酶活力的影响如图2所示。MC-LR对对虾谷胱甘肽过氧化酶活力有明显的影响。对虾注射MC-LR后4 h内,谷胱甘肽过氧化酶活力随着时间延长而逐渐增大,在4 h 达到最大值,为59.62 U/mg,比对照组升高18.76% (F = 16.11, P <0.01)。随后,处理组的谷胱甘肽过氧化酶活力逐渐下降至最低值,低于对照组,差异具统计学意义(F = 45.37, P <0.01)。
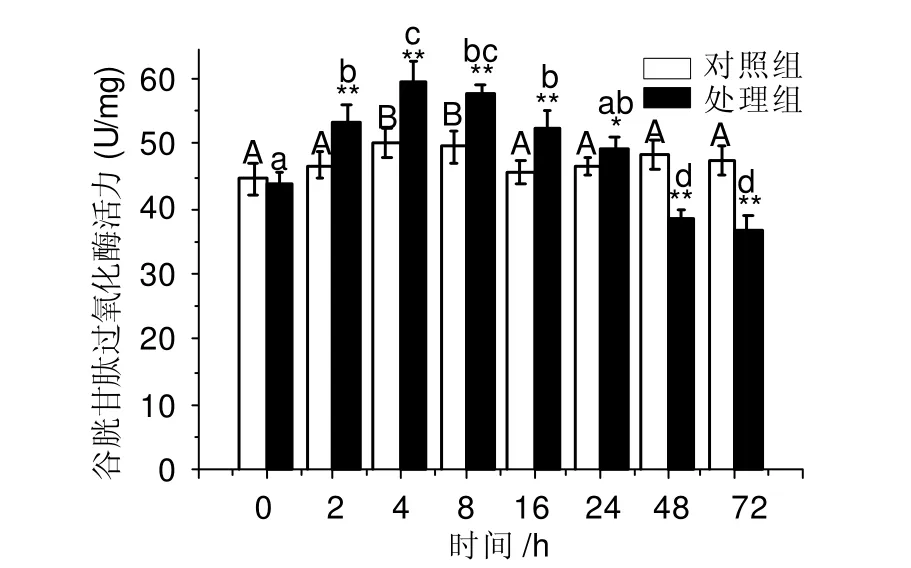
图2 MC-LR对凡纳滨对虾谷胱甘肽过氧化酶活力的影响Fig. 2 Effects of MC-LR on activity of glutathione peroxidase of L. vannamei
2.3WC-LR对凡纳滨对虾过氧化物酶活力的影响
WC-LR对凡纳滨对虾过氧化物酶活力的影响如图3所示。WC-LR对对虾过氧化物酶活力有显著影响。对虾注射MC-LR后4 h内,过氧化物酶活力随着时间延长呈现上升趋势。在4 h 时,对虾过氧化物酶酶活力最大,达2.99 U/mg,比对照组增加了32.86% (F = 27.65 , P <0.01)。随后,处理组的过氧化物酶活力逐渐下降至最低值,低于对照组,差异具统计学意义(F = 92.54 , P <0.01)。

图3 MC-LR对凡纳滨对虾过氧化物酶活力的影响Fig. 3 Effects of MC-LR on activity of peroxidase of L. vannamei
2.4WC-LR对凡纳滨对虾酸性磷酸酶活力的影响
WC-LR对凡纳滨对虾酸性磷酸酶活力的影响如图4所示。WC-LR对对虾酸性磷酸酶活力有显著影响,呈现先增大后减小的变化趋势。对虾注射MC-LR 2 h后,对虾酸性磷酸酶活力最大,达157.90 U/mg,比对照组增加了25.02% (F = 36.94, P <0.01)。随后处理组的酸性磷酸酶活力逐渐下降至最低值,低于对照组,差异具统计学意义(F = 136.03, P <0.01)。

图4 MC-LR对凡纳滨对虾酸性磷酸酶活力的影响Fig. 4 Effects of MC-LR on activity of acid phosphatase of L. vannamei
2.5WC-LR对凡纳滨对虾碱性磷酸酶活力的影响
WC-LR对凡纳滨对虾碱性磷酸酶活力的影响如图5所示。MC-LR对对虾碱性磷酸酶活力有明显的影响。碱性磷酸酶活力在对虾注射WC-LR后2 h达最高值,为181.76 U/mg,比对照组水平增加37.99% (F = 68.26, P <0.01)。在2 h后呈持续下降趋势,在72 h时达最低值,处理组的碱性磷酸酶活性仅为对照组的68.68% ,差异具统计学意义(F = 74.80 , P <0.01)。
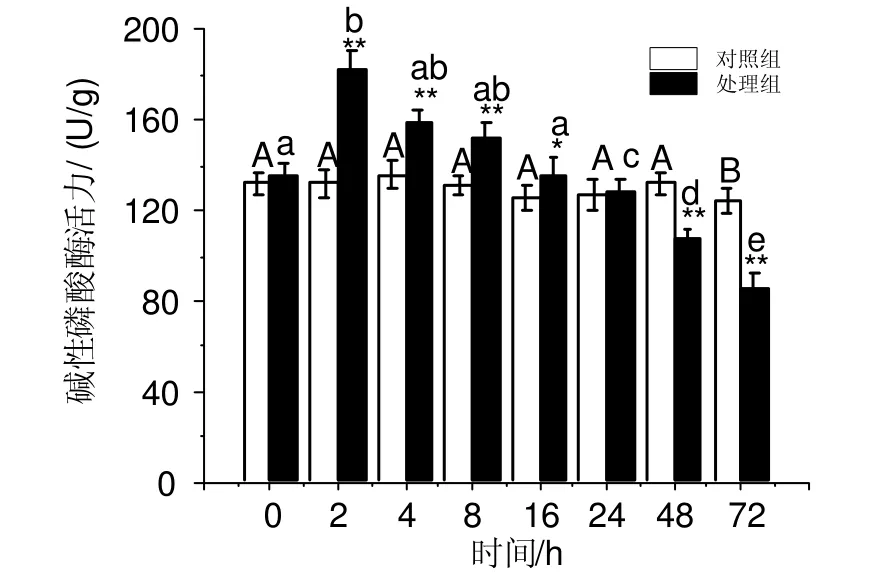
图5 MC-LR对凡纳滨对虾碱性磷酸酶活力的影响Fig. 5 级Effects of MC-LR on activity of alkaline phosphatase of L. vannamei
2.6WC-LR对凡纳滨对虾溶菌酶活力的影响
WC-LR对凡纳滨对虾溶菌酶活力的影响如图6所示。WC-LR对对虾溶菌酶活力有显著影响。对虾注射WC-LR后0~8 h间,溶菌酶活力呈现上升趋势。对虾溶菌酶活力在8 h达到峰值,达28.80 U/mg,比对照组增加了33.57% (F = 18.38 , P <0.01)。随后,处理组溶菌酶活力逐渐下降至最低值,低于对照组,差异具统计学意义(F = 13.5,P <0.01)。

图6 MC-LR对凡纳滨对虾溶菌酶活力的影响Fig. 6 Effects of MC-LR on activity of lysozyme of L. vannamei
3 讨论
3.1WC-LR对凡纳滨对虾超氧化歧化酶、谷胱甘肽过氧化酶和过氧化物酶酶活力的影响
超氧化歧化酶、谷胱甘肽过氧化酶和过氧化物都是机体内的抗氧化酶,在清除活性氧(reactive oxygen specias, ROS),防止生物分子损伤方面发挥重要的生理作用[9]。由于各种外界因素和细胞内部因素刺激而导致体内活性氧增多或机体消除活性氧能力下降,机体就会出现氧化应激(oxygen stress)[10]。有研究表明,MC能致使大鼠肝细胞的活性氧水平上升,并具有时间和剂量依赖性[11]。在体内急性毒性实验中,Moreno等[12]以每千克100和150 μg MC的剂量经腹腔注射处理大鼠,在8h后,MC能显著性抑制超氧化歧化酶的酶活性。Prieto等[13]研究表明,尼罗罗非鱼(Oreochromis niloticus)经口服铜绿微囊藻制成的饲料微丸,谷胱甘肽过氧化酶活力会受微囊藻毒素(MC-LR)抑制,活力下降。乐亚玲等[14]发现克氏原螯虾(Procambarus clarkii)血清中的过氧化物酶活性在高浓度铜绿微囊藻中暴露1 d 后显著增加。在本实验中,在对虾经MC-LR处理4 h后,超氧化歧化酶、谷胱甘肽过氧化酶和过氧化物酶活力均分别显著高于其他处理组( P <0.05) ,且达到最大值,之后随着时间延长,超氧化歧化酶、谷胱甘肽过氧化酶和过氧化物酶活力呈现降低的变化趋势。推测产生该结果的原因是,超氧化歧化酶、谷胱甘肽过氧化酶和过氧化物酶活性的增强可能是由于MC-LR诱导的活性氧的增加,机体提高超氧化歧化酶、谷胱甘肽过氧化酶和过氧化物酶活力用于清除体内过多的活性氧,以维持内环境中自由基的动态平衡;而它们的酶活性降低则可能是由于MC-LR通过细胞膜进入细胞后对细胞或酶结构造成氧化损伤引起的。由此,笔者认为MC-LR能引起凡纳滨对虾的应激反应,随着时间延长,毒素能抑制抗氧化酶活力从而削弱机体抗氧化酶清除活性氧的能力。
3.2WC-LR对凡纳滨对虾酸性磷酸酶和碱性磷酸酶酶活力的影响
酸性磷酸酶和碱性磷酸酶不仅是甲壳动物体内重要的解毒酶类,而且作为溶酶体酶的重要组成部分,在机体免疫系统中发挥积极作用[15]。张双玲等[16]认为酸性磷酸酶和碱性磷酸酶活性随MC毒素浓度和作用时间的变化而发生相应变化,可以作为MC 胁迫的生物标志物。Molina等[17]研究发现,罗非鱼(Oreochromis sp.)暴露于一定浓度铜绿微囊藻21 d后,肝脏酸性磷酸酶和碱性磷酸酶酶活力显著高于对照组。曹平等[4]研究表明,低浓度的颤藻可诱导凡纳滨对虾碱性磷酸酶活性增加,而高浓度颤藻能抑制碱性磷酸酶活性。本实验结果显示:WC-LR对对虾酸性磷酸酶和碱性磷酸酶酶活力有显著影响(P <0.05),对虾的酸性磷酸酶和碱性磷酸酶酶活力呈先升高后下降的趋势,在2 h处达到最高值,随后下降并显著性低于对照组。说明对虾受到MC-LR的胁迫后,可诱导酸性磷酸酶和碱性磷酸酶活力快速增加,从而增强机体解毒能力,但随后酸性磷酸酶和碱性磷酸酶活力持续下降,可能与MC-LR 诱导的氧化损伤有关[11-12,18]。因此,说明MC-LR对对虾有致毒作用,能促使对虾提高酸性磷酸酶和碱性磷酸酶酶活力来抵御这种毒性作用。
3.3WC-LR对凡纳滨对虾溶菌酶活力的影响
溶菌酶是非特异性免疫系统中的重要成分,在甲壳动物体内形成水解酶体系,能有效地清除体内的异物[19]。Juhel等[20]用有铜绿微囊藻喂养斑马贻贝(Dreissena polymorpha)3周后,溶菌酶活力显著高于对照组,且与 MC 暴露有时间-效应关系。有研究表明,鲤鱼(Cyprinus carpio L.)在MC-LR胁迫下,溶菌酶活力显著低于对照组[21]。李智等[6]研究发现,经MC-LR 注射后的凡纳滨对虾的抗菌肽基因的表达量均低于对照组,表明MC-LR能影响其抗菌肽在抵御外来细菌入侵时的抗菌能力。本实验中,随着MC-LR处理的时间延长,对虾的溶菌酶活力呈先升高后下降的趋势,并在8 h处达到最高值,随后下降。表明对虾在经WC-LR注射后,溶菌酶活力受到刺激产生应激反应,活力呈上升趋势,这可能是由于MC-LR影响了对虾体内溶酶体细胞膜的完整性,导致不同水解酶释放出来,用于抵御MC-LR对机体的侵害,但其中参与的水解酶种类和作用的机制比较复杂,仍需更多的研究来探讨MC-LR对体液免疫的影响[20]。
[1]CREMEN M C,MARTINEZ-GOSS M R. Phytoplankton bloom in commercial shrimp ponds using green-water technology[J]. Aquac Res,2007,19(6):615-624.
[2]截瑾瑾,陈德辉,高云芳,等. 蓝藻毒素的研究概况[J].武汉植物学研究,2009,7(1):90-97.
[3]查广才,周昌清,牛晓光. 铜绿微囊藻对凡纳滨对虾低盐度养殖的危害研究[J]. 中山大学学报(自然科学版),2007,46(2):64-67.
[4]曹平. 颤藻对凡纳滨对虾生长与免疫相关酶活力的影响[D]. 湛江:广东海洋大学,2012.
[5]GONÇALVES-SOARES D,ZANETTE J,YUNES J S,et al. Expression and activity of glutathione S-transferases and catalase in the shrimp Litopenaeus vannamei inoculated with a toxic Microcystis aeruginosa strain[J]. Marine environmental research,2012,75:54-61.
[6]李智,傅一鸣,李响,等. 凡纳滨对虾在微囊藻毒素(MC-LR) 诱导下 3 种抗菌肽基因的表达量分析[J].上海海洋大学学报,2014,23(6):842-847.
[7]SÖDERHÄLL K,CERENIUS L. Role of the prophenoloxidase-activating system in invertebrate immunity[J]. Current opinion in immunology,1998,10(1):23-28.
[8]FALCONER I R. Tumor promotion and liver injury caused by oral consumption of cyanobacteria[J]. Environmental toxicology and water quality,1991,6(2):177-184.
[9]黄旭雄,周洪琪. 甲壳动物免疫机能的衡量指标及科学评价[J]. 海洋科学,2007,31(7):90-96.
[10]王秋林,王浩毅,王树人. 氧化应激状态的评价[J]. 中国病理生理杂志,2006,21(10):2 069-2 074.
[11]DING W X,SHEN H M,ZHU H G,et al. Studies on oxidative damage induced by cyanobacteria extract in primary cultured rat hepatocytes[J]. Environmental research,1998,78(1):12-18.
[12]MORENO I,PICHARDO S,JOS A,et al. Antioxidant enzyme activity and lipid peroxidation in liver and kidney of rats exposed to microcystin-LR administered intraperitoneally[J]. Toxicon,2005,45(4):395-402.
[13]PRIETO A I,PICHARDO S,JOS Á,et al. Time-dependent oxidative stress responses after acute exposure to toxic cyanobacterial cells containing microcystins in tilapia fish(Oreochromis niloticus)under laboratory conditions[J]. Aquatic Toxicology,2007,84(3):337-345.
[14]乐亚玲,刘利平,李慷,等. 铜绿微囊藻对克氏原螯虾幼虾存活及成虾几种酶类的影响[J]. 水产学报,2011,35(8):1158-1165.
[15]邹广众,孙虎山. 水产甲壳动物免疫学研究进展与前景展望[J]. 生命科学仪器,2009(6):17-21.
[16]张双玲,陆开宏,郑忠明,等. 微囊藻毒素在铜锈环棱螺肝组织中的累积降解及对 3 种酶活性的影响[J].农业环境科学学报,2009,28(1):54-59.
[17]MOLINA R,MORENO I,PICHARDO S,et al. Acid and alkaline phosphatase activities and pathological changes induced in Tilapia fish (Oreochromis sp.) exposed subchronically to microcystins from toxic cyanobacterial blooms under laboratory conditions[J]. Toxicon,2005,46(7):725-735.
[18]DING W X,ONG C N. Role of oxidative stress and mitochondrial changes in cyanobacteria-induced apoptosis and hepatotoxicity[J]. FEMS Microbiology Letters,2003,220(1):1-7.
[19]王建平,吴雄飞. 虾类血细胞及体液免疫的研究现状[J]. 浙江海洋学院学报(自然科学版),2000,19(4):354-360.
[20]JUHEL G,RAMSAY R M,DAVENPORT J,et al. Effect of the Microcystin-Producing Cyanobacterium, Microcystis aeruginosa,on Immune Functions of the Zebra Mussel Dreissena polymorpha[J]. Journal of Shellfish Research,2015,34(2):433-442.
[21]SIEROSLAWSKA A,RYMUSZKA A,VELISEK J,et al. Effects of microcystin-containing cyanobacterial extract on hematological and biochemical parameters of common carp(Cyprinus carpio L.)[J]. Fish physiology and biochemistry,2012,38(4):1159-1167.
(责任编辑:陈庄)
Effects of Microcystin on Activities of Immune Enzymes in the White Shrimp Litopenaeus Vannamei
CHEN Yan-yan,LI Chang-ling,HUANG Xiang-hu
(Fisheries College of Guangdong Ocean University,Zhanjiang 524088,China)
The study was conducted to investigate the effects of microcystins(MC-LR)on the activity of immune enzymes in the hepatopancreas of white shrimp Litopenaeus Vannamei by toxicity experiment. The results showed that the activity of superoxide dismutase, glutathione peroxidase, peroxidase,acid phosphatase,alkaline phosphatase and lysozyme were significantly affected by MC-LR with the increasing of time(P < 0.05). Activities of these emzymes inereased in the early period of the experiment and decreased in the later period. The activities of superoxide dismutase,glutathione peroxidase and peroxidase increased 15.62%,18.76% and 32.86% at 4 h, reapectively. The activities of acid phosphatase and alkaline phosphatase increased 25.02% and 37.99% at 2 h,reapectively. The activities of lysozyme increased 33.57% at 8 h. It is concluded that MC-LR can not only induce stress response, but also suppress immune enzymes activities of L. Vannamei.
microcystin(MC-LR);Litopenaeus Vannamei;immune enzymes
S945
A
1673-9159(2015)06-0035-06
10.3969/j.issn.1673-9159.2015.06.007
2015-11-03
公益性行业(农业)科研专项(201203083);广东省专业镇中小微企业服务平台建设项目(2012B040500025);广东省海洋渔业科技推广专项(A201308B10)
陈妍妍(1989—),女,硕士研究生,研究方向为水域生态。
李长玲, 女, 教授,研究方向为水域生态。E-mail: ybcl901@126.com
