豚草提取物脲醛树脂微胶囊主要影响因子的研究
2015-09-17包颖
包 颖
(吉林省林业技术推广站,吉林 长春 130022)
豚草(Ambrosia artemisiifolia L)属菊科(Asteraceae)豚草属(Ambrosia)有花植物,有长豚草和短豚草之分,是全球性公害植物。豚草在中国属外来入侵物种,如今从南部广东省到北部黑龙江省均有分布[1~2],其种子具较强生命力,被认为是具危害性能够侵入农业与城市中的植物,其花粉在传播过程中能使人引起严重过敏性紊乱疾病[3]。然而,大量对其组成成分与性质的研究表明,豚草提取物具重要生物活性,如灭钉螺活性成分[4]、植物生长抑制性[5]、抗炎性[6]、抗凝血酶[7]、抗菌性[8]、杀虫性[9]及保肝作用[10]。这种物质的主要化学成分被认为是倍半萜烯内酯,此物质的存在使豚草提取物具有驱肠虫、强心、抗炎、止痛、镇静、抗疟疾、抗肿瘤等药理活性[11~12]。由于豚草大量蔓延,许多研究者对豚草综合防治进行大量研究。近些年研究发现,豚草提取物具有一定杀虫效果,豚草可以作为低毒植物源杀虫剂,且安全性高于化学农药[13]。但植物源杀虫剂在使用过程中极易受温度、光照等外界条件影响而失去生物活性,药效降低。微胶囊剂是新型环境友好型剂型,以水取代二甲苯作为助剂,能够缓慢释放、延长药效、降低毒副作用。作者以豚草提取物为囊芯物质,以脲醛树脂为囊壁材料,探讨原位聚合法制备豚草提取物脲醛树脂微胶囊的适宜条件,旨在为进一步研制高效、低毒、安全的植物源微胶囊剂提供基础数据。
1 试验材料、试剂和仪器
材料:豚草提取物(自制)[6,9],尿素(分析纯,国药集团化学试剂有限公司)。
试剂:甲醛(质量分数30.03%,分析纯)、丙酮(质量分数58.08%,分析纯)、Tween-80(质量分数74.92%,分析纯,AMRESCO)、戊二醛(质量分数100.12%,分析纯)、冰乙酸(质量分数60.05%,分析纯)、氢氧化钠(质量分数40%,分析纯)、乙醇(质量分数95%,分析纯)、以上试剂均为国药集团化学试剂有限公司产品;去离子水(实验室自制)。
仪器:高速粉碎机(RT-12),超声波清洗机(FRQ-1004HT),平行蒸发仪(V-700),磁力搅拌器(SZCL-A),高速离心机(D-37520),冷冻干燥机(LL3000),扫描电子显微镜 (QUANTA200),紫外分光光度计(CARY 100)[14~16]。
2 试验方法
2.1 脲醛树脂预聚体的制备
称取一定量尿素和甲醛溶液于烧杯中,使用质量分数为1%氢氧化钠溶液调节pH 至8 ~9,在搅拌速度200 r·min-1、70℃条件下反应一段时间,制得脲醛树脂预聚体。
2.2 豚草提取物脲醛树脂微胶囊悬浮液的制备
豚草提取物脲醛树脂微胶囊悬浮液的制备采用原位聚合法,其原理是利用尿素和甲醛单体、预聚体或低分子量聚合物,在酸性物质固化剂催化作用下,在油水界面上形成聚合囊壁,进而包覆散相粒子,从而使有效成分微胶囊化。
称取一定量豚草提取物活性物质,与80%乙醇溶液1 ∶10 体积比混合,加入一定量Tween-80,置于磁力搅拌器进行搅拌,搅拌速度控制在低速,制成豚草提取物悬浮液,再将已制好的脲醛树脂预聚体缓慢倒入豚草提取物悬浮液中,边倒边搅拌,温度缓慢升至45℃恒温,使用冰乙酸调节pH,继续搅拌进行乳化反应,加入一定量去离子水,反应一段时间后,加入固化剂戊二醛溶液1 mL 并调节体系pH 值至8 ~9,同时对溶液进行降温处理,固化1 h 后,取出微胶囊溶液进行离心处理,转速3 000 r·min-1下离心10 min,取出上清液,用去离子水将离心管下方沉淀洗涤并抽滤,最后得到的微胶囊置于冷冻干燥机内干燥,干燥后的物质为豚草提取物微胶囊粉末,室温下保存[14 ~16]。
2.3 豚草提取物脲醛树脂微胶囊化的包封率和载药量
取一定量豚草提取物质分别配制成五个质量浓度溶液,使用乙醇溶液作为空白对照,利用紫外分光光度计在660 nm 波长条件下测其吸光度A,以A 对质量浓度C 线性回归得出标准曲线方程。将制备完成的微胶囊悬浮液离心后,取其上清液1 mL 稀释,上清液里含有游离未被包覆的豚草提取物,取适量于比色皿中,置于紫外分光光度计进行测定,重复3 次,使用紫外分光光度计测定其在660 nm 处吸光度A,根据得出的标准曲线方程计算未被包覆的豚草提取物含量,计算包封率(A.E.)和载药量(L.C.)[14~16]。
微胶囊包封率(A.E.)和载药量(L.C.)计算公式如下:
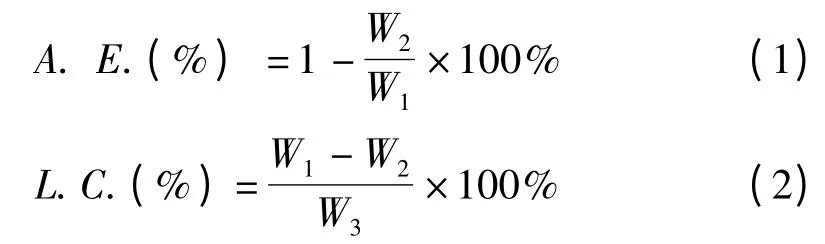
式中:W1——芯材总量;
W2——微胶囊表面未被包覆的芯材总量;
W3——微胶囊粉末的质量。
2.4 单因素试验
单因素试验是指先预选对试验有可能造成影响的条件因素,保持其他反应条件不变情况下,只改变其中一个反应条件参数,分别进行试验,通过计算微胶囊化包封率和载药量,讨论设置的每个因素值域范围对试验结果的影响,并在相同试验条件下重复3 次,最后得出对试验结果有影响因素和最佳试验条件配比[14]。
在豚草提取物脲醛树脂微胶囊的单因素试验中,采用6 个因素条件来反映不同试验条件对结果的影响情况,分别是脲醛树脂预聚体制备时间、尿素与甲醛质量比、芯壁比、成囊pH、成囊时间和搅拌速度,每个试验因素分别设置4 个不同参数。
2.4.1 脲醛树脂预聚体制备时间对微胶囊形成的影响
分别设置脲醛树脂预聚体制备时间为2.5 h、2.0 h、1.5 h、1.0 h。尿素与甲醛质量比1.0∶2.0,芯壁比1∶1,成囊pH 为2.0,成囊时间100 min,搅拌速度300 r·min-1左右,反应温度40℃~50℃。
2.4.2 尿素与甲醛质量比对微胶囊形成的影响
分别设置尿素与甲醛质量比为2.5∶1.0、1.5∶1.0、1.0∶1.5、1.0∶2.5。脲醛树脂预聚体制备时间1.0 h,芯壁比1:1,成囊pH 为2.0,成囊时间100 min,搅拌速度300 r·min-1左右,反应温度40℃~50℃。
2.4.3 芯壁比对微胶囊形成的影响
分别设置芯壁比为3 ∶1、2 ∶1、1 ∶2、1∶3。脲醛树脂预聚体制备时间1.0 h,尿素与甲醛质量比1.0∶1.0,成囊pH 为2.0,成囊时间100 min,搅拌速度300 r·min-1左右,反应温度40℃~50℃。
2.4.4 成囊pH 对微胶囊形成的影响
分别设置成囊pH 为3.0、2.5、1.5、1.0。脲醛树脂预聚体制备时间1.0h,尿素与甲醛质量比1.0 ∶1.0,成囊pH 为2.0,成囊时间100 min,搅拌速度300 r·min-1左右,反应温度40℃~50℃。
2.4.5 成囊时间对微胶囊形成的影响
分别设置成囊时间为30 min、60 min、90 min和120 min。脲醛树脂预聚体制备时间1.0 h,尿素与甲醛质量比1.0∶1.0,成囊pH为2.0,搅拌速度300 r·min-1左右,反应温度40℃~50℃。
2.4.6 搅拌速度对微胶囊形成的影响
分别设置搅拌速度为200 r·min-1、400 r·min-1、600 r·min-1和800 r·min-1。脲醛树脂预聚体制备时间1.0 h,尿素与甲醛质量比1.0 ∶1.0,成囊pH 为2.0,反应温度40℃~50℃。
2.5 豚草提取物脲醛树脂微胶囊形态特征
制备好的微胶囊经干燥成为粉末状后,先进行喷金处理。利用扫描电子显微镜观察豚草提取物微胶囊外部形态特征。2.6 豚草提取物脲醛树脂微胶囊粒径分布
利用激光粒度分布仪得到粒径分布曲线,得出中位径及粒径分布区间。
3 结果与分析
3.1 单因素试验结果与分析
3.1.1 脲醛树脂预聚体制备时间对微胶囊形成的影响
脲醛树脂预聚体制备时间为2.5 h、2.0 h、1.5 h、1.0 h 时,制得的微胶囊包封率分别为18.15%、31.47%、67.25%、71.35%,载药量分别为33.97%、35.12%、58.22%、59.75%。从中可以看出,脲醛树脂预聚体制备时间在1.0 ~1.5 h时包封率和载药量较高,制备预聚体时间过长,有效成分易失活,造成性状不稳定,不利于微胶囊形成;制备时间过短反应不完全,无法形成预聚体。
3.1.2 尿素与甲醛质量比对微胶囊形成的影响
尿 素 与 甲 醛 质 量 比 为 2. 5 ∶1. 0、1.5∶1.0、1.0∶1.5、1.0∶2.5 时,制得的微胶囊包封率分别为21.56%、29.21%、60.11%、76.15%,载药量分别为13.51%、30.90%、47.98%、57.36%。从中可以看出,尿素与甲醛质量比在1.0∶1.5 ~1.0∶2.5 时包封率和载药量较高。构成囊壁的脲醛树脂交联度和空间结构差异对脲醛树脂微胶囊形态、性能影响较大。预聚体形成过程中,其组成和体系受尿素与甲醛质量比、温度、pH 值等因素影响,尤其受尿素与甲醛质量比影响最大。因此,设置最优化的尿素与甲醛质量比对预聚体形成至关重要。
3.1.3 芯壁比对微胶囊形成的影响
芯壁比为3∶1、2∶1、1∶2、1∶3 时,制得的微胶囊包封率分别为34.08%、33.32%、59.82%、19.13%,载药量分别为35.80%、26.34%、46.52%、29.45%。由此得知,芯壁比为1:2 的微胶囊包封率和载药量较高。芯壁比的设置直接影响到微胶囊大小、形状、厚度、成囊率、及缓释性能。芯材过量时,囊壁材料不能完全将芯材包覆,导致包封率和载药量下降,也会使囊壁膜变薄;过少则会造成大量壁材剩余。壁材用量对微胶囊囊壁厚度及致密度影响很大,壁材过多时,会有大量囊芯附在微胶囊表面,囊壁变厚,渗透性较差,不利于囊芯缓慢释放,还会造成囊壁材料自行成球现象,使体系不平衡;用量过少,油相不会完全被包覆,所得微胶囊会因囊皮过薄而破裂,重新恢复到油相状态,不能达到理想的包封率和载药量。
3.1.4 成囊pH 对微胶囊形成的影响
成囊pH 为3.0、2.5、1.5、1.0 时,制得的微胶囊包封率分别为36.56%、69.35%、72.48%、38.47%,载药量分别为33.45%、77.15%、62.76%、38.68%。从中可以看出,成囊pH 在1.5 ~2.5 时,制得的微胶囊包封率和载药量较高,利于微胶囊形成。初始pH 值会影响反应速度且与微胶囊表面光滑与粗糙程度有关[17]。脲醛树脂预聚体在低pH 值条件下会发生急剧聚合反应,从而形成许多粒径较大树脂块,很难沉积并包覆形成微胶囊,或者有很少量微胶囊形成,微胶囊之间都黏结在一起,不会形成独立且分散的个体;而在高pH 值条件下,聚合反应难以形成,不利于微胶囊形成,囊壁与囊芯分散在体系中,造成体系不稳定。
3.1.5 成囊时间对微胶囊形成的影响
成囊时间为30 min、60 min、90 min 和120 min 时,制得的微胶囊包封率分别为27.47%、72.92%、61.29%、47.57%,载药量分别为32.68%、74.95%、79.55%、34.85%。可以看出,成囊时间在60 ~90min 时,微胶囊包封率和载药量较高。成囊时间设置稍长些有利于微胶囊形成,但不能过长,否则易发生絮结现象;时间过短反应不完全,会残留较多囊壁和囊芯材料,不能进行很好地包覆。
3.1.6 搅拌速度对微胶囊形成的影响
搅拌速度为200 r·min-1、400 r·min-1、600 r·min-1和800 r·min-1时,制得的微胶囊包封率分别为59.85%、62.28%、49.75%、42.55%,载药量分别为52.23%、59.67%、42.78%、36.76%。可 以 看 出,搅 拌 速 度200 ~400 r·min-1时微胶囊包封率和载药量较高。搅拌过程伴随微胶囊制备全过程,微胶囊制备过程中,随温度升高,必须加大机械强度促其形成微胶囊,机械强度低不利于成囊稳定性;但搅拌速度不宜太高,应保持在低转速条件下,整个体系才能保持稳定状态,高转速下形成剪切速度太快,易使体系紊乱,阻碍微胶囊形成。因此,只要将搅拌速度控制在低转速下即可保证反应正常进行。
单因素试验所得适宜条件下制备的微胶囊包封率与载药量均达到80%以上。
3.2 豚草提取物脲醛树脂微胶囊形态特征
豚草提取物脲醛树脂微胶囊外部形态如图1 所示。可以看出微胶囊外部形态规则,呈球状,较光滑。

图1 豚草提取物脲醛树脂微胶囊SEM 照片Fig.1 The SEM of Ambrosia artemisiifolia extractive urea resin microcapsule
3.3 豚草提取物脲醛树脂微胶囊粒径分布
豚草提取物脲醛树脂微胶囊粒径分布如图2 所示。其中位径为19.99 μm;大部分粒径分布在14.43 ~45.38 μm 之间,分布有序,大粒径微胶囊极少存在。
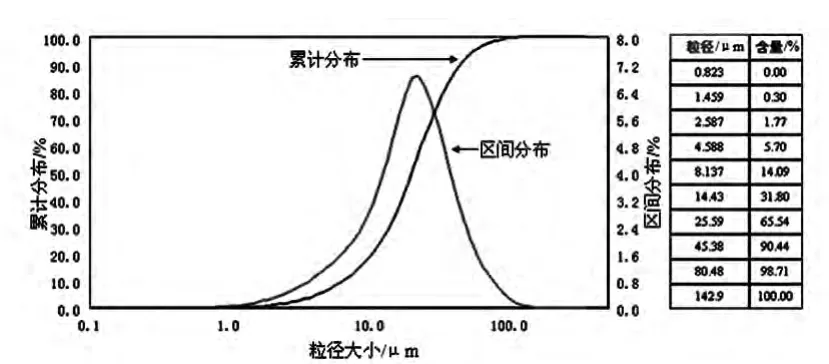
图2 豚草提取物脲醛树脂微胶囊粒径分布Fig.2 Particle size distribution of Ambrosia artemisiifolia extractive urea resin microcapsule
4 结论与讨论
制备豚草提取物脲醛树脂微胶囊适宜条件为:脲醛树脂预聚体制备时间为1.0 ~1.5 h,尿素与甲醛质量比为1.0∶1.5 ~1.0∶2.5,芯壁比为1 ∶2,成囊pH 为1.5 ~2.5,成囊时间60 ~90 min,搅拌速度200 ~400 r·min-1时微胶囊包封率和载药量较高。单因素试验所得适宜条件下制备微胶囊包封率与载药量均达到80%以上,且外部形态规则,表面较光滑。
原位聚合法工艺水平相对成熟,且操作简单,壁厚及芯材用量可控,成本低,易于形成工业化大规模生产。但原位聚合法制得微胶囊表面粗糙、易黏连,干燥后易变形,产生原因除缩聚反应中与反应时间、酸化时间、温度、表面活性剂选择与用量等因素有关外,还与脲醛预聚体制备条件有关。预聚体反应时间选择要适中,本试验结果显示,脲醛树脂预聚体制备时间在1.0 ~1.5 h 范围内较适宜,与丁明惠[18]研究结果中缩聚反应1.0 h 为最佳缩聚反应时间基本吻合。本试验所得尿素与甲醛质量比为1.0 ∶1.5 ~1.0 ∶2.5,与万邱影[19]和张大侠[20]等人研究结果不一致,其原因有可能与囊芯材料选择不同有关,万邱影和张大侠等人选择包覆材料为化学农药,而本试验选择低毒植物源杀虫剂为囊芯。今后应对产生这一差异的具体原因及预聚体制备最适宜条件进行深入研究。
脲醛树脂微胶囊制备过程中,芯壁比试验结果除与张大侠研究结果有差异外,与其他相关资料均一致,张大侠研究得出不同芯壁比对于包封率没有影响,与微胶囊其他性质形成有关[20]。本试验最适成囊pH 值为1.5 ~2.5,范传杰[17]研究结果表明,较高pH 值条件下反应不完全,形成脲醛分子量过小,难以沉积到芯材表面,而在较低pH 条件下,脲醛树脂快速反应并大量沉积在芯材上,导致制得微胶囊表面不光滑,研究结果还表明,反应终点pH 值大于3.0时制得微胶囊表面光滑,而试验中最适成囊pH 值保证了最佳包封率与载药量,制得微胶囊表面形态并不一定为最佳。因此,可以看出初始pH 值、终点pH 值、反应时间、温度等条件相互作用共同影响微胶囊形成。因此,今后对于脲醛树脂微胶囊最适成囊pH 值的研究要基于各种反应条件进行综合考虑,并进行深入探讨。
[1]Ding W,Huang R,Zhou Z,et al. New sesquiterpenoids from Ambrosia artemisiifolia L.[J].Molecules,2015,20(3):4450-4459.
[2]Lu D W,Liu J,Qu H. Spread of ragweed and advances of preventive measures in China[J].Chin. J. Allergy Clin.Immunol.,2012,6:60–63.
[3]Taglialatela-Scafati O,Pollastro F,Minassi A,et al.Sesquiterpenoids from common ragweed(Ambrosia artemisiifolia L.),an invasive biological polluter[J].Eur.J.Org.Chem.,2012,27:5162–5170.
[4]El-Sawy M F,Bassiouny H K,El-Magdoub A I.Biological combat of schistosomiasis Ambrosia maritima(Damsissa)for snail control[J]. J. Egypt. Soc. Parasitol.,1981,11:99–117.
[5]Bradow J M. Germination regulation by Amaranthus palmeri and Ambrosia artemisiifolia[M]. In The Chemistry of Allelopathy;Thompson A C,Ed.;American Chemical Society:Washington,DC,USA,1985;Chapter 19:285–299.
[6]Pérez-G R M. Anti-inflammatory activity of Ambrosia artemisiaefolia and Rhoeo spathacea[J].Phytomedicine,1996,3:163–167.
[7]Chistokhodova N,Nguyen C,Calvino T,et al. Antithrombin activity of medicinal plants from central Florida[J].J.Ethnopharmacol,2002,81:277–280.[8]Soluji S,Sukdolak S,Vukovi N,et al. Chemical composition and biological activity of the acetone extract of Ambrosia artemisiifolia L. pollen[J]. J. Serb. Chem.Soc,2008,73:1039–1049.
[9]Zhang G C,Zhao Y,Ma L,et al.Toxicity testing of insecticidal active substances from Ambrosia artemisiifolia and its security[J]. J. Northeast For. Univ,2010,38:94–96.
[10]Parkhomenko A Y,Oganesyan E T,Andreeva O A,et al. Pharmacologically active substances from Ambrosia artemisiifolia[J]. Part 2.Pharm. Chem. J,2006,40:627–632.
[11]David J P,de O Santos A J,da S Guedes M L,et al. Sesquiterpene lactones from Ambrosia artemisiaefolia(Asteraceae)[J].Pharm.Biol,1999,37:165–168.
[12]Parkhomenko A Y,Andreeva O A,Oganesyan E T,et al. Ambrosia artemisiifolia as a source of biologically active substances[J]. Pharm. Chem. J,2005,39:149–153.
[13]张欣倩,张国财,包颖,等.豚草提取液对小鼠肝脏CarE 活性及蛋白质含量的影响[J]. 北京林业大学学报,2012,34(2):109-111.
[14]包颖.复凝聚法制备豚草提取物微胶囊剂的研究[D].哈尔滨:东北林业大学,2013.
[15]包颖,张国财.单凝聚法制备豚草提取物微胶囊剂的研究[J].北京林业大学学报,2013,35(4):101-105.
[16]包颖,赵杨,张欣倩.豚草提取物脲醛树脂微胶囊制备与表征[J].吉林林业科技,2015,44(5):39-43.
[17]范传杰.脲醛树脂壁材微胶囊的制备[D].上海:华东理工大学,2010.
[18]丁明惠.脲醛树脂微胶囊制备及应用研究[D].哈尔滨:哈尔滨工程大学,2006.
[19]万邱影.2,4—滴丁酯微胶囊悬浮剂的研制[D].长春:吉林农业大学,2012.
[20]张大侠.脲醛树脂和聚氨酯壁材微胶囊农药应用性能的对比研究[D].泰安:山东农业大学,2011.
