Synthesis of vitamin E catalyzed by [(C2H5)3NH]Cl/ZnCl2 ionic liquid
2015-09-12LUOManDUJunLIUZuohuaFANXingZHOUXiaoxiaTAOChangyuan
LUO Man, DU Jun, LIU Zuohua, FAN Xing, ZHOU Xiaoxia, TAO Changyuan
[(C2H5)3NH]Cl/ZnCl2离子液体催化合成维生素E
罗曼1,杜军1,刘作华1,范兴1,周小霞2,陶长元1
(1重庆大学化学化工学院,重庆 400044;2第三军医大学化学教研室,重庆 400038)
维生素E合成过程中催化剂用量大、损失严重且不能循环使用,后处理过程产生大量废液导致严重的环境问题。实验合成了几种Lewis酸性离子液体,并应用于维生素E合成。研究发现,[(C2H5)3NH]Cl/ZnCl2离子液体催化合成维生素E效果最好,该离子液体中无机阴离子起主要催化作用,季铵阳离子易与异植物醇的羟基形成氢键,能使异植物醇与主环发生定向缩合反应。采用FT-IR研究了[(C2H5)3NH]Cl/ZnCl2离子液体结构和酸性,并系统考察了其对维生素E合成的影响。随着ZnCl2摩尔分数增加,离子液体的Lewis酸性增强。在ZnCl2摩尔分数为0.66的[(C2H5)3NH]Cl/ZnCl2离子液体催化作用下,维生素E的产率可达到87.4%,该离子液体重复使用5次,催化性能没有明显下降。
Lewis酸;离子液体;维生素E;合成;催化剂
引 言
维生素E(vitamin E,VE)是苯并二氢吡喃的衍生物,又称生育酚,因其良好的抗氧化性以及在生命体新陈代谢中的重要作用,在食品、饲料、医药及化妆品等得到了广泛应用[1-2]。工业生产维生素E以2,3,5-三甲基氢醌和异植物醇为原料[3],ZnCl2和浓HCl为催化剂,经缩合得到α-生育酚。由于游离的生育酚在空气中容易被氧化,生育酚要进一步经醋酸酐酯化反应制备维生素的乙酸酯[4-5]。传统工艺中存在催化剂使用量大、腐蚀性强、损失严重等问题,且后期处理产生大量含锌有机废水,导致严重的“三废”问题[6]。
为了克服上述缺点,研究人员开发了多种替代催化剂。Qian等[7]提出以H3PW12O40和H3PMo12O40杂多酸为催化剂合成维生素E,但因催化剂遇水容易失活,循环使用性能并不理想。Werner等[8]将Nafion和Amberlyst固体酸用于维生素E的合成,使用碳酸丙烯酯为反应介质,所得维生素E的产率可高达90%。Xu等[9]研究了Nafion/SiO2纳米组件对TMHQ和IP合成维生素E的影响,得到维生素E的产率可达86%。虽然固体酸催化合成维生素E的产率较高,但这类催化剂价格昂贵、重复使用活性差。为提高催化剂的使用效率、实现催化剂的重复使用,Xing等[10]将磺酸功能化离子液体用于维生素E合成,其产率可达90.4%,离子液体循环使用效果好,但催化体系还存在设备要求高、操作过程复杂、催化剂价格贵等缺点。
近年来,Lewis酸性离子液体以化学稳定性好、环境友好等[11-14]优点,已广泛应用于Friedel-Crafts反应中[15-16]。本文采用有机胺盐和无机金属盐为原料,合成几种Lewis酸性离子液体用于催化合成维生素E,通过调节有机卤化物和无机金属盐的比例来调节离子液体的酸碱性[17-18],探讨离子液体Lewis酸性对维生素E合成的影响,进一步考察离子液体的重复使用性能。
1 实验部分
1.1 实验原料
2,3,5-三甲基氢醌、异植物醇均由西南合成制药有限公司提供;氯化锌,分析纯,天津市光复科技发展有限公司;盐酸三乙胺,分析纯,国药集团化学试剂有限公司;氯化1-丁基-3-甲基咪唑,分析纯,河南利华制药有限公司。
1.2 实验方法
1.2.1 离子液体的合成 准确称量[(C2H5)3NH]Cl 3.03 g,ZnCl26.0 g(摩尔比1:2),加入100 ml三口瓶中,再加入溶剂正庚烷20 ml,不断通入氮气保护,90℃恒温油浴条件下搅拌反应4 h,冷凝回流。然后在150℃油浴条件下蒸馏出溶剂正庚烷,继续搅拌加热2 h,制得淡黄色离子液体,如式(1)所示,置于干燥器中备用。
同理,可制得不同摩尔比的[(C2H5)3NH]Cl/ZnCl2离子液体以及一定摩尔比的[(C2H5)3NH]Cl/AlCl3、[Py]Cl/ZnCl2、[Py]Cl/AlCl3、[Bmim]Cl/ZnCl2、[Bmim]Cl/AlCl3离子液体。
1.2.2 离子液体的表征 合成的Lewis酸性离子液体用红外光谱FT-IR(液膜法)表征其结构,并与文献中报道的离子液体的红外结构谱图对比。
[(C2H5)3NH]Cl/ZnCl2离子液体的酸性测定: 将乙腈与不同ZnCl2摩尔分数的离子液体按乙腈和离子液体中ZnCl2摩尔比1:1配制,加入适量氯仿稀释后,以KBr为背景,液膜法测定红外吸收光谱。
采用差热-热重分析仪对合成的离子液体进行热稳定性测定,测试条件为:30~600℃,升温速率为10 ℃·min-1,N2氛围。
1.2.3 缩合反应 在100 ml带恒压分液漏斗三口烧瓶中,依次加入一定量的离子液体催化剂、25 ml乙酸乙酯、2.5 g三甲基氢醌(TMHQ)以及0.24 ml的浓盐酸,待TMHQ完全溶解,用恒压分液漏斗缓慢滴加5 g异植物醇(IP),在60℃下反应3 h,反应过程中需要通氮气保护。其中,离子液体中无机氯化物MCl与反应原料TMHQ的摩尔比为1:1。缩合反应方程式为
反应结束后,蒸馏回收乙酸乙酯,剩余物为维生素E和离子液体,加入30 ml石油醚溶解维生素E。将溶液置于分液漏斗中,加入20 ml甲醇萃取分离离子液体,上层为石油醚层(溶有维生素E),下层为离子液体层,分出离子液体层。离子液体层经过蒸馏除去其中甲醇后可回收,重复使用作为缩合反应的催化剂。石油醚层继续用蒸馏水洗至洗出液的pH7.0,蒸馏回收石油醚后即得维生素E。
1.2.4 酯化反应 在100 ml带有冷凝管的圆底烧瓶中,加入缩合反应中合成的维生素E、0.36 g NaBH4、0.025 g无水乙酸钠及6.6 g乙酸酐。反应温度由90℃升到130℃,在130℃下反应3 h。酯化反应方程式为
反应结束后,减压蒸馏除去过量的乙酸酐以及生成的乙酸,然后加入30 ml石油醚溶解维生素E乙酸酯,石油醚层继续用75%甲醇和蒸馏水交替洗涤至洗出液的pH7.0,最后蒸馏回收石油醚后即得到维生素E乙酸酯。通过气相色谱法(内标法)检测计算维生素E乙酸酯纯度,分析方法和条件见文献[19],进而计算维生素E乙酸酯的产率。
2 结果与讨论
2.1 离子液体的表征
2.1.1 [(C2H5)3NH]Cl/ZnCl2离子液体的结构表征 图1曲线a为[(C2H5)3NH]Cl红外光谱图,2800~3000 cm-1之间的谱带可归属为侧链上CH3和CH2的伸缩振动峰,叔铵盐在2700~2500 cm-1处出现多重峰,指纹区1445、1382、1365 cm-1归属于侧链上C(CH3)的弯曲振动峰,1072 cm-1左右的吸收峰是CN的伸缩振动和骨架伸缩振动引起的。图1曲线b为[(C2H5)3NH]Cl/ZnCl2红外光谱图,2800~3000 cm-1处的侧链上CH3和CH2的伸缩振动峰,与[(C2H5)3NH]Cl的红外光谱相比发生蓝移,这是由于负电荷与[C2H5NH]+之间的相互作用弱于Cl-,而使得[C2H5NH]+的CH强化产生的[20]。另外,在663 cm-1和555 cm-1处出现有弱的吸收峰,可能是ZnCl的弯曲振动所致。
2.1.2 [(C2H5)3NH]Cl/ZnCl2离子液体的酸性表征 红外光谱法常用来检测溶液的酸性,寇元等[21]提出用乙腈作为探针测定离子液体酸性强弱,提出乙腈探针与Lewis酸位作用后,乙腈在2250 cm-1处的CN伸缩振动吸收峰变弱并在高波数出现新峰,可以来指示离子液体的酸性。表征结果如图2所示,
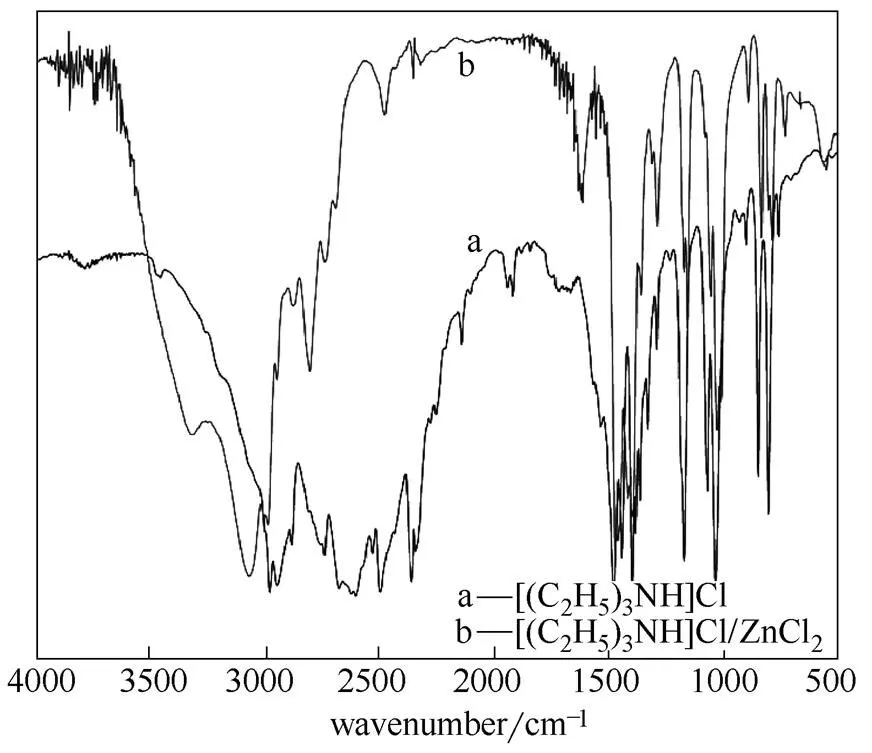
图1 [(C2H5)3NH]Cl与[(C2H5)3NH]Cl/ZnCl2的 红外光谱图
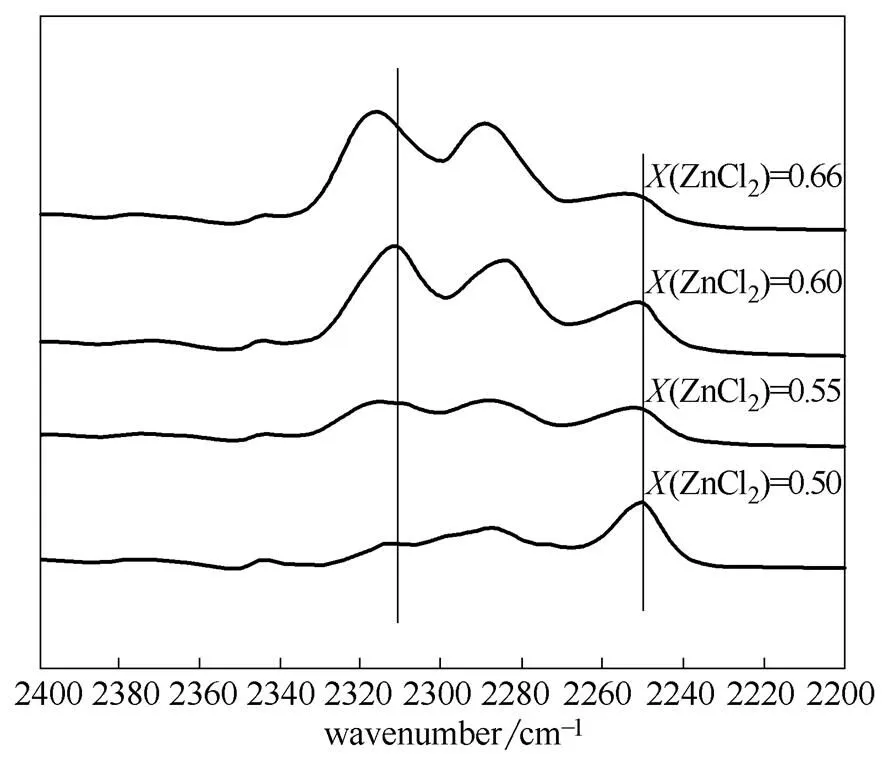
图2 乙腈(ACN)探针法测定不同组成[(C2H5)3NH]Cl/ZnCl2酸性的FT-IR谱图
图中(ZnCl2)为离子液体中氯化锌的摩尔分数,计算公式为
图中2250 cm-1和2290 cm-1附近为乙腈特征红外吸收峰,乙腈与Lewis酸作用时,在2310 cm-1附近会出现新的红外吸收峰,该峰为乙腈中CN与氯化锌酸位的特征吸收峰,它向高波数位移程度以及峰的大小与离子液体酸强度的变化保持一致。从图2可看出,随着(ZnCl2)逐渐由0.50增加到0.66时,离子液体阴离子增加,2250 cm-1附近的特征峰逐渐减小直至消失,而2310 cm-1附近的新峰逐渐增强并发生蓝移,这与文献[21]中所述现象一致。这些现象表明,随着ZnCl2含量的增加,[(C2H5)3NH]Cl/ZnCl2离子液体Lewis酸性增强。
2.1.3 [(C2H5)3NH]Cl/ZnCl2离子液体的热稳定性 利用差热-热重分析仪对离子液体[(C2H5)3NH]Cl/ZnCl2热稳性进行测试,结果如图3所示。DTA曲线上有两个热吸收峰,第一个峰开始温度为380℃,其峰值温度为404℃;第二个峰开始温度为510℃,其峰值温度为529℃,温度达到540℃时,热分解过程完成。温度为100℃,失重率仅为6%,对应于水分的脱除。[(C2H5)3NH]Cl/ZnCl2离子液体的初始分解温度为320℃,热重损失最高温度为530℃,在室温至300℃之间,离子液体失重率较低,结构相对比较稳定,为其循环使用提供了稳定性基础。
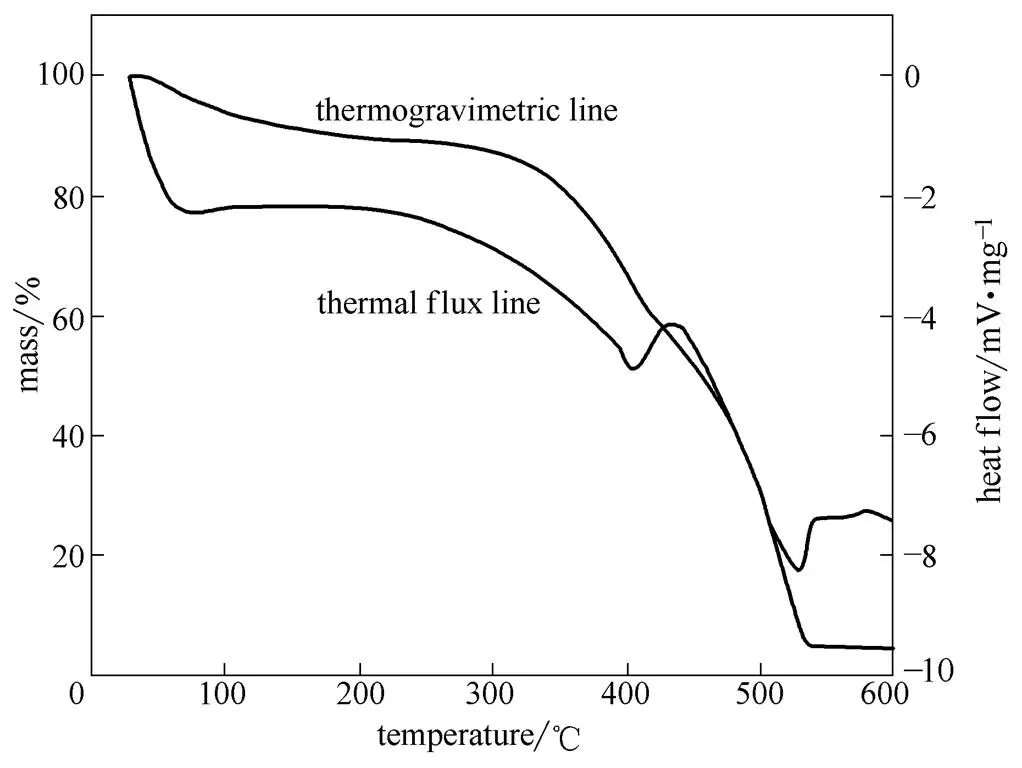
图3 [(C2H5)3NH]Cl/ZnCl2差热-热重曲线
2.2 不同Lewis酸性离子液体对维生素E产率的影响
Lewis离子液体是由有机阳离子和无机阴离子组成的,不同的阴阳离子对其催化性能和反应的结果有着很大的影响。实验考察了不同种类的Lewis酸性离子液体对维生素E产率的影响,有机阳离子选用咪唑阳离子、吡啶阳离子和季铵阳离子,无机阴离子选用ZnCl2、AlCl3,其中(TMHQ):(IP):(MCl)1:1:1,实验结果见表1。
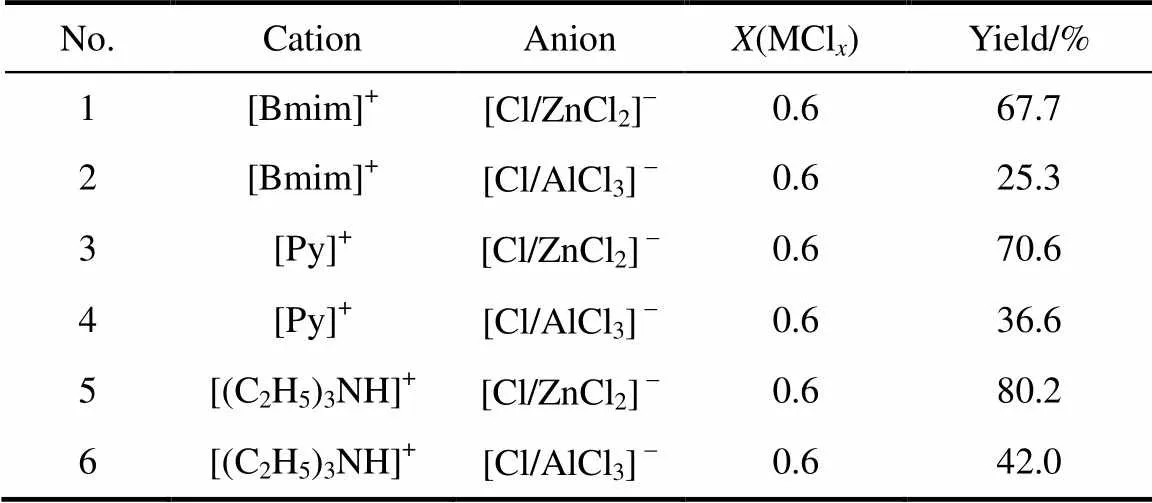
表1 离子液体种类对VE产率的影响
Note: [Bmim]+—1-butyl-3-methylimidazolium;—mole fraction of ZnCl2/AlCl3in ionic liquid.
由表1可见,无机金属氯化物种类对维生素E产率影响较大,ZnCl2类离子液体的催化活性明显高于AlCl3离子液体。缩合反应机理(图4)是主环三甲基氢醌与离子液体中无机阴离子作用,形成相对稳定的复合物Ⅱ,为活性较强的质子酸。异植物醇与活化主环形成离子对Ⅲ,使两分子紧密接触而失水,形成过渡态物质Ⅳ,Ⅳ易转变为稳定的苯并二氢吡喃环(VE)。该反应为烷基化和脱水反应的结合,因此反应需在酸性催化条件下进行。离子液体的酸性顺序为AlCl3>ZnCl2[22],理论上离子液体的催化活性应与酸性顺序一致,但合成维生素E反应会产生少量水,AlCl3类离子液体对水敏感导致其催化活性低于ZnCl2类离子液体。
阳离子的种类同样也会影响影响离子液体的催化性能,由表1可得,在无机阴离子相同的情况下,阳离子为[(C2H5)3NH]+的离子液体所得维生素E产率明显高于阳离子为[Bmim]+和[Py]+的离子液体,原因是季铵阳离子易与异植物醇中的羟基形成氢键[23],如图4中Ⅰ。异植物醇上氧的自由电子对被氢键阻碍,这样能使反应定向缩合,避免异植物醇发生自缩合反应,从而提高了维生素E的产率。且盐酸三乙胺价格便宜,[(C2H5)3NH]+类离子液体较适用于工业生产。综合考虑可得,[(C2H5)3NH]Cl/ZnCl2离子液体催化性能较佳,得到维生素E的产率高达80%以上。
2.3 [(C2H5)3NH]Cl/ZnCl2离子液体组成对维生素E产率的影响
离子液体为可调节的液体,可通过调节其阴阳离子的比例来改变其催化性。实验分别考察了不同ZnCl2摩尔分数的[(C2H5)3NH]Cl/ZnCl2离子液体对维生素E产率的影响,从图5可看出,不同ZnCl2摩尔分数的离子液体对维生素E产率影响较大。当离子液体中(ZnCl2)0.50时,离子液体几乎没有催化活性,维生素E的产率仅有2.7%。随着离子液体中氯化锌摩尔分数的增加,维生素E的产率逐步增加,当(ZnCl2)0.55时,维生素E的产率为61.0%,当(ZnCl2)0.60时,维生素E产率达到80.2%,当(ZnCl2)0.66时,维生素E产率达到最高87.4%。结合图2中离子液体酸性表征结果可知,随着离子液体中氯化锌摩尔分数的增加,离子液体的Lewis酸性增强,催化活性增加,得到的维生素E产率增加。
2.4 [(C2H5)3NH]Cl/ZnCl2离子液体的重复使用性
传统工艺中催化剂用量大且不能重复使用,导
图5 不同组成的[(CH)NH]Cl/ZnCl离子液体对
维生素E产率的影响
Fig.5 Effect of [(CH)NH]Cl/ZnCl ionic liquid
with different compositions on yield of VE
致了大量锌盐的损失,同时也产生了大量的含锌废水,故催化剂的重复使用有十分重要的意义。本实验考察了ZnCl2摩尔分数为0.66的[(C2H5)3NH]Cl/ZnCl2离子液体的重复使用性,结果如图6所示。从图中可看出,[(C2H5)3NH]Cl/ZnCl2离子液体经过5次循环使用,维生素E产率仍保持在82.4%,与新鲜催化剂相比,产率仅降低了5%,证明了该离子液体有良好的重复利用性能。由于缩合反应中生成的少量水积累在离子液体中,水分脱除不彻底导致离子液体催化性能降低,还有少量未反应完的原料残余在离子液体中,导致离子液体活性降低。
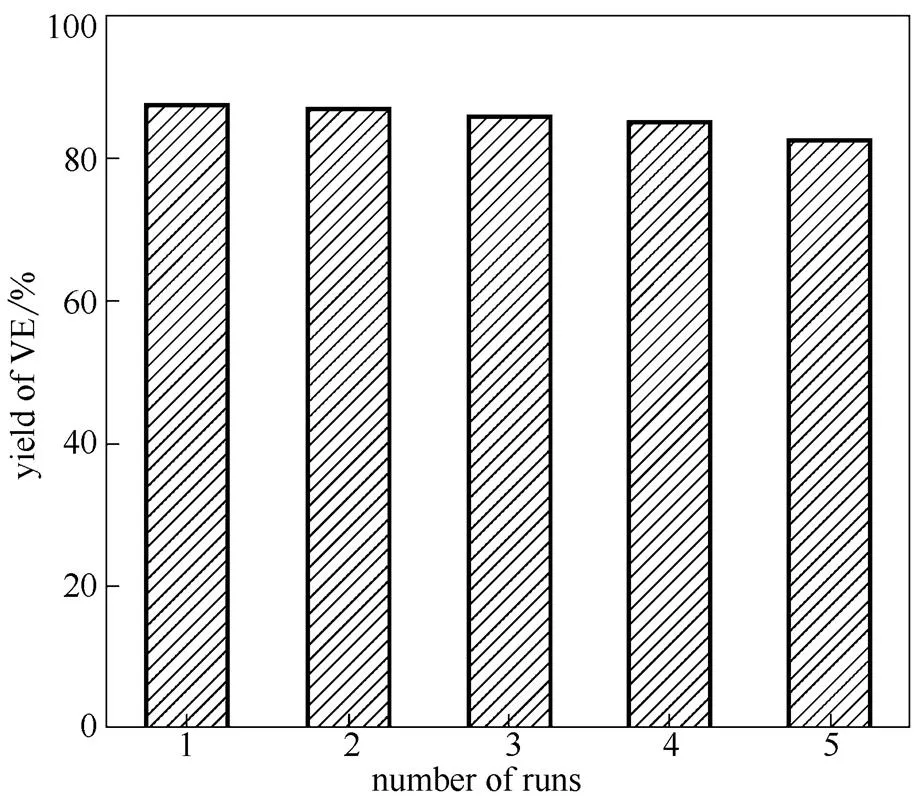
图6 [(C2H5)3NH]Cl/ZnCl2离子液体的重复使用性能
3 结 论
(1)在合成的6种Lewis酸性离子液体[Bmim]Cl/ZnCl2、[Bmim]Cl/AlCl3、[Py]Cl/ ZnCl2、[Py]Cl/AlCl3、 [(C2H5)3NH]Cl/ZnCl2、[(C2H5)3NH]Cl/AlCl3中,[(C2H5)3NH]Cl/ZnCl2离子液体催化合成维生素E效果最好。其催化维生素E缩合反应的机理为:三甲基氢醌与离子液体中阴离子作用,形成活性较强的复合物,异植物醇与活化主环形成离子对,使两分子紧密接触失水而形成过渡态物质,进而转变为维生素E。由于季铵阳离子[(C2H5)3NH]+与异植物醇的羟基形成氢键,使异植物醇能与主环的1-OH发生定向缩合反应生成维生素E。
(2)不同ZnCl2摩尔分数的[(C2H5)3NH]Cl/ZnCl2离子液体对维生素E产率影响较大,随着离子液体中ZnCl2摩尔分数增加,Lewis酸性增强,得到维生素E的产率增加。离子液体催化合成维生素E的最佳反应条件是:60℃下反应3h,[(C2H5)3NH]Cl/ZnCl2离子液体中氯化锌的摩尔比为0.66,(ZnCl2):(TMHQ):(IP)1:1:1,维生素E的总产率为87.4%。
(3)对ZnCl2摩尔分数为0.66的[(C2H5)3NH]Cl/ ZnCl2离子液体的重复使用性进行测试,发现离子液体在循环使用5次后,维生素E产率仅降低了5%,说明该离子液体稳定性好,可重复使用。
References
[1] Huang Xiangui (黄贤贵), Li Tao (李涛), Jin Ronghua (金荣华), Tian Weisheng (田伟生). Asymmetric synthesis of vitamin E [J].(有机化学), 2006, 26 (10): 1353-1361
[2] Wang Shaoning, Werner Bonrath, Horst Pauling, Frank Kienzle. The synthesis of d,l-α-tocopherol in supercritical media [J]., 2000, 17 (2): 135-143
[3] Coman S M, Wuttke S, Vimont A, Daturi M, Kemnitz E. Catalytic performance of nanoscopic, aluminium trifluoride-based catalysts in the synthesis of (all-rac)-α-tocopherol [J]., 2008, 350 (16): 2517-2524
[4] Baldenius K, Bussche-Hlinnefeld L, Hilgemann E, Hoppe P, Stiirmer R. Acetate by condensation of trimethyldroquinone with isopytol [P]: EP, 132384A2. 2001-12-09
[5] Liu Zuohua (刘作华), Sun Ruixiang (孙瑞祥), Tao Changyuan (陶长元), Wu Chunxia (吴春霞). A method for the preparation of vitamin E acetate [P]: CN, 102276572A. 2011-12-14
[6] Juraj Gömöry, Milan Králik. Study of (all-rac)-α-tocopherol synthesis from trimethylhydroquinone and isophytol at the presence of solid catalysts [J]., 2010, 3 (2): 110-121
[7] Qian Dong, Cui Jia, Tan Yanzhi, Wang Kaiyi. Synthesis of d,l-α-tocopherol catalyzed by heteropoly acids [J]., 1999, 10 (6): 443-444
[8] Frank Schager, Werner Bonrath. Synthesis of d,l-α-tocopherol using strong solid acids as catalysts [J]., 1999, 182: 282-284
[9] Wang Hai, Xu Boqing. Catalytic performance of Nafion/SiO2nanocomposites for the synthesis of α-tocopherol [J].:, 2004, 275: 247- 255
[10] Xing Huabin, Wang Tao, Dai Youyuan. Continuous synthesis of d,l-α-tocopherol catalyzed by sulfonic acid-functionalized ionic liquid in supercritical carbon dioxide [J]., 2009, 49 (1): 52-58
[11] Du Jun (杜军), Ke Gaili (柯改利), Liu Zuohua (刘作华), Liu Renlong (刘仁龙), Tao Changyuan (陶长元). Effects of ionic liquid and/or catalysts on product distribution of methyl cellulose pyrolysis by microwave [J].(化工学报), 2012, 63 (4): 1083-1088
[12] Du Jun, Shi Jing, Li Zhengfei, Liu Zuohua. Ionic liquid mediated CO2activation for DMC synthesis [J]., 2012, 21: 476-479
[13] Guo Jintang (郭锦棠), Zhu Chengcai (朱成才), Tian Jing (田晶), Zhang Hongxin (张鸿信). Application of novel ionic liquid in copolymerization of carbon monoxide and styrene [J].() (化工学报), 2008, 59 (2): 497-502
[14] Zhang Lipeng (张丽鹏), Yu Xianjin (于先进), Zhao Zengdian (赵增典), Dong Yunhui (董云会), Wang Xiaoming (王晓铭), Zhang Dechao (张德超). Synthesis of [EMIM]Br-AlCl3ionic liquid [J].(化工学报), 2011, 62 (S2): 173-178
[15] Qiao Kun, Deng Youquan. Alkylations of benzene in room temperature ionic liquids modified with HCl [J]., 2001, 171 (1/2): 81-84
[16] Hao Suxia (郝苏霞), Wang Guirong (王桂荣), Luan Yanqin (栾艳勤), Zhao Xinqiang (赵新强), Wang Yanji (王延吉). Progress in the application of ionic liquids for Friedel-Crafts reactions [J].(化工进展), 2009, 28 (6): 953-957
[17] Zhao Dishun (赵地顺), Ge Jingjing (葛京京), Zhai Jianhua (翟建华). Synthesis of succinic acid diisopropyl ester catalyzed by Lewis acid ionic liquids [J].(化工学报), 2014, 65 (2): 561-569
[18] Wang Xiaolei (王晓磊), Han Jinyu (韩金玉), Wang Hua (王华). Preparation of lactide using ionic liquid catalyst [J].() (化工学报), 2007, 58 (12): 3082-3085
[19] National Pharmacopoeia Committee (国家药典委员会). Pharmacopoeia of the People’s Republic of China (中华人民共和国药典) [M]. Part 2. Beijing: Chinese Medical Science and Technology Press, 2010: 907-908
[20] Fan Mingming (范明明), Wang Hui (王辉), Zhang Pingbo (张萍波), Ni Bangqing (倪邦庆). Synthesis, characterization and catalysis performance of ionic liquid 1-butyl-3-methylimidazolium chlorozincate [J].(无机化学学报), 2012, 27 (7): 1333-1337
[21] Wang Xiaohua (王晓化), Tao Guohong (陶国宏), Wu Xiaomu (吴晓牧), Kou Yuan (寇元). Investigate of the acidity of ionic liquids by IR spectroscopy [J].(物理化学学报), 2005, 21 (5): 528-633
[22] Yang Yali, Kou Yuan. Determination of the Lewis acidity of ionic liquids by means of an IR spectroscopic probe [J]., 2004 (2): 226-227
[23] Bulychev E Yu, Kartsev G N. On the mechanism of α-tocopherol synthesis. Effect of amines on the yield and purity of α-tocopherol [J]., 1999, 33 (5): 267-268
Synthesis of vitamin E catalyzed by [(C2H5)3NH]Cl/ZnCl2ionic liquid
LUO Man1, DU Jun1, LIU Zuohua1, FAN Xing1, ZHOU Xiaoxia2, TAO Changyuan1
(1School of Chemistry & Chemical Engineering, Chongqing University, Chongqing 400044, China;2Department of Chemistry, Third Military Medical University, Chongqing 400038, China)
The main problems in the synthesis of vitamin E are large dosage and much loss of the catalyst, as well as difficulty to recycle the catalyst. There also exist serious environmental problems caused by contamination of water with the catalysts in the washing process. Several ionic liquids were synthesized to catalyze the synthesis of vitamin E. [(C2H5)3NH]Cl/ZnCl2ionic liquid had the best catalytic performance. The inorganic anion in the ionic liquid played the major catalytic role, and the quaternary ammonium cation could form hydrogen bonds with isophytol easily, which enabled directed condensation reaction between isophytol and trimethylhydroquinone. The structure and acidity of [(C2H5)3NH]Cl/ZnCl2ionic liquid were characterized by FT-IR, and its effect on production of vitamin E was investigated. With the increase of mole fraction of ZnCl2, the ionic liquid showed stronger acidity. When the mole fraction of ZnCl2in ionic liquid was 0.66, yield of vitamin E could reach 87.4% under catalysis of [(C2H5)3NH]Cl/ZnCl2. The ionic liquid could be reused 5 times without significant decrease in catalytic performance.
Lewis acid; ionic liquid; vitamin E; synthesis; catalyst
10.11949/j.issn.0438-1157.20141011
TQ 032.4
国家自然科学基金项目(31101447);重庆市重点科技攻关项目(CSTC2011AB5020)。
date: 2014-07-07.
TAO Changyuan, taocy@cqu.edu.cn
supported by the National Natural Science Foundation of China (31101447).
A
0438—1157(2015)01—0126—06
2014-07-07收到初稿,2014-09-17收到修改稿。
联系人:陶长元。第一作者:罗曼(1991—),女,硕士研究生。
