基于Ag配合物的流动注射
2015-09-11扶昭富李攻科��胡玉斐
扶昭富+李攻科��胡玉斐


摘 要 基于氢化可的松对Ag配合物-H2SO4体系化学发光信号的增敏作用,建立了一种测定血清中氢化可的松的流动注射-化学发光分析方法。当H2SO4浓度为1.0 mol/L,Ag配合物浓度为2.5×10
4 mol/L,流速为4.20 mL/min时,体系具有最强的化学发光。在最优实验条件下,相对发光强度与氢化可的松浓度在3.0×10
~1.0×10
7 g/mL范围内呈良好的线性关系,方法的检出限为2.2×10
10 g/mL (3σ)。对5.0×10
8 g/mL氢化可的松连续平行测定11次,其相对标准偏差为0.6%。本方法成功地用于人血清中氢化可的松的含量测定,回收率为93.0%~110.0%,相对标准偏差在0.3%~3.2%之间。通过研究该体系的紫外可见吸收光谱和荧光发射光谱,探讨了可能的化学发光机理。
关键词 化学发光; 流动注射; 氢化可的松; Ag配合物; 血清
[HT][HK][FQ(32,X,DY-W][CD15] 2015-07-21收稿; 2015-08-06接受
本文系国家自然科学基金项目(Nos.21475153, 21107008, 91232703)及高等学校博士学科点专项项目(No.20120171110001)
* E-mail: cesgkl@mail.sysu.edu.cn; huyufei@mail.sysu.edu.cn[HT]
1 引 言
氢化可的松(Hydrocortisone,分子结构见图1)是人肾上腺产生的一种肾上腺糖皮质激素,它在人体生理过程中起着至关重要的作用。氢化可的松主要作用包括参与免疫和代谢两方面。在免疫方面,氢化可的松主要起抗炎和免疫抑制作用,影响体内免疫球蛋白的生成[1]; 在代谢行为方面,它主要是参与中间代谢(通常是分解代谢),例如减少体内组织对葡萄糖的吸收,通过加速葡萄糖异生酶在肝脏的合成加强葡萄糖异生作用[2]。血液中氢化可的松的浓度通常可以反映机体应激性亢进水平[3]。氢化可的松在临床上可用于诊断与其浓度水平相关的疾病,如阿狄森病患者的肾上腺类固醇排泄水平低,库欣综合征患者体内氢化可的松生产过剩。此外,高血清水平(氢化可的松)也发现存在于应激反应,如精神疾病、肥胖、糖尿病、酗酒和怀孕人群。低水平的皮质醇见诸于肾上腺酶缺陷患者和长时间处于压力下的人群[4]。
已报道的测定氢化可的松的方法包括免疫法[5,6]、液相色谱法[7,8]、气相色谱-质谱联用法[9]、液相色谱-质谱法[10~12]、毛细管电色谱[13]等。然而,这些方法都存在一定的缺陷,例如色谱法和质谱法需要昂贵的仪器,对环境的要求高; 免疫法易受样品中相似结构的化合物的交叉反应影响。因此,建立一种简单、快速、灵敏度高、选择性好的氢化可的松检测方法具有重要意义。化学发光检测技术具有线性范围宽、灵敏度高、检测限低、仪器设备简单和分析速度快等优点。结合流动注射技术(FI),化学发光法具有重现性好的特点,已广泛应用于环境、医药等领域[14~18]。超常氧化态配合物通常可以在碱性环境中通过多齿配体的络合作用而稳定存在[19~21]。
[Ag(HIO6)2]5
(Diperiodatoargentate,Ag配合物,简写为DPA)是一种超常氧化态配合物,也是一种强氧化剂,目前广泛应用于无机,有机反应的动力学及反应机理研究[21]。由于具有强氧化性与良好的催化性能,DPA也逐渐引起分析研究者的关注。基于DPA和鲁米诺的化学发光法测定氢化可的松已有报道[23],而发光试剂如鲁米诺等的使用会影响方法的选择性。
研究发现,氢化可的松可大大增强DPA在H2SO4介质中产生的微弱化学发光信号,该体系不需要发光试剂,方法的选择性也较高。本研究基于该化学发光反应,结合流动注射技术,建立了一种灵敏的氢化可的松的分析方法,并成功应用于人血清中氢化可的松的检测。通过荧光光谱和紫外光谱的研究,探讨了可能的化学发光反应机理。
2 实验部分
2.1 仪器与试剂
如图2所示,流动注射化学发光(FI-CL)系统由两个蠕动泵用于输送试液,样品注射通过一个带定量环的六通阀实现。系统各部分的连接使用聚四氟乙烯管(直径0.8 mm)。CL信号通过BPCL微弱发光检测仪测量(中国科学院生物物理研究所); LS-45发光光谱仪 (美国Perkin Elmer 公司)。紫外分光光度仪(北京普析通用仪器有限责任公司)。
氢化可的松来源于德国Dr Ehrenstorfe公司,AgNO3,KIO4,K2S2O8和KOH购于上海第一化学试剂厂。所有试剂都为分析纯,实验用水均为二次蒸馏水。氢化可的松储备液:准确称取氢化可的松100 mg,用甲醇溶解,并定容至100 mL。
2.2 实验过程
2.2.1 DPA的合成 按文献[24]方法,将AgNO3 (1.36 g), KIO4 (3.24 g), K2S2O8 (3.00 g),KOH (8.00 g)与200.0 mL去离子水混合,加热回流40 min,冷却后过滤,得到DPA,低温避光保存。通过其在λ=361 nm处的紫外吸光度计算其浓度(A=εcL, 摩尔吸光系数ε=1.26×104 L/(mol·cm)。
2.2.2 样品处理 血清样品由中山大学医院提供。取适量血清,置于超滤管中,4000 r/min离心20 min,过滤,滤液用乙酸乙酯萃取3次,收集有机相并将其蒸干,加入适量水溶解,待测。
2.2.3 实验方法 如图2所示,在
950 V的负高压下,时间间隔为0.1 s。以水为载流,经管道输入流通池与DPA溶液在流通池中混合,开启分析系统,待基线平稳后,切换阀,通过载流注入100 μL氢
图2 FI-CL系统装置图
Fig.2 Schematic diagram of FI-CL system
P:蠕动泵(Peristaltic); V:进样阀(Valve); F:流通池(Flow Cell); PMT:光电倍增管(Photomultiplier Tube); AMP: 信号放大器(Amplifier); HV: 高压(High Voltage); REC: 记录仪(Recorder); W:废液(Waste); HV:
50 V。a: H2SO4; b: Hydrocortisone; c: Water; d: Diperiodatoargentate (DPA).化可的松标准溶液或样品溶液与H2SO4的混合液,与DPA溶液在流通池中混合,产生化学发光,通过检测系统记录反应的发光信号,在线性范围内,根据相对发光强度ΔI(ΔI=I-I0)进行定量分析。
3 结果与讨论
3.1 化学发光反应动力学曲线
采用静态注射法研究了氢化可的松-DPA-H2SO4体系的化学发光动力学曲线。用0.1 mL微量注射器将DPA溶液迅速注入到H2SO4和样品(或水)(1∶1, V/V)的混合液中,产生显著的化学发光。由图3可见,这是一个快速反应过程,从试剂混合到发光强度达最大峰值所用时间仅为0.5 s,并在5 s内完成整个过程。因此,基于氢化可的松对DPA-H2SO4发光反应的增敏作用,结合流动注射技术可对氢化可的松进行测定。
3.2 条件优化
3.2.1 进样体积及流速的选择 进样体积及流速能直接影响发光强度,结果表明,当进样体积为200 μL时,可获得最大的发光强度,所以实验选定的最佳进样体积为200 μL。实验发现,发光强度随流速的增加而增大,但考虑到精确性与试剂用量,选择4.20 mL/min进行后续实验。
3.2.2 反应介质的选择 考察了常见的酸性介质HCl、HNO3、H3PO4、多聚磷酸和H2SO4对该体系反应的化学发光强度的影响。研究表明,DPA在酸性环境中能产生微弱的化学发光,氢化可的松的加入能大大增强化学发光信号。在H2SO4介质中,体系的发光强度最大且稳定,而在其它介质中未观察到明显的发光信号,故选用H2SO4为反应介质。固定其它条件,考察0.05~2.0 mol/L H2SO4溶液对化学发光强度的影响。如图4所示,随着H2SO4浓度增大,氢化可的松的相对发光强度也增大; 当H2SO4浓度达到1.0 mol/L时,相对发光强度达到最大值; 继续增大H2SO4浓度,化学发光强度反而减小。因此,H2SO4溶液的最佳浓度选用1.0 mol/L。
3.2.3 DPA浓度的选择 DPA在体系中是氧化剂,其浓度对发光信号的影响很大。在5.0×10
1.0×10
3 mol/L范围内,考察了DPA溶液浓度对化学发光信号的影响。由图5可见,当DPA溶液浓度低于2.5×10
4 mol/L, 相对发光强度随DPA溶液浓度的增加而增大,当其浓度达到2.5×10
4 mol/L时,相对发光强度达到最大发光值; 继续增大DPA的浓度,发光强度反而会减小,其原因可能是DPA为橘红色溶液,浓度过大会导致自吸收。因此DPA溶液的浓度选用2.5×10
4 mol/L。
3.3 分析特性
在最佳实验条件下,氢化可的松的质量浓度在0.3 ~10 ng/mL范围内与相对发光强度呈良好的线性关系,回归方程为I=7.62C-18.58 (ng/mL, R2=0.9991 )。对浓度为50 ng/mL氢化可的松平行测定11次,相对标准偏差为0.6%。方法的检出限为0.22 ng/mL。
3.4 干扰测定
在选定的最优条件下,考察了人血清样品中常见组分对该化学发光体系的干扰情况,结果见表1。对于50 ng/mL氢化可的松,相对误差小于5%的条件下,部分物质及离子对氢化可的松的测定有一定的干扰,特别是尿酸和Cl
,故在对血清进行实际检测时需要进行样品前处理。
3.5 样品分析
标准加入回收实验: 在0.5 mL血清样品或注射液样品中加入适量氢化可的松标准溶液,搅拌混匀
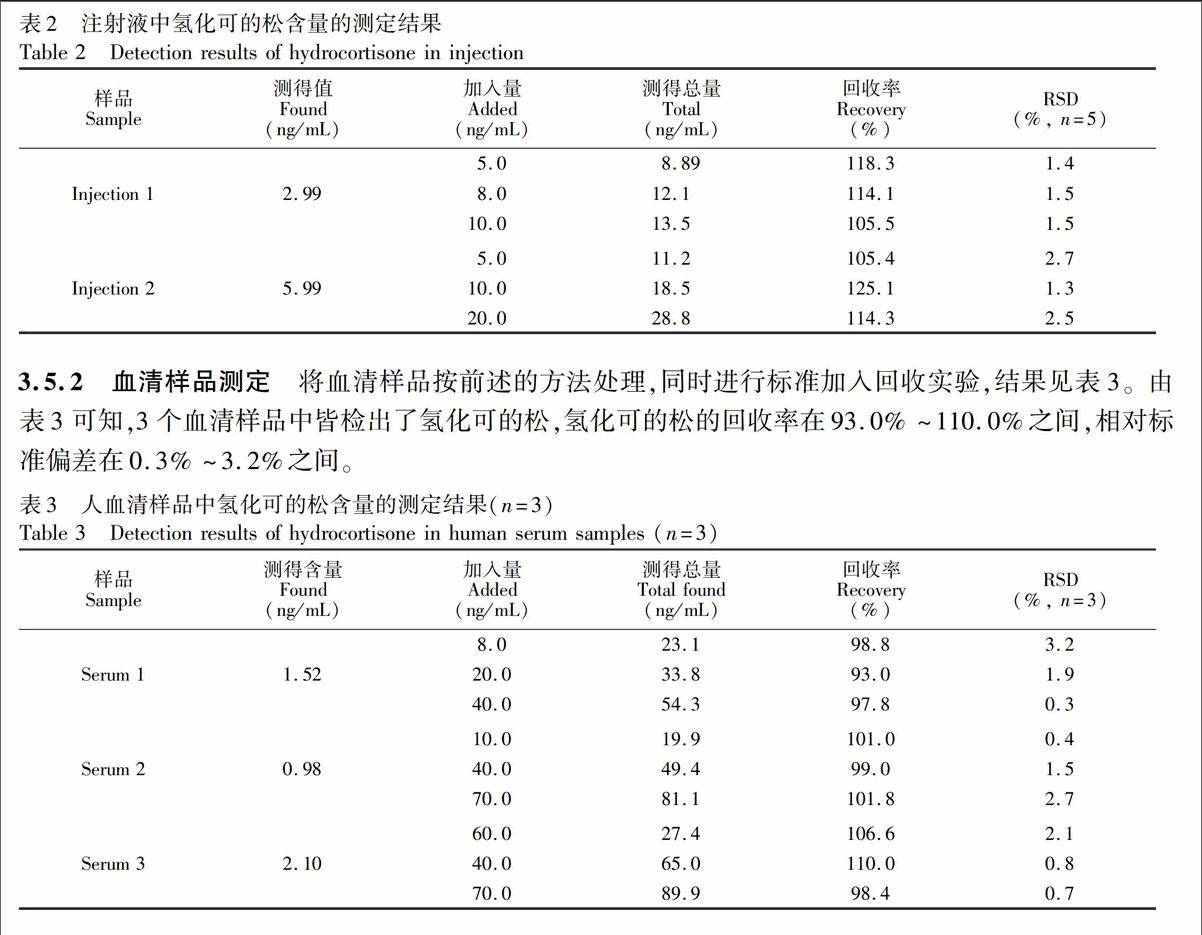
3.5.1 注射液测定 将氢化可的松注射液(每管25 mg)用水稀释至不同浓度,按照实验方法测定,同时进行标准加入回收实验。由表2可知,氢化可的松的回收率在105.4%~125.1%之间,相对标准偏差在1.3%~2.7%之间。
3.5.2 血清样品测定 将血清样品按前述的方法处理,同时进行标准加入回收实验,结果见表3。由表3可知,3个血清样品中皆检出了氢化可的松,氢化可的松的回收率在93.0%~110.0%之间,相对标准偏差在0.3%~3.2%之间。
3.6 化学发光机理探讨
3.6.1 紫外可见吸收光谱图研究 氢化可的松-DPA-H2SO4体系的紫外可见吸收光谱图如图6所示。DPA的吸收峰在364 nm处,当加入H2SO4后,DPA溶液的颜色逐渐褪去,其吸收峰减弱,表明H2SO4与DPA发生了化学反应。氢化可的松的吸收峰在249 nm处,当其与DPA或DPA-H2SO4混合后,其紫外光谱明显不同于氢化可的松和DPA或DPA-H2SO4紫外吸收光谱图的简单加合,说明氢化可的松与DPA发生了反应。
3.6.2 荧光光谱研究 在300~475 nm范围内,氢化可的松-DPA-H2SO4体系的荧光光谱图见图7。H2SO4和DPA在300~475 nm波长范围内均无荧光,但DPA存在基体光谱峰,两者混合之后,DPA的基体光谱峰发生了明显的变化,可推断DPA与H2SO4可发生化学反应。氢化可的松在紫外光激发下能产生特征荧光,其最大激发波长和发射波长分别为289 和361 nm; 当其与H2SO4混合,由于酸效应使荧
光发射峰强度降低,但无明显位移,可以推断H2SO4与氢化可的松之间并未产生化学反应; 当其与DPA混合时,仅在460 nm处产生一个弱发射峰,存在明显的位移,由此可以推断,DPA与氢化可的松发生了强的相互作用,这可能是反应过程中产生的激发态(O2)2*所引起的[25,26]。将DPA、H2SO4和氢化可的松三者混合所得到的荧光光谱也表明三者之间发生了化学反应在反应过程中可能产生了O2·
O2·
之间结合可能产生富电子中间体:激发态(O2)2*,(O2)2*返回基态生成O2[27,28]。
紫外可见光谱和荧光光谱测试表明,在H2SO4介质中,DPA与氢化可的松发生了化学反应,Shi等[29]的研究表明, DPA有两种存在形式:[Ag(HIO6)2]5
和 [Ag(HIO6)(OH)(H2O)]2
(图8),后者是活性中心并能发生复合反应。氢化可的松分子可以获得激发态(O2)2*的部分能量从而被激发。DPA-H2SO4-氢化可的松体系产生的发光可能来源于DPA和氢化可的松获得(O2)2*的能量, 并被激发,返回基态时,能量以光的形式释放,产生CL发射[25~28]。
4 结 论
本研究基于H2SO4介质中氢化可的松对DPA信号的增强作用,提出了一种测定氢化可的松的流动注射化学发光法。研究结果表明,本方法具有设备简单、操作方便、灵敏度高、线性范围宽等优点,适用于实际样品分析。
References
1 Nagae M, Fuda H, Ura K, Kawamura H, Adachi S, Hara A, Yamauchi K. Fish Physiol. Biochem., 1994, 13(1): 41-48
2 Jost C M, Picon R I. Br. Vet. J., 1970, 125: 321-326
3 Attia M S, El-Swafy E, Youssef A O, Hefny H A, Khalil M H. J. Fluoresc., 2014, 24(2): 337-344
4 Turpeinen U, Hmlinen E. Best Pract. Res. Cl. En., 2013, 27(6): 795-801
5 Zangheri M, Cevenini L, Anfossi L, Baggiani C, Simoni P, Di Nardo F, Roda A. Biosens. Bioelectron., 2015, 64: 63-68
6 Yadav R, Mohan K, Kumar V, Sarkar M, Nitu K, Meyer H H D, Prakash B S. Domest. Anim. Endocrin., 2013, 45(2): 72-78
7 Saracino M A, Iacono C, Somaini L, Gerra G, Ghedini N, Raggi M A. J. Pharmaceut. Biomed., 2014, 88: 643-648
8 Ronowicz J, Kupcewicz B, Pakowski A, Bilski P, Siódmiak T, Marsza M, Krysiski J. Chem. Pap., 2014, 68(7): 861-870
9 Amendola L, Garribba F, Botrè F. Anal. Chim. Acta, 2003, 489(2): 233-243
10 Snchez-Guijo A, Hartmann M F, Shi L, Remer T, Wudy S A. Anal. Bioanal. Chem., 2014, 406(3): 793-801
11 Chen Z, Li J, Zhang J, Xing X, Gao W, Lu Z, Deng H. J. Chromatogr. B., 2013, 929: 187-194
12 ZHOU Jian,WANG Min,TANG Xiao-Yan,MAO Xue-Fei,DAI Xin-Hua. Chinese J. Anal. Chem., 2013, 41(9): 1439-1443
周 剑, 王 敏, 汤晓艳, 毛雪飞, 戴新华. 分析化学, 2013, 41(9): 1439-1443
13 SUN Xue-Ting, SHANG Shao-Ming, CHEN Xiu-Ying, WANG Yun, LI Juan. Chinese J. Anal.Chem., 2014, 42(1): 36-40
孙雪婷, 商少明, 陈秀英, 汪 云, 李 娟. 分析化学, 2014, 42(1): 36-40
14 Iranifam M. Revisiting Flow-Chemiluminescence Techniques: Pharmaceutical Analysis, Luminescence. 2013, 28(6): 798-820
15 Christodouleas D, Fotakis C, Economou A, Papadopoulos K, Timotheou-Potamia M, Calokerinos A. Anal. Lett., 2011, 44(1-3): 176-215
16 XIAO Hu-Yong, CHEN Jia, WEI Guo-Fen, HU Qin-Qin, AI Yong-Qing, HAN Yun, ZHOU Xing-Wang, L Jian-Quan. Chinese J. Anal. Chem., 2013, 41(3): 432-435
肖虎勇,陈 佳, 魏国芬, 胡芹芹, 艾永青, 韩 韵, 周兴旺,吕鉴泉. 分析化学, 2013, 41(3): 432-435
17 Tang Y, Song H, Su Y, Lv Y. Anal. Chem., 2013, 85(24): 11876-11884
18 Ocaa-Gonzlez J A, Ramos-Payn M, Fernndez-Torres R, Villar Navarro M, Bello-López M . Talanta, 2014, 122: 214-222
19 Zhao F, Zhao W, Xiong W. Luminescence, 2013, 28(2): 108-113
20 Shetti N P, Hosamani R R, Nandibewoor S T. The Open Catalysis Journal, 2009, 2(1): 130-139
21 Sivaramakrishna A, Clayton H S, Muralikrishna U. ChemInform., 2011, 42(28): doi: 10.1002/chin.201128221
22 Shi H, Guo Y, Kang W. J. Solution Chem., 2011, 40(7): 1371-1381
23 Shi H, Xu X, Ding Y, Liu S, Li L, Kang W. Anal. Biochem., 2009, 387(2): 178-183
24 Balikungeri A, Pelletier M, Monnier D. Inorg. Chim. Acta, 1977, 22(1): 7-14
25 Sun H, Chen P, Wang F, Wen H. Talanta, 2009, 79(2): 134-140
26 Liang S, Zhao L, Zhang B, Lin J. J. Phys. Chem. A, 2008, 112(4): 618-623
27 Zhao F, Zhao W, Xiong W. Luminescence, 2013, 28(2): 108-113
28 Chen P, Sun H. Drug Test. Anal., 2010, 2(1): 24-27
29 Shi H, Shen S, Sun H, Liu Z, Li L. J. Inorg. Biochem., 2007, 101(1): 165-172
