安塞油田驱油微生物多样性研究及筛选
2015-09-10杨剑李斌董小丽杨娜张蓓中国石油长庆油田分公司第一采油厂陕西延安76000中国石油长庆油田分公司技术监测中心陕西西安7008中国石油长庆油田分公司生产运行处陕西西安7008
杨剑,李斌,董小丽,杨娜,张蓓(.中国石油长庆油田分公司第一采油厂,陕西延安 76000;.中国石油长庆油田分公司技术监测中心,陕西西安 7008;.中国石油长庆油田分公司生产运行处,陕西西安 7008)
安塞油田驱油微生物多样性研究及筛选
杨剑1,李斌1,董小丽2,杨娜3,张蓓1
(1.中国石油长庆油田分公司第一采油厂,陕西延安716000;2.中国石油长庆油田分公司技术监测中心,陕西西安710018;3.中国石油长庆油田分公司生产运行处,陕西西安710018)
利用微生物及其代谢产物作用于原油提高采收率,首先必须了解油藏本源微生物种类,进行油藏微生物菌种多样性分析。提取安塞油田油水样品,进行菌种分离培养、提取和纯化DNA,设计适合的引物进行目的基因PCR扩增、高通量测序,对序列结果进行生物信息学分析,得到安塞油田驱油微生物多样性研究结果。分析认为安塞油田本源微生物种类丰富,主要是芽孢杆菌纲、梭菌纲、α-变形菌纲及γ-变形菌岗等细菌,又以芽孢杆菌岗属占优势分布。在此基础上筛选出一株产生物表面活性剂微生物,发酵液稀释30倍后与原油的界面张力仅为1.727 6 mN/m,具有较强的降低油水界面张力的能力,筛选出一株产生物聚合物微生物,发酵液中生物聚合物含量高达800 mg/L,具有较强的产生物聚合物能力。最终由这两种微生物菌种构建微生物驱油体系。
低渗透油藏;驱油微生物;分子生物学;生物表面活性剂;生物聚合物
油藏微生物菌种多样性分析目前主要采用分子生物学DNA标记方法[1]。多样性检测的分子标记主要包括:限制性片段长度多态性(RFLP)、随即扩增多态性DNA(RAPD)、DNA扩增指纹分析(DAF)、扩增片段长度多态性(AFLP)、16SrRNA基因序列分析等,目前应用较为广泛的是基于微生物16SrRNA特异性基因序列的标记技术。16SrRNA为原核生物核糖体中一种核糖体RNA,大小约1.5 kb左右。其种类少、含量大(约占细菌RNA含量的80%),分子大小适中,存在于所有的生物中,特别是其进化具有良好的时钟性质,在结构和功能上具有高度的保守性,素有“细菌化石”之称。16SrRNA既能体现不同菌属之间的差异,又能利用测序技术来较容易地得到其序列,故被微生物学家及分类学家所接受[2]。
通过从环境样品中提取和纯化DNA,设计适合的引物进行目的基因PCR扩增、测序,对序列结果进行生物信息学分析,即可得到相应的多样性分析结果。该结果对目标油藏微生物种质资源调查提供基础资料,对油藏的后期开发中有效驱油菌株的构建有指导作用。
1 试验材料及仪器
1.1试验材料
E.Z.N.A Soil DNA试剂盒(OMEGA公司)、琼脂糖凝胶、AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)、TransStart FastPfu DNA Polymerase(聚合酶)、TransGen AP221-02、Tris-HCl缓 冲 液 、EmPCR(Roche emPCRAmp-Lib_L Kit公司)。
1.2实验仪器
ABI GeneAmpR9700型PCR仪、QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)、Roche Genome Sequencer FLX+(测序系统)、mothur软件、JYW-200A 表/界面张力仪、SVT-20旋转滴界面张力仪(德国)、恒温箱。
2 试验方法及结果
2.1驱油微生物多样性研究
2.1.1基因组DNA提取采集安塞油田长6油藏油样6个,用采样容器分别取水样1 L,油样1 L(油水分离,经滤纸除杂),封口并记录井号,做好试样标记,放置于4℃的条件下保存备用。
对采样的6个样品使用OMEGA公司E.Z.N.A Soil DNA试剂盒抽提基因组DNA,采用1%琼脂糖凝胶电泳检测抽提的基因组DNA。
2.1.2引物设计按指定测序区域,合成带有“5'454 A、B接头-特异引物3'”的融合引物,A为测序端,需加标签,B端引物可共用。为保证后续数据分析的准确性及可靠性,需满足两个条件:(1)尽可能使用低循环数扩增;(2)保证每个样品扩增的循环数一致。随机选取具有代表性的样品进行预实验,确保在最低循环数中绝大多数样品能够扩增出浓度合适的产物[3]。
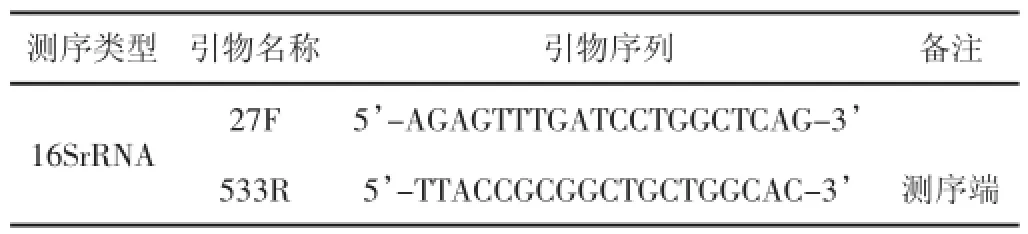
表1引物序列
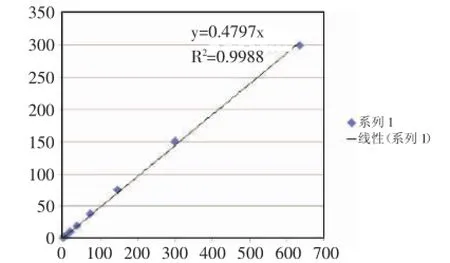
图1 荧光定量标准曲线
2.1.3PCR扩增每个样品3个重复,将同一样品混合后用2%琼脂糖凝胶电泳,使用AXYGEN公司的AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测,2 μL上样检测[4]。
2.1.4荧光定量将已构建好的PCR产物文库参照电泳初步定量结果,使用 Promega公司的QuantiFluorTM-ST蓝色荧光定量系统进行检测[5],得到标准曲线(见图1)。
6个样品待测PCR产物文库浓度较高(均高于4 ng/μL),足以满足下一步测序要求,数据(见表2)。
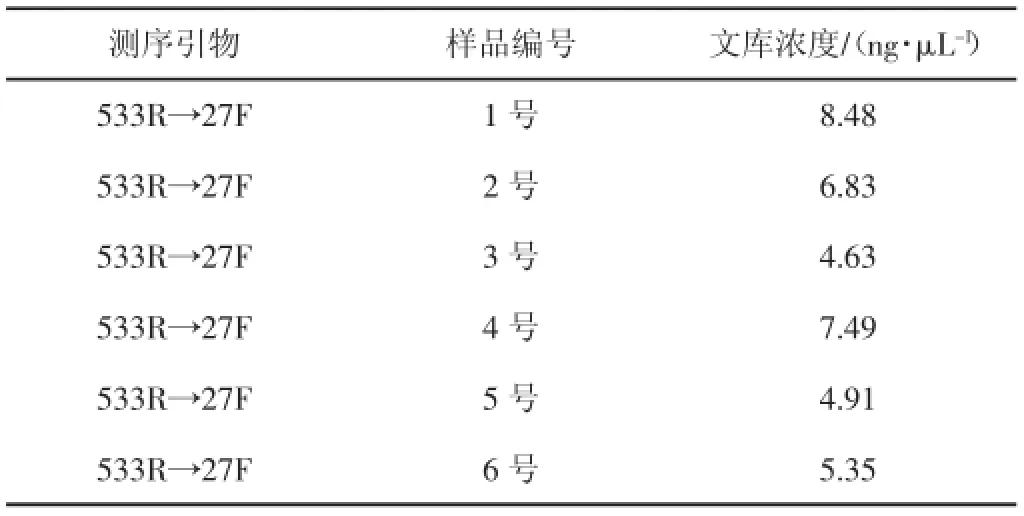
表2 PCR产物文库定量结果统计表
2.1.5测序及数据分析将每个样品的测序量比例混合,使用EmPCR产物,使用Roche Genome Sequencer FLX+上机测序。分析步骤:(1)去除序列末端的接头序列、后引物序列、多碱基N、polyA/T尾巴及低质量序列;(2)去除(1)中所得序列的条形码标签序列、前引物序列;(3)丢弃长度短于200 bp、模糊碱基数大于0、序列平均质量低于25的序列[6]。
优化后样品平均长度446 bp,数据统计结果(见表3)。
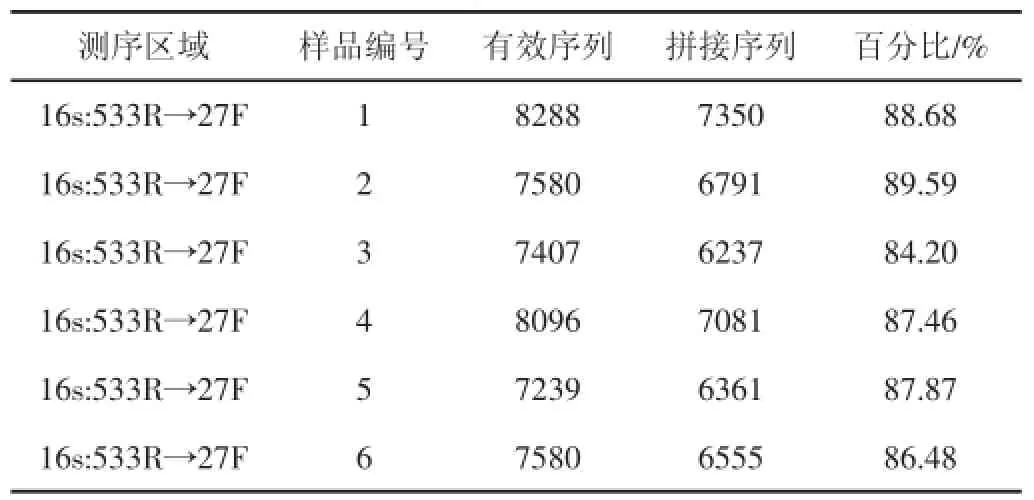
表3 有效序列数据统计

表4 样品OTU列表(部分)

表4 样品OTU列表(部分)(续表)
2.1.6多样性分析及结果采用OTU聚类分析方法[7],将所有测序结果作为OUT数,先将相似度均达到97%以上的1对序列聚为一类,即为1个OUT,名称为OTU1,再重新比较剩余序列中哪1对相似度均可以达到97%以上,将其聚为一类,命名为OTU2,如此反复计算,直至完成所有分析。此次分析应用mothur软件进行。
6个样品共计聚类得到1 050个OTU,各OTU中每个样品丰度不一,数据(见表4)。其中样品中含量最丰富的是芽孢杆菌纲细菌,其次是梭菌纲、α-变形菌纲和γ-变形菌纲细菌;主要菌属为芽孢杆菌属、乳酸球菌属、环丝菌属、假黄色单胞菌属、色盐杆菌属等(见表4)。
2.2驱油微生物筛选
微生物增产和作用于原油非常复杂,一般有多种生物化学过程相互作用。微生物在油藏中的作用有:微生物本身聚集或生成生物聚合物堵塞高渗透透层并改变水驱方向;生成表面活性剂,增加残余油流动力;产生CO2或甲烷,增加气体压力;消化大分子,降低原油黏度等[8]。
2.2.1产生物表面活性剂微生物筛选采用稀释分离法[9]将油井采出水进行梯度稀释后,取菌液涂平板,将混杂的菌种在琼脂平板表面上分散,培养获得单菌落。利用产生物表面活性剂的微生物具有溶血的特性,在血平板上形成透明圈,以此现象初步筛选出产表面活性剂的驱油菌株DN001、DN005、DN035,溶血圈直径分别为4.1 mm、3.3 mm和3.5 mm。将三种微生物菌株分别接种到200 mL液体摇瓶培养基中,150 r/min、37℃条件下摇床培养48 h,用SVT-20旋转滴界面张力仪对安塞油田地层水、培养基、三株微生物稀释的发酵液进行界面张力测定,数据(见表5)。
安塞油田原油与地层水界面张力为11.423 2 mN/m, 30倍稀释的DN001菌株发酵液与原油的界面张力为1.727 6 mN/m,说明DN001菌株发酵液具有较强的降低油水界面张力的能力,产表面活性剂性能最好(见图2)。

表5 油水界面张力的测定

图2 DN001菌株发酵液界面张力测定
采用液相色谱、液质分析方法对发酵液中的代谢产物的种类进行鉴定,主要次级代谢产物是鼠李糖脂和脂肽,属于糖脂类和脂肽类生物表面活性剂(见图3,图4)。
2.2.2产生物聚合物微生物筛选采取稀释分离法获得微生物单菌落,进行菌种纯化,初步分离筛选20株微生物,按3%比例接入发酵培养基(葡萄糖培养基不加琼脂),150 r/min,37℃摇床培养72 h,测定发酵液粘度。菌株DN002、DN016、DN022和DN034的发酵液粘度较高均在15 mPa·s以上,初步选择这四株菌进行后续试验。
用安塞油田地层水配制摇瓶发酵培养基,将上述4种微生物菌株3%的比例分别接种到培养基中,模拟油田地层温度,在45℃,150 r/min的条件下,摇床振荡培养。每隔8 h测定菌液浓度,绘制生长曲线,测定发酵液粘度,优选出产生生物聚合物的最佳菌株(见图5,图6)。

图5 菌株生长曲线对比

图6 发酵液粘度随时间变
由图5,图6可知,菌株DN002培养8 h即进入对数生长期,24 h后进入稳定期,而且稳定期长达24 h,产生的菌浓度最高,培养32 h时最大菌浓为6.5×108个/毫升。菌株DN016和DN034的菌浓度也相对较高,但稳定期相对较短。4种发酵液粘度达到最大值之后,均能稳定保持。其中菌株DN002在32 h即可达到最大粘度值26 mPa·s,32 h~72 h粘度值变化不大。而其它三种微生物的最大粘度值均小于DN002,且在达到最大粘度值后都有所降低。因此,综合菌种浓度和发酵液粘度两项因素,确定选择DN002作为用来产生生物聚合物的目的菌。
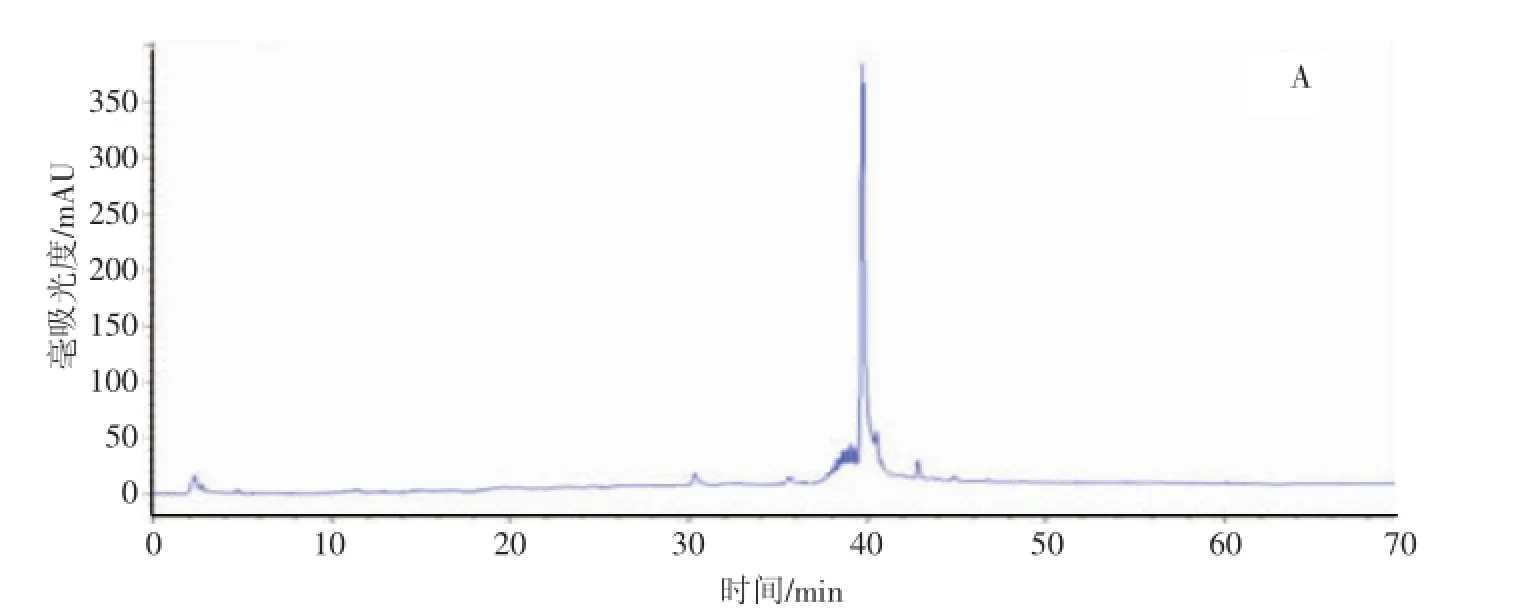
图3 DN001发酵液液相色谱254 nm测定结果
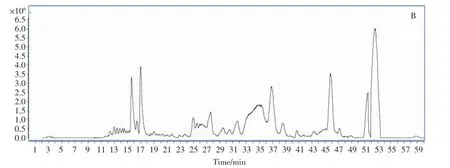
图4 DN001发酵液液质鉴定结果
对DN002菌株接种于发酵液体培养基中,置于45℃、150 r/min培养箱中振荡培养,5 d后对其产生聚合物进行分析测定。将培养后的培养液离心(8 000 r/min~9 000 r/min,30 min),用移液管吸取上清液,用5倍体积95%的酒精沉淀生物聚合物,收集生物聚合物并用95%的酒精洗涤,50℃恒温烘箱中烘干后称重,经检测生物聚合物含量为800 mg/L。
2.2.3微生物分子生物学检测对筛选出来的两种菌株进行分子生物学16SrRNA检测。通过PCR扩增得到目的基因片段,经测序为1 500 bp左右的16SrRNA部分序列,利用GenBank Blast在线比对进行序列同源性比较,结果显示菌株DN001的16SrRNA序列与多株假单胞菌具有高度同源性,菌株DN002和CYR602与枯草芽孢杆菌有高度同源性。通过Clustal X进行聚类分析后,利用MEGA4.1软件生成系统发育进化树(见图7,图8)。
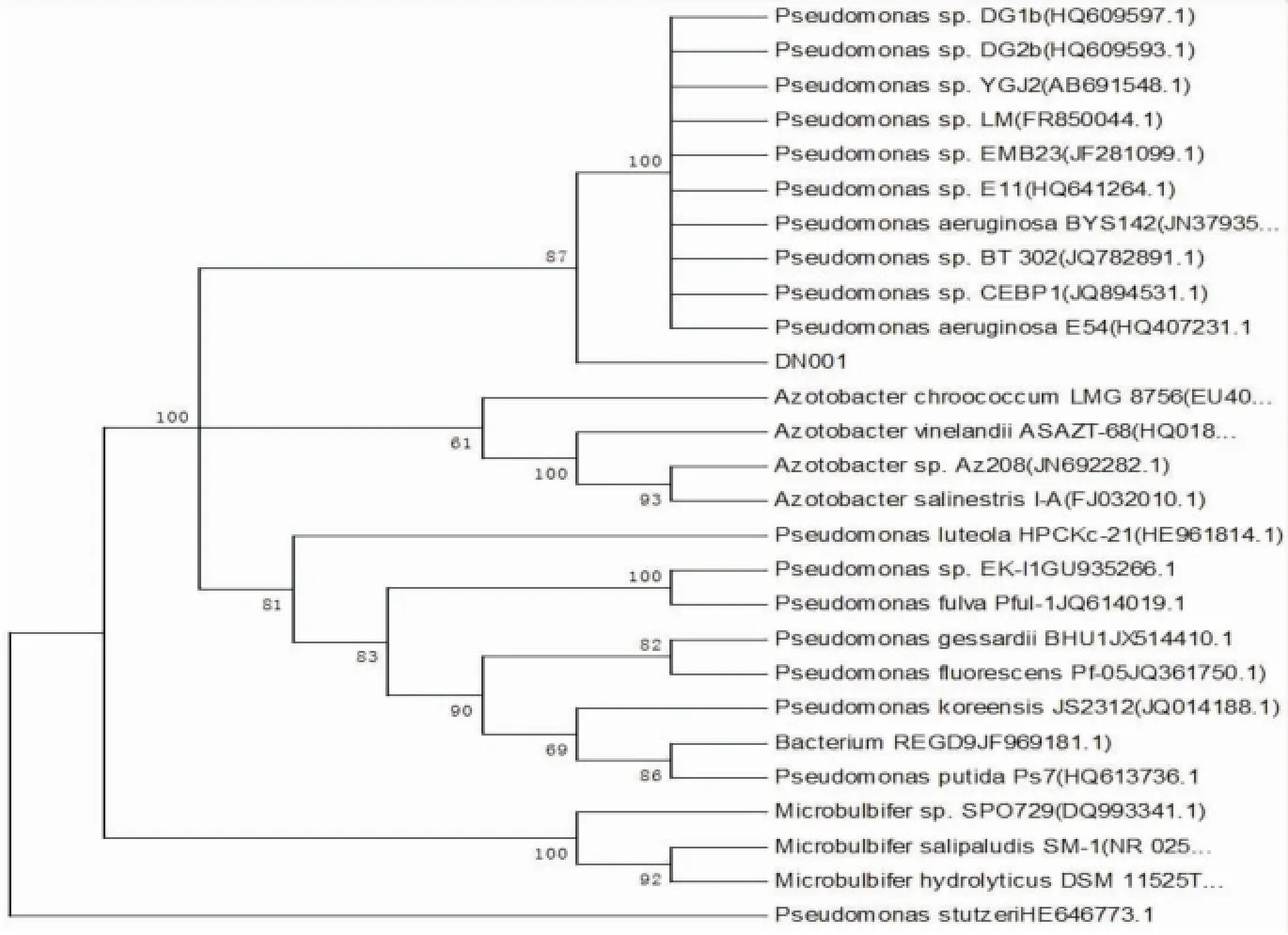
图7 DN001菌株的系统进化树

图8 DN002菌株的系统进化树
3 结论
(1)安塞油田本源微生物种类丰富,6个样品中均检测到了大量种属的本源微生物。其中1号样微生物种类最多,含有4个菌纲6 992种微生物;6号样微生物种类最少,有11个菌纲4 589种微生物。本源微生物以芽孢杆菌纲占绝对优势,1号样中芽孢杆菌纲微生物高达6 985种,3号样中芽孢杆菌纲微生物最少有3 019种,分别占到了总菌属的99.9%和61.8%。在两个样品的属种分布中,又以芽孢杆菌属占优势分布,分别占到了94.22%和31.34%。
(2)对微生物稀释、分离、纯化,筛选出产生物表面活性剂微生物DN001,属于假单胞菌,发酵液稀释30倍与原油的界面张力仅为1.727 6 mN/m,具有较强的降低油水界面张力的能力。微生物DN002属于枯草芽孢杆菌,具有较强的产生物聚合物能力,发酵液中生物聚合物含量高达800 mg/L,且该微生物生长能力较强,培养8 h即进入对数生长期,快速繁殖,24 h后进入稳定期,而且稳定期长达24 h,产生的菌浓度最高为6.5× 108个/毫升。
[1]夏北成,Zhou J Z,T ied je J M.分子生物学方法在微生物形态中的应用[J].中山大学学报,1998,37(2):97-101.
[2]刘文强,贾玉萍,赵宏坤,等.16SrRNA在细菌分类鉴定研究中的应用[J].动物医学进展,2006,27(11):15-18.
[3]尤超,赵大球,梁乘榜,等.PCR引物设计方法综述[J].现代农业科技,2011,14(17):48-51.
[4]魏鑫丽,魏江春.用于PCR扩增的DNA简易制备法现状[J].菌物研究,2003,1(1):52-54.
[5]刘渠,李涌,陈应坚,等.大肠杆菌荧光定量PCR方法和多管发酵法检测结果相关性研究[A].张云.2011广东省预防医学会学术年会资料汇编[C].广东省广州市:广东省预防医学会,2011:353-358.
[6]黄勇.基于高通量测序的微生物基因组学研究[D].北京:中国人民解放军军事医学院档案馆,2013.
[7]王珊珊,江洁曙,方晶晶,等.25株泛耐药绿铜假单胞菌耐药与毒素基因的样本聚类分析[A].张云.中华医学会第一届重症心脏全国学术大会暨第二届西湖重症医学论坛、2013年浙江省重症医学学术年会论文汇编[C].浙江省杭州市:浙江省医学会重症医学分会,2013:524-531.
[8]王小林,王学刚,马翠岩,等.微生物驱油技术综述[J].国外油田工程,2007,23(3):5-8.
[9]张轶华.稀释分离法鉴定嗜鳍黄杆菌[J].鞍山师范学院学报,2010,12(2):43-47.
Flooding microbial diversity research and screening of Ansai oilfield
YANG Jian1,LI Bin1,DONG Xiaoli2,YANG Na3,ZHANG Bei1
(1.Oil Production Plant 1 of PetroChina Changqing Oilfield Company,Yan'an Shanxi 716000,China;2.Technical Testing Center of PetroChina Changqing Oilfield Company,Xi'an Shanxi 710018,China;3.Product Managment Department of PetroChina Changqing Oilfield Company,Xi'an Shanxi 710018,China)
Using microorganisms and their metabolic products to improve recovery of crude oil,firstly understand reservoir source of microbial species,analysis of oil reservoir microbial species diversity.Extracting oil and water samples of Ansai oilfield,separating strains of cultivation,extracting and purificating of DNA,designing a suitable primers for PCR amplification,sequencing high-throughput gene,analysising the sequence result of bioinformatics,ansai oilfield flooding microbial diversity research results of Ansai oilfield are obtained.Ansai oilfield source microorganism is variety,mainly bacillus classes is clostridium,alpha deformation and gamma phylum bacteria such as and belong to the dominant distribution with bacillus hillock.On the basis of the screened strains produce surfactants microorganisms,fermented liquid and interfacial tension of crude oil after 30 times dilution was only 1.727 6 mN/m,hasstrong ability to reduce the oil-water interfacial tension,and screened strains produce polymer microorganisms,biological polymer content in the fermented liquid is as high as 800 mg/L,has the strong ability of producing polymer content.Finally by the two strains build microbial oil displacement system.
low permeability;displacement of microbial;molecular biology;biosurfactant;biopolymers
10.3969/j.issn.1673-5285.2015.01.005
TE357.46
A
1673-5285(2015)01-0016-07
2014-10-10
杨剑,女(1983-),采油工程师,2013年硕士毕业于中国石油大学(北京)石油与天然气专业,现从事油田提高采收率工作,邮箱:yjian2_cq@petrochina.com.cn。
