玉米大斑病菌黑色素合成还原酶基因酵母单杂交报告载体的构建
2015-09-09贾慧郭丽婕孟庆江等
贾慧 郭丽婕 孟庆江等
摘要:根据玉米大斑病菌(Setosphaeria turcica)黑色素合成还原酶基因St3HNR、St4HNR 5′端侧翼序列和酵母单杂交报告载体pHIS2.1多克隆位点,设计了带有限制性内切酶位点的特异性引物,并以玉米大斑病菌01-23菌株基因组DNA为模板,PCR扩增启动子区域长度约1 000 bp的片段,双酶切目的片段及载体pHIS2.1回收并连接,构建2个还原酶基因的酵母单杂交报告载体。结果表明,克隆到启动子区域长度为998 bp核酸片段,经PCR检测、测序、酶切鉴定,2个还原酶基因的酵母单杂交报告载体构建成功,为进一步研究还原酶与转录因子互作关系及明确黑素素合成调控机制奠定了基础。
关键词:玉米大斑病菌(Setosphaeria turcica);黑色素;酵母单杂交报告载体
中图分类号:Q78 文献标识码:A 文章编号:0439-8114(2015)14-3542-04
DOI:10.14088/j.cnki.issn0439-8114.2015.14.053
Construction of Report Vectors of Melanin HNreductase Gene of
Setosphaeria turcica in Yeast One-hybrid
JIA Hui, GUO Li-jie, MENG Qing-jiang, CAO Zhi-yan, SONG Ya-feng
(College of Life Science, Agriculture University of Hebei/Hebei Key Laboratory of Physiological and Molecular Plant Pathology,
Baoding 071000, Hebei, China)
Abstract: According to the restriction enzyme sites of melanin biosynthesis promoter region of reductase gene St3HNR, St4HNR and reporter vector pHIS2.1 of Setosphaeria turcica, two pairs of primers containing restriction enzyme sites were designed, the fragment length about 1 000 bp obtained by PCR using genomic DNA of S.turcica 01-23 strain as templet, and double digested by the corresponding restricted enzymes respectively, recycled and connected, constructed the yeast one-hybrid reporter vector of reductase gene. The results showed that the fragment length of two genes were both 998 bp, vectors were successfully constructed by PCR, sequencing, restriction enzyme digestion, and lay the foundation for the study of the transcription factor.
Key words: Setosphaeria turcica; melanin; report vectors of the yeast one-hybrid system
玉米大斑病是玉米(Zea mays L.)的重要葉部病害,病斑呈梭形,直接影响玉米的产量和品质,造成严重的经济损失[1]。玉米大斑病菌(Setosphaeria turcica)是引起玉米大斑病的一种丝状病原真菌,在其侵入寄主过程中,主要依靠附着胞产生机械压力穿透植物表皮细胞[2,3]。成熟的附着胞内沉积着一层黑色素,黑色素是由病菌产生的一种非均质的不溶于水的无定形小颗粒状类多酚聚合体,其作为重要的毒力因子,在维持附着胞内机械压力方面起着重要的作用。玉米大斑病菌能够代谢DHN黑色素,其在病菌附着胞壁上的沉积,保证了病菌能够产生足够的膨胀压力而穿透寄主组织致病[4]。对不同病原真菌中DHN黑色素合成途径的研究结果表明,DHN黑色素合成途径起始于聚酮体合成酶(Polyketide synthase),其后经2个还原酶(HNreductase)、2个脱水酶(Scytalone dehydratase)和1个氧化酶(Laccases)催化聚合而形成黑色素,另外还存在一个调控黑色素生物合成的转录因子(MR)[5]。在玉米小斑病菌(Helminthosporium maydis)、水稻胡麻斑病菌(Bipolaris oryzae)中均存在该转录因子,其对黑色素合成酶基因的转录具有调控作用[6,7]。河北农业大学真菌霉系与植物病理学实验室根据其他真菌中已知DHN黑色素调控基因设计引物获得StMR1基因片段,并通过RACE(Rapid amplification of cDNA ends)技术得到该基因全长。
研究蛋白质与DNA互作的方法很多,包括DNA蛋白质印迹杂交、凝胶阻滞电泳、DNasel足迹法、DNA与蛋白质复合体的电镜观察、紫外交联法、体内交联与免疫沉淀相结合等[8]。酵母单杂交体系(Yeast one-hybrid system)是一种识别稳定结合于DNA上的蛋白质的研究技术,它是根据DNA结合蛋白(即转录因子)与DNA顺式作用元件结合调控报告基因表达的原理来研究目的转录因子与基因(DNA或cDNA)互作的体系,该方法也是在细胞内分析鉴定转录因子与顺式作用元件结合的有效方法[9,10]。真核生物中各种转录因子在转录水平的调控是基因表达调控的主要方式。典型的转录因子都有DNA结合区与转录激活区(或抑制区),在特定的时间、部位或特定条件(如胁迫条件)下,特定的转录因子与靶基因启动子的顺式作用元件特异性结合并相互作用,就可以激活或抑制靶基因的表达[11]。要阐明细胞内各种信号转导与基因表达的机制,以及细胞对外界环境刺激引起的一系列信号传递与应答基因表达调控等机理,鉴定各种调控基因表达的顺式作用元件和转录因子至关重要。本研究构建了玉米大斑病菌黑色素合成还原酶基因St3HNR、St4HNR启动子区酵母单杂交报告载体,为探究转录因子StMR1和还原酶基因St3HNR、St4HNR的作用机制奠定基础。
1 材料与方法
1.1 材料
玉米大斑病菌菌株01-23、大肠杆菌(Eschrichia coli)DH5α感受态细胞、SDS碱裂解溶液由河北农业大学真菌毒素与植物分子病理学实验室保存或制备,pHIS2.1载体由河北农业大学生命科学学院张彩英教授惠赠;质粒提取试剂盒、凝胶回收试剂盒、Taq DNA聚合酶、dNTPs、限制性内切酶、T4 DNA连接酶、pMD?誖19-T Simple Vector购自宝生物工程(大连)有限公司;引物合成与序列测定由生物工程技术(上海)有限公司完成。
1.2 方法
1.2.1 PCR扩增 根据St3HNR、St4HNR启动子区的基因序列和载体pHIS2.1上的多克隆位点分别设计一对引物,并分别添加Sac I、Spe I和EcoR I、Spe I酶切位点,引物序列见表1。采用CTAB法提取玉米大斑病菌01-23菌株基因组DNA[12],用于PCR反应模板,扩增体系为DNA 2 μL,10×Taq Buffer(Mg2+)2.5 μL,dNTPs(2.5 mmol/L)2 μL, Taq DNA聚合酶(5 U/μL)0.3 μL,3HPF(4HNF)(10 μmol/L)1.0 μL,3HPR(4HPR)(10 μmol/L)1.0 μL,加ddH2O至25 μL。PCR扩增程序为95 ℃预变性 5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR扩增产物用1.5%琼脂糖凝胶电泳检测,用紫外凝胶成像仪(Bio-Rad)观察结果,凝胶回收试剂盒回收扩增产物。
1.2.2 St3HNR、St4HNR基因启动子区的克隆 将凝胶回收的目的基因片段与pMD?誖19-T Simple Vector 16 ℃连接30 min或过夜。连接产物转化大肠杆菌DH5α感受态细胞,随机挑取白色单菌落于3 mL含100 μg/mL Amp+ 的LB液体培养基中,37 ℃下220 r/min 振荡培养过夜。取2 μL菌液作为模板,利用pMD19-T Simple载体克隆载体上的通用引物M13+和M13-进行PCR检测。选取PCR检测阳性的单克隆测序,将测序正确的阳性克隆分别命名为pMD19-3HNRP、pMD19-4HNRP。
1.2.3 酵母单杂交报告载体的构建 采用SDS碱裂解法制备质粒DNA。将质粒pMD19-3HNRP、pMD19-4HNRP以及pHIS2.1载体分别进行雙酶切,电泳检测并回收酶切目的片段进行连接反应,连接完毕后转化大肠杆菌感受态细胞,提取阳性克隆质粒酶切验证,构建完成St3HNR、St4HNR基因启动子酵母单杂交的报告载体pHIS-3HNRP、pHIS-4HNRP。
2 结果与分析
2.1 St3HNR、St4HNR基因启动子片段的扩增
分析St3HNR、St4HNR基因启动子区序列的酶切位点,结合酵母单杂交报告载体质粒pHIS2.1上的多克隆位点,分别选用限制性内切酶Sac I、EcoR I和Spe I,设计2对带有酶切位点的特异引物扩增目的片段,分别得到998 bp两条条带,与预期大小相符(图1)。
2.2 St3HNR、St4HNR基因启动子的克隆
回收纯化片段并与pMD?誖19-T Simple Vector连接,转化大肠杆菌感受态细胞,转化后选择单克隆进行菌液检测,引物用载体通用引物M13/M17和特异引物3HPF/3HPR和4HNF/4HNR进行PCR扩增(图2)。选取PCR鉴定为阳性的克隆送生工生物工程技术(上海)有限公司测序,并命名为pMD19-3HNRP、pMD19-4HNRP。
2.3 pMD19-3HNRP、pMD19-4HNRP的酶切鉴定
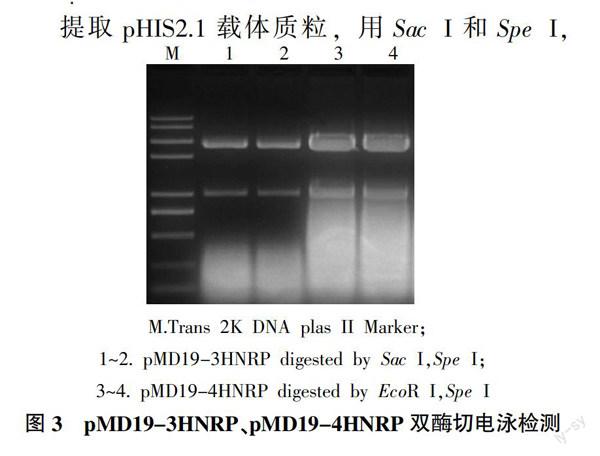
将与pMD?誖19-T Simple Vector载体连接并且测序正确的单克隆pMD19-3HNRP、pMD19-4HNRP分别用Sac I和Spe I,EcoR I和Spe I进行双酶切验证,均得到预期大小的目的条带(图3),成功克隆得到St3HNR、St4HNR基因启动子。
2.4 pHIS2.1载体酶切鉴定
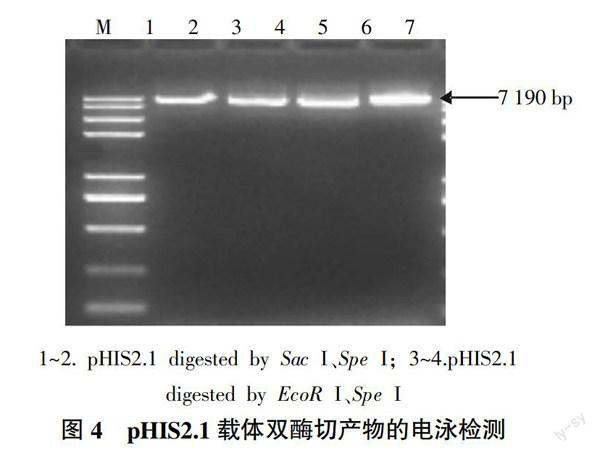
提取pHIS2.1载体质粒,用Sac I和Spe I,EcoR I和Spe I进行双酶切并回收,得到7 190 bp大小的片段,所得片段与预期结果一致(图4)。
2.5 St3HNR、St4HNR基因启动子酵母单杂交报告载体的构建
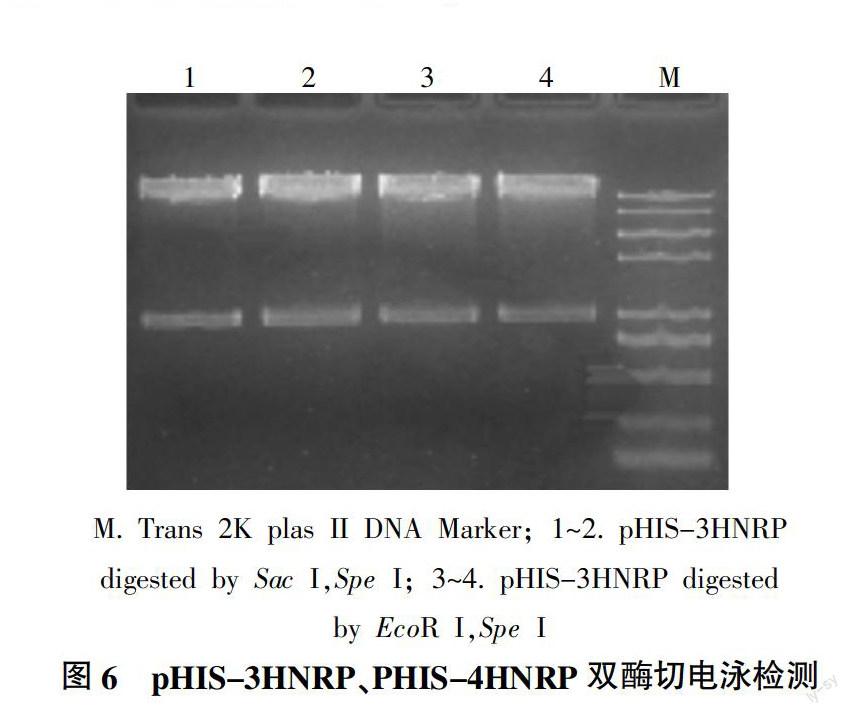
将pMD19-3HNRP和pHIS2.1质粒载体分别用Sac I、Spe I进行双酶切,回收目的片段后将带有相同黏性末端的3HNRP和线性的pHIS2.1连接,得到pHIS-3HNRP重组载体。将pMD19-4HNRP与pHIS2.1分别用EcoR I、Spe I进行双酶切,回收纯化目的片段后再连接,得到pHIS-4HNRP重组载体。pHIS-3HNRP、pHIS-4HNRP重组载体全长约8 200 bp,Sac I与Spe I双酶切得到大小为7 190 bp和998 bp的条带,EcoR I与Spe I酶切得到大小为7 190 bp和998 bp条带,结果均与预期大小相符(图6),玉米大斑病菌黑色素还原酶基因启动子的酵母单杂交载体构建成功。
3 小结与讨论
目前,在研究DNA-蛋白质相互作用中,酵母单杂交体系主要有以下3种用途:①确定已知DNA-蛋白质之间是否存在相互作用;②分离编码结合于目的顺式调控元件或其他短DNA结合位点蛋白的新基因;③定位已经证实的具有相互作用的DNA结合蛋白的DNA结合结构域以及准确定位与DNA结合的核苷酸序列[13]。应用酵母单杂交体系已经识别并验证了许多与目的DNA序列结合的蛋白质。
StMR1基因是DHN黑色素合成途径中的具有转录调控作用的转录因子,St3HNR、St4HNR基因是该途径中编码还原酶的基因。据报道,瓜类炭疽病菌、玉米小斑病菌中调控基因CMR1的转录产物直接或间接作用于还原酶基因,影响其表达,进而影响黑色素的合成[5,6]。本试验构建了玉米大斑病菌黑色素合成还原酶基因St3HNR和St4HNR的酵母单杂交报告载体,为其研究调控基因的互作机制奠定了基础。
参考文献:
[1] 郭丽媛,贾 慧,曹志艳,等.玉米大斑病菌有性杂交后代的交配型与寄生适合度分化[J].中国农业科学,2013,46(19):4058-4065.
[2] 王晓鸣,晋齐鸣,石 洁,等.玉米病害发生现状与推广品种抗性对未来病害发展的影响[J].植物病理学报,2006,36(1):1-11.
[3] 范永山,谷守芹,董金皋,等.MAPK途径对玉米大斑病菌HT-毒素产生和生物学活性的调控作用[J].中国农业科学,2008,41(1): 86-92.
[4] XUE C S,WU D L,CONDON B J,et al. Efficient gene knockout in the maize pathogen Setosphaeria turcica using Agrobacterium tumefaciens-mediated transformation[J]. The American Phytopathological Society, 2013, 103:641-647.
[5] TSUJI G,KENMOCHI Y,TAKANO Y,et al.Novel fungal transcriptional activators,Cmr1p of Colletotrichum lagenarium and Pig1p of Magnaporthe grisea,contain Cys2His2 zinc finger and Zn(II)2Cys6 binuclear cluster DNA-binding motifs and regulate transcription of melanin biosynthesis genes in a developmentally specific manner[J]. Molecular Microbiology,2000,38(5): 940-954.
[6] ELIAHU N, IGBARIA A. Melanin biosynthesis in the maize pathogen Cochliobolus heterostrophus depends on two mitogen-activated protein Kinases, Chk1 and Mps1, and the transcription factor Cmr1[J]. Eukaryotic Cell, 2007, 6(3): 421-429.
[7] KIHARA J, MORIWAKI A, TANAKA N, et al. Characterization of the BMR1 gene encoding a transcription factor for melanin biosynthesis genes in the phytopathogenic fungus Bipolaris oryzae[J]. FEMS Microbiology Letters, 2008, 281:221-227.
[8] 李英賢,贺福初.DNA与蛋白质相互作用研究方法[J].生命的化学,2003,23(4):306-308.
[9] 廖名湘,方福德.酵母单杂交体系——一种研究DNA-蛋白质相互作用的有效方法[J].中国医学科学院学报,2000,22(4): 379-391.
[10] REECE-HOYES J,WALHOUT A J. Yeast one-hybrid assays: A historical and technical perspective[J].Methods,2012,57(4): 441-447.
[11] SIMON A, DALMAIS B, MORGANT G, et al. Screening of a Botrytis cinerea one-hybrid library reveals a Cys2His2 transcription factor involved in the regulation of secondary metabolism gene clusters[J]. Fungal Genetics and Biology, 2013,52:9-19.
[12] 安鑫龙,董金皋,韩建民.应用CTAB法提取玉米大斑病菌DNA[J].河北农业大学学报,2001,24(1):38-41.
[13] 陈 峰,李 洁,张贵友,等.酵母单杂交的原理及应用实例[J].生物工程进展,2001,21(4):57-61.
