超声波破碎发酵性丝孢酵母提取蛋白酶条件的研究
2015-09-08李英张晓锋候英敏孙玉梅
李英,张晓锋,候英敏,孙玉梅
超声波破碎发酵性丝孢酵母提取蛋白酶条件的研究
李英,张晓锋,候英敏,孙玉梅
(大连工业大学生物工程学院,辽宁大连116034)
发酵性丝孢酵母(Trichosporon fermentans)所产蛋白酶为胞内酶,要提取蛋白酶需对细胞进行破碎。利用超声波破碎发酵性丝孢酵母细胞,研究超声波工作条件对提取蛋白酶活性的影响。通过单因素试验和正交试验,确定提取蛋白酶的适宜条件为输出功率550 W、工作总时间13 min、超声波每次辐射时间7 s(间歇时间5 s)、每克细胞缓冲液加入量20 mL,在此条件下提取的蛋白酶活力达到393.78 U·g-1。
发酵性丝孢酵母;蛋白酶;超声波;细胞破碎
0 引言
破碎细胞是提取胞内产物的必需途径,常用的细胞破碎方法有高压匀浆法、高速珠磨法、超声破碎、化学渗透法、酶溶法。其中,超声波破碎法具有省时高效、操作简单、液量损失小、无污染等优点,但超声波在细胞破碎过程中产生的化学自由基团可以使一些敏感的活性物质失活[1,2]。因此,研究最佳的超声波破碎条件对提取胞内活性物质具有重要意义。目前,研究超声波破碎酵母细胞的最佳条件多为:输出功率500~600 W,工作总时间5~20 min,每次辐射时间3~6 s,间歇时间2~5 s[3-6]。
发酵性丝孢酵母能合成脂肪酶、蛋白酶等多种酶,而蛋白酶的生成会影响脂肪酶的生物合成和生物催化活性。本研究采用超声波法破碎发酵性丝孢酵母,通过单因素试验和正交试验测定超声波输出功率、工作总时间、每次辐射时间以及细胞缓冲液加入量对提取蛋白酶活性的影响,研究超声波破碎发酵性丝孢酵母提取蛋白酶的最佳工作条件,为发酵性丝孢酵母蛋白酶的后续研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种
发酵性丝孢酵母(Trichosporon fermentans):CICC1368,购自中国食品发酵工业研究院。
1.1.2 培养基
固体斜面培养基(g/L):葡萄糖20,酵母浸粉10,蛋白胨10,琼脂20,pH自然,1.0×105Pa下灭菌15 min。
液体种子培养基(g/L):葡萄糖100,蛋白胨5.3,酵母膏2.0,尿素2.0,MgSO40.5,pH自然,0.5×105Pa下灭菌15 min。
发酵培养基(g/L):葡萄糖100,蛋白胨1.8,酵母膏0.5,KH2PO42,植物油10 mL,吐温80 5 mL,pH自然,0.8×105Pa下灭菌20 min。
1.1.3 试剂与仪器
试剂各种试剂均为市售化学纯或分析纯的化学试剂以及生物试剂。
仪器JY98-ШN超声波细胞破碎机,宁波新芝生物科技股份有限公司;501型超级恒温器,上海试验仪器厂;722S可见分光光度计,上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 培养方法
菌种活化培养:将4 °C保存的酵母菌种接于固体斜面培养基上,于30 °C培养48 h。
液体种子培养:将活化菌种接入液体种子培养基中,于30 °C、160 r/min摇床培养24 h。
发酵培养:将种子液接入发酵培养基中,接种量10%,于30 °C、160 r/min摇床培养60 h。
1.2.2 发酵液和细胞的处理
发酵液于4 °C、10000 r/min离心10 min,收集菌体沉淀。用pH 6.8的磷酸盐缓冲液将菌体重悬,再次离心,重复三次。最后再用磷酸盐缓冲液悬浮菌体细胞,使菌体沉淀(g)与缓冲液体积(mL)之比为1: 20制得细胞悬浮液。
超声波处理细胞:取20 mL上述细胞悬浮液,在超声波功率400 W、总时间5 min、工作时间6 s、时间间隔5 s 的条件下,于冰浴中进行破碎处理,得到的细胞破碎液于4 ℃、10000 r/min离心10 min,每个实验平行做三次,得到的上清液即为粗蛋白酶液。
1.2.3 蛋白酶活力的测定
采用福林法[7]测定蛋白酶活力。分别测定发酵上清液、破碎细胞悬浮液、细胞破碎液及蛋白酶粗酶液的蛋白酶活力。
蛋白酶活力定义:在40 ℃、pH 7.2 的条件下,1 g菌体制备的蛋白酶粗酶液每分钟催化酪蛋白产生1 μg酪氨酸定义为一个活力单位。
2 实验结果与分析
2.1 发酵性丝孢酵母蛋白酶存在位置的确定
发酵液和细胞组分的蛋白酶活力如表1所示。由表1可知,发酵上清液无蛋白酶活力,可以推断发酵性丝孢酵母所产蛋白酶不是分泌的胞外酶。根据破碎细胞悬浮液无酶活而超声破碎后的细胞破碎液具有较高酶活力,可以推断发酵性丝孢酵母所产蛋白酶不在细胞外壁,为胞内酶。

表1 发酵液和细胞组分的蛋白酶活力
2.2 超声波输出功率对蛋白酶活力的影响
在超声波每次辐射时间为6 s、间隙时间为5 s以及超声波处理总时间为5 min的条件下,研究超声波输出功率对蛋白酶活性的影响,结果见图1。由图1可知,超声波功率为200~500 W时蛋白酶活力随着超声波输出功率的增加而逐渐增大。这是由于输出功率的增加使液体中形成较多的空穴,进而产生更多的空化泡,使破碎作用增强。400~600 W时超声波输出功率的增加对蛋白酶活力影响不大。选择蛋白酶活力最高的超声波输出功率500 W为适宜的输出功率。这与卢群[6]等人的研究结果相似。
2.3 超声波处理总时间对蛋白酶活力的影响
在超声波输出功率为500 W、间隙时间为5 s以及超声波每次辐射时间为6 s的条件下,研究超声波处理总时间对蛋白酶活性的影响,结果见图2。由图2可知,超声波处理总时间为2~15 min时,蛋白酶活力随着超声波处理总时间的延长而增大。超声波处理总时间为15 min时蛋白酶活力达到最大,超过20 min时,蛋白酶活力迅速下降,是由于超声波破碎细胞过程中处理液局部有一定升温,导致酶液失活。超声波处理总时间延长至10 min后,蛋白酶活力增加的幅度已不太明显,考虑到经济性,选择超声波处理总时间为10 min。
在高功率的超声波处理10~20 min的过程中,发酵性丝孢酵母蛋白酶表现出较好的稳定性。研究发现胰蛋白酶在超声波介质(200 W)中水解酪蛋白可获得较高的水解率[8]。因此,发酵性丝孢酵母蛋白酶在超声波反应介质中的应用值得深入研究。
2.4 超声波辐射时间对蛋白酶活力的影响
在超声波输出功率为500 W、间隙时间为5 s以及超声波处理总时间为10 min的条件下,研究超声波每次辐射时间对蛋白酶活性的影响,结果见图3。由图 3 可知,每次辐射时间低于6 s时,蛋白酶活力明显下降,是由于辐射时间太短,空化效应起不到爆裂破壁的效果[9]。超声波辐射时间高于8 s时,蛋白酶活力迅速下降,因较长时间的超声波辐射使得细胞破碎液局部产生大量热量,导致酶液失活。选择蛋白酶活力最高的超声辐射时间6 s为适宜的超声波辐射时间。
2.5 细胞缓冲液加入量对蛋白酶活力的影响
称取5份湿菌体,用磷酸盐缓冲液(pH 6.8)悬浮细胞,制成细胞悬浮液,使每克细胞缓冲液的加入量分别为10、20、30、40、50 mL。在超声波输出功率500 W、超声辐射时间6 s、间隙时间5 s以及超声处理总时间10 min的条件下,研究细胞缓冲液加入量对蛋白酶活性的影响,结果见图4。由图4可知,随细胞缓冲液加入量的增加,蛋白酶活力呈先升高后降低的趋势。每克细胞缓冲液加入量为20 mL·g-1时蛋白酶活力最大。超声波在水中传递时能量损失较大,较低的细胞浓度不利于超声波能量的传输,进而影响细胞破碎效果;而在细胞浓度过高时,细胞破碎液粘稠不利于空化泡形成、膨胀和爆炸,导致细胞破碎效果较差[9]。因此选择每克细胞缓冲液加入量为20 mL·g-1。
2.6 超声波处理条件正交试验
根据上述单因素试验结果,以蛋白酶活力为考察指标,采用L9(34)正交表进行正交试验。因素水平设计见表2,正交试验设计与结果见表3,方差分析结果见表 4。由表4可知,各因素对酶活的影响顺序为:D输出功率>A细胞的缓冲液加入量>B超声波处理总时间>C超声波辐射的时间,综合表3的k值选择细胞破碎工艺参数为D2A2B2C3,即输出功率为550 W、超声波工作总时间为13 min、每克细胞的缓冲液加入量为20 mL及超声波每次辐射时间为7 s(间歇时间5 s)。
按正交试验确定的细胞破碎最佳工艺条件D2A2B2C3,以蛋白酶活性为指标进行验证试验。在此条件破碎细胞三次并测定蛋白酶活力,所得蛋白酶活力平均值为393.78 U·g-1,高于正交试验的蛋白酶活力最大值375.86 U·g-1。所以认为正交实验得出的最优水平是可靠的。
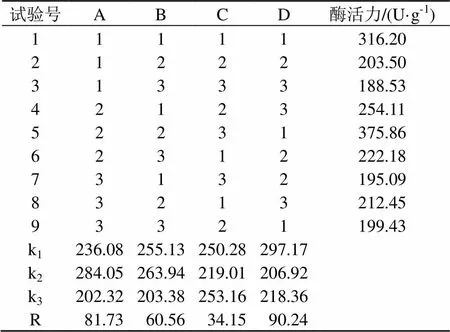
表3 正交试验设计与结果
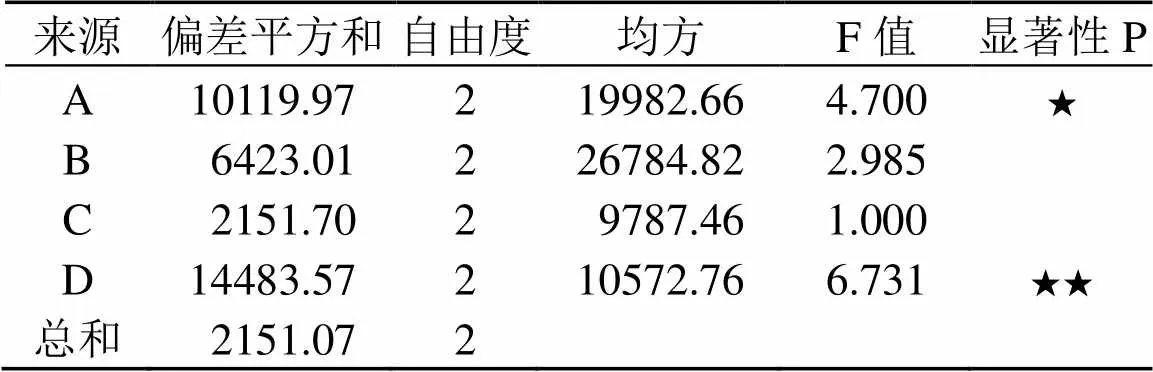
表4 方差分析
3 结论
发酵性丝孢酵母所产蛋白酶为胞内酶。通过单因素试验和正交试验,测定超声破碎发酵性丝孢酵母细胞的工艺条件为输出功率550 W,工作总时间13 min,超声波每次辐射时间7 s(间歇时间5 s),每克细胞缓冲液加入量为20 mL。在高功率超声波破碎细胞过程中,发酵性丝孢酵母蛋白酶表现出较好的稳定性,因此发酵性丝孢酵母蛋白酶在超声波反应介质中的应用值得深入研究。
[1] 修志龙, 姜维, 苏志国. 细胞破碎技术的研究进展和发展方向[J]. 化工进展, 1994(1): 15-21.
XIU Zhilong, JIANG Wei, SU Zhiguo. Research progress and development tendency of cell disruption technique[J]. Chemical Industry and Engineering Progress, 1994(1): 15-21.
[2] ZHANG H F, YANG X H, ZHAO L D, et al. Ultrasonic-assisted extraction of epimedin C from fresh leaves of epicedium and extraction mechanism[J]. Innovative Food Science and Emerging Technologies, 2009, 10(1): 54-60.
[3] 屈慧鸽, 于小飞, 张玉香, 等. 白葡萄酒废酵母蛋白及多糖的提取工艺研究[J]. 食品科学, 2007, 28(9): 315-318.
QU Huige, YU Xiaofei, ZHANG Yuxiang, et al. Study on extraction techniques of protein and polysaccharide from waste yeast of white wine[J]. Chinese Food Science, 2007, 28(9): 315-318.
[4] 江凌, 田小群, 朱明军, 等. 啤酒废酵母残余内源蛋白酶活力的测定及其对酵母自溶的影响[J]. 食品工业科技, 2007, 28(12): 82-84.
JIANG Ling, TIAN Xiaoqun, ZHU Mingjun, et al. Determine the activity of the residue endogenic protease and the effect of the yeast autolysate from waste brewer yeast[J]. Science and Technology of Food Industry, 2007, 28(12): 82-84.
[5] 王迪, 曹方, 栾静, 等. 超声波破碎法提取发酵性丝孢酵母胞内脂肪酶的条件优化[J]. 大连工业大学学报, 2012, 31(6): 405-408.
WANG Di, CAO Fang, LUAN Jing, et al. Optimization of ultrasonic disruption for lipase extraction from Trichosporon fermentans[J]. Journal of Dalian Polytechnic University, 2012, 31(6): 405-408.
[6] 卢群, 刘晓艳, 丘泰球, 等. 超声对酵母细胞膜通透性的影响[J]. 食品与发酵工业, 2005, 31(9):14-17.
LU Qun, LIU Xiaoyan, QIU Taiqiu, et al. Effect of ultrasound on membrane permeability of saccharomyces cerevisiae[J]. Food and Fermention Industries, 2005, 31(9): 14-17.
[7] 上海市酿造科学研究所. SB/T 10317-1999 蛋白酶活力测定法[S]. 北京: 中国国家标准出版社, 1999.
Shanghai Brewing Science Institute. SB/T 10317-1999 Assay for proteinase activity[S]. Beijing: The National Stangdard of Publishing House, 1999.
[8] 丁莎莉, 张永忠. 超声波法混合蛋白酶水解酪蛋白制备酪蛋白磷酸肽的研究[J]. 中国乳品工业, 2007, 35(11):13-14.
DING Shali, ZHANG Yongzhong. Study of producing CPPs by the hydrolysis of casein by hydrolyzing casein with ultrasound[J]. China Dairy Industry, 2007, 35(11): 13-14.
[9] 周丽珍, 李冰, 李琳. 超声处理对酵母细胞的致死及相关影响[J]. 华南理工大学学报: 自然科学版, 2007, 35(12): 122-125.
ZHOU Lizhen, LI Bing, LI Lin. Inactivation of yeast cells by ultrasound disinfection and related influences[J]. Journal of South China of University of Technology: Natural Science Edition, 2007, 35(12): 122-12.
Conditions of extraction protease from Trichosporon fermentans by ultrasonication
LI Ying, ZHANG Xiao-feng, HOU Ying-min, SUN Yu-mei
(School of Biological Engineering Dalian Polytechnic University, Dalian 116034, Liaoning, China)
The cell discruption is essential toextracting intracellular protease of Trichosporon fermentans. Ultrasonication was used to disrupt cells and the effect of ultrasonic condition on the activity of protease extracted was examined. The intracellular protease was extracted more efficiently in 20 mL phosphate buffer per gram of wet cell of Trichosporon fermentans by irradiating ultrasound of 550 W for total working time of 13 min with a 5 s break following each 7 s irradiation.Under the optimal ultrasonic condition, the activity of protease extracted could reach 393.78U·g-1.
trichosporon fermentans; protease; ultrasonication; cell disruption
TS201.3 Q556.3
A
1000-3630(2015)-03-0233-04
10.3969/j.issn1000-3630.2015.03.009
2014-03-21;
2014-07-26
辽宁省教育厅创新团队项目(LT2011008)
李英(1991-), 女, 山东乐陵人, 硕士, 研究方向为微生物代谢控制发酵。
孙玉梅, E-mail: sunyumei62@163.com
