139例晚期食管鳞状细胞癌的一线化疗及生存分析
2015-08-29闫晓杰夏学明刘钦兰
闫晓杰,夏学明,刘钦兰,白 莉
解放军总医院 肿瘤内科,北京 100853
139例晚期食管鳞状细胞癌的一线化疗及生存分析
闫晓杰,夏学明,刘钦兰,白 莉
解放军总医院 肿瘤内科,北京 100853
目的 研究晚期食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)一线化疗情况及影响预后的相关因素。方法 回顾性分析2009年1月- 2014年8月在我院初治Ⅳ期行一线化疗的139例ESCC患者的临床资料,其中男性124例,女性15例,年龄39 ~ 78岁,中位年龄为58岁。采用Kaplan-Meier法分析总生存时间(overall survival,OS),单因素和Cox回归多因素分析影响生存及预后的相关因素。结果 139例患者化疗总有效率为46.8%,1年、3年、5年生存率分别为55.4%、15.8%、4.5%。一线化疗的中位OS为13.9个月,单因素及多因素分析显示,肝转移(P=0.028)、一线化疗疗效(P=0.001)、是否胸部放疗(P=0.000)与OS有关。结论 有无肝转移、化疗是否有效、是否接受放疗对患者预后有重要影响,无肝转移患者的预后好,化疗评价有效、接受放疗有益于生存。
食管肿瘤;鳞状细胞癌;晚期;化疗;生存;影响因素
网络出版时间:2015-04-09 09:32 网络出版地址:http://www.cnki.net/kcms/detail/11.3275.R.20150409.0932.001.html
食管癌是世界上最常见的6大恶性肿瘤之一,我国是食管癌发病率和死亡率最高的国家[1]。我国食管癌90% ~ 95%病理类型为鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[2]。近年来,随着经济的发展、人们保健意识的增强、新的药物及治疗方法的出现,使得食管癌在防治方面有了新进展。对于可行手术治疗的患者,手术切除仍是治疗的主要手段,但由于食管癌初期没有特异性症状,65% ~ 70%患者初诊时已属晚期,失去了手术机会[3]。晚期食管癌可以考虑给予一线化疗以延长总生存时间(overall survival,OS)、减少肿瘤负荷、改善生活质量。既往研究表明,对晚期ESCC可能有效的药物有紫杉醇、顺铂、多西他赛、吉西他滨、氟尿嘧啶等[4-8]。本研究通过回顾性分析我院初治晚期食管鳞状细胞癌患者的一线化疗的生存情况,探讨影响其生存预后的相关因素,为预后评估和临床治疗提供参考依据。
资料和方法
1 资料对象 收集2009年1月- 2014年8月在本院住院初治的晚期ESCC患者的临床资料。纳入条件:1)年龄>18周岁;2)经细胞学或组织病理学检查确诊为ESCC;3)经胸腹部增强CT、全身骨扫描、头颅增强CT检查、浅表淋巴结超声等检查,根据美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)制订的分期方法判定为胸段晚期(Ⅳ期),不适宜手术的ESCC;4)接受一线化疗;5)病历资料完整。
2 研究方法 收集患者完整的临床资料,包括一般情况(年龄、性别、确诊时间、转移部位)、治疗情况(一线化疗方案、一线化疗周期数、一线化疗最佳疗效、是否行胸部放疗)等。采用电话形式进行随访,随访截止时间为2014年12月31日,存活时间以月为单位。
3 评定标准 根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版评估疗效,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)、进展(progressive disease,PD)。总生存时间是指从一线化疗开始至患者死亡或末次随访时间(月)。有效率(response rate,RR)=(CR+PR)/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。
4 统计学方法 采用SPSS19.0软件进行数据统计分析,用Kaplan-Meier法计算患者的OS。采用单因素及COX回归多因素分析各因素对生存及预后的影响。P<0.05为差异有统计学意义。
结 果
1 一般情况 符合条件的胸段初治晚期(Ⅳ期)行一线化疗的ESCC患者共139例,男性124例,女性15例,年龄39 ~ 78岁,中位年龄为58岁。病理组织学上,单纯ESCC 136例,混合癌3例(伴有腺癌成分),其中颈部及锁骨上淋巴结转移90例(64.7%),腹腔淋巴结转移49例(35.3%),肺转移27例(19.4%),肝转移19例(13.7%),骨转移12例(8.6%)。原发肿瘤部位位于胸上段19例,胸中段69例,胸下段44例,7例为多个病变部位。病理报告分化程度的有86例,其中中、高分化42例,低分化44例。
2 治疗情况及疗效评价 139例均行化疗,化疗周期数为1 ~ 10,中位一线化疗周期数为4周期。83例(59.7%)行胸部放疗。一线化疗方案:紫杉类联合铂类(紫杉醇/多西他赛+顺铂/卡铂/奈达铂)114例,氟尿嘧啶联合铂类(氟尿嘧啶/替吉奥/卡培他滨+顺铂/奥沙利铂)10例,吉西他滨联合顺铂15例。疗效评价:CR/PR者65例(46.8%),SD者50例(36.0%),PD者24例(17.3%)。
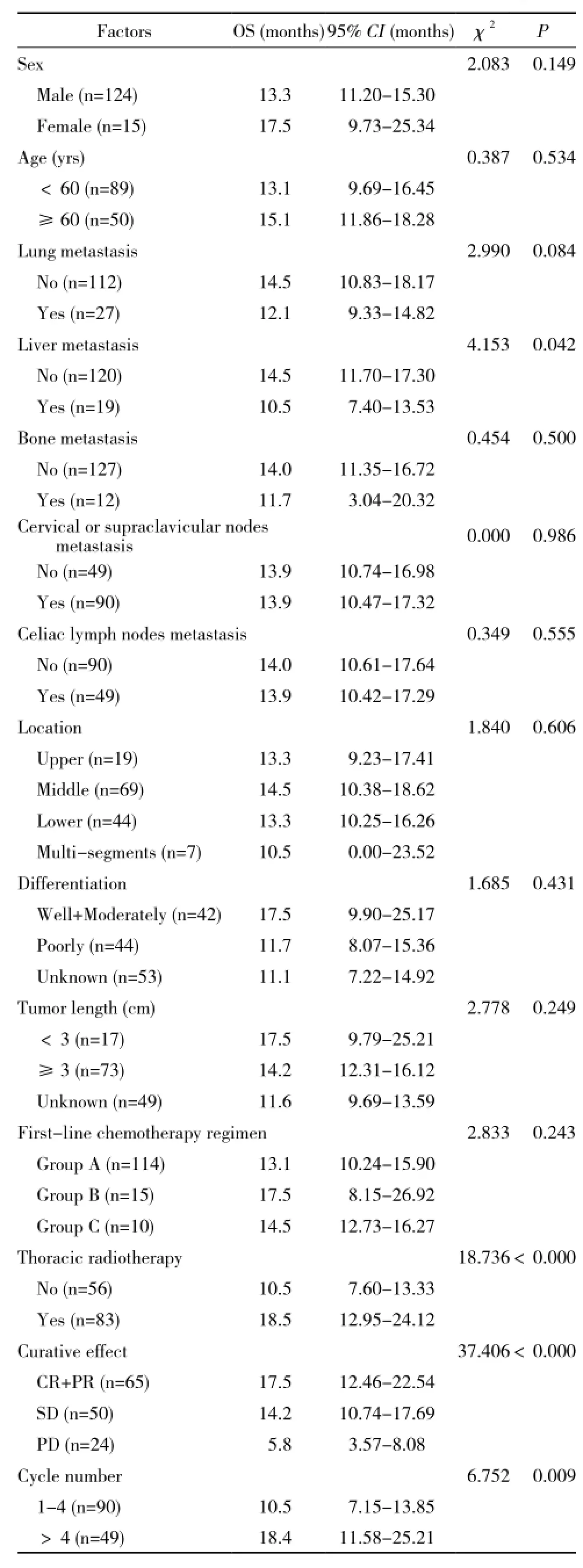
表1 晚期食管鳞癌一线化疗OS的单因素分析Tab. 1 Univariate analysis of overall survival in advanced ESCC patients who received first -line chemotherapy
3 一线化疗的OS及影响因素 一线化疗的中位OS为13.9个月,有效率为46.8%,1年、3年、5年生存率分别为55.4%、15.8%、4.5%。单因素分析表明,一线化疗的OS与肝转移、有无放疗、一线化疗疗效、一线化疗周期数相关(见表1、图1、图2、图3、图4);多因素分析显示,肝转移、有无放疗、一线化疗疗效是影响一线化疗OS的因素,见表2。

表2 晚期食管鳞癌一线化疗OS的多因素分析Tab. 2 Multivariate analysis of OS in advanced ESCC patients who received first-line chemotherapy

图 1 有无肝转移晚期食管鳞癌患者的生存曲线Fig. 1 Survival curves of advanced ESCC patients with or absence of liver metastasis
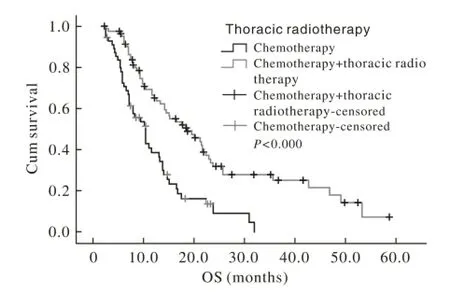
图 2 有无放疗晚期食管鳞癌患者的生存曲线Fig. 2 Survival curves of advanced ESCC patients with or without thoracic radiotherapy

图 3 不同化疗疗效的晚期食管鳞癌患者生存曲线Fig. 3 Survival curves of advanced ESCC patients with different curative effect of chemotherapy

图 4 不同化疗周期的晚期食管鳞癌患者生存曲线Fig. 4 Survival curves of advanced ESCC patients with different cycle numbers of chemotherapy
讨 论
本研究中139例患者的一线化疗的中位OS为13.9个月,1年、3年、5年生存率分别为55.4%、15.8%、4.5%,一线化疗有效率为46.8%,疾病控制率为82.7%,与既往文献报道的中位OS 13.0个月基本一致[9]。单因素和多因素统计结果表明,OS与肝转移、是否放疗、一线化疗疗效有关。本研究中无肝转移的患者OS较有肝转移的患者的生存期长(14.5个月 vs 10.5个月,P=0.042),这与临床相符。据Yamamoto等[10]分析1 132例食管癌尸检资料,其中肝转移328例(29.0%)。一般认为,远处转移是由血道转移引起,食管癌肝转移多经门脉系统,患者初治时即发现有肝转移,是预示着将有全身多处转移的信号,提示肿瘤的恶性程度高预后差[11]。
本研究中一线化疗的OS与一线化疗疗效相关。本研究达到CR/PR的患者的中位OS为17.5个月,SD与PD的中位OS分别为14.2个月和5.8个月,即CR/PR、SD患者较PD患者的OS分别延长了11.7个月和8.4个月,故如果患者化疗疗效评价有效将有益于生存,患者肿瘤体积越大,表示肿瘤细胞数量越多,更易引起肿瘤内血运障碍、乏氧细胞增加甚至肿瘤中心坏死,而乏氧细胞增多会引发肿瘤侵袭性增强,对治疗的抗拒性增加,影响治疗效果[12]。单因素分析化疗周期数是影响OS的因素,化疗4周期以上的患者OS为18.4个月,而化疗4周期以下的患者OS为10.5个月(P=0.009),但是多因素分析显示,化疗周期数并不是影响OS的独立的预后因素,可能是一般一线化疗4周期以上的患者,其化疗疗效评价较好,身体耐受性好,接受治疗的机会也多,所以OS相对较长。
单因素及多因素分析放疗是影响OS的重要因素。大多数的临床研究均是对比同步放化疗与单纯放疗,例如RTOG 94-05[13]统计了218例食管癌患者,随机分为单纯放疗组和同步放疗组,两组的中位生存时间、局部复发率和2年生存率均无显著性差异。国内的吴金龙等[14]报道了化疗组(紫杉醇+顺铂)与放化疗组(紫杉醇+顺铂,同时配合放疗),放化组在1年、2年、3年局部控制率及生存率上较单纯化疗组高。而本研究中,放疗联合化疗组的OS为18.5个月,单纯化疗组的OS为10.5个月(P=0.000)。临床上患者如果一般情况可耐受,可以考虑化疗联合放疗,以改善进食哽噎等症状,控制食管的局部病变,提高生活质量,后期也可以耐受其他治疗,生存可能获益。
本研究中女性OS较男性长4.2个月,分别为17.5个月与13.3个月,但差异无统计学意义(P=0.149),可能因本研究中女性患者较少,仅有15例(10.8%),结果有偏倚。本研究中60岁及以上患者OS为15.1个月,而<60岁患者OS为13.1个月,但两者差异无统计学意义(P=0.534)。关于性别、年龄、分化程度的差异对预后的影响,既往文献报道不一致,Yang等[15]、Wu等[16]认为,性别、年龄均不是影响预后的独立因素,也有研究报道称女性食管癌患者的预后较男性好[17]。此外,本研究中胸上、中、下段及不同分化程度组的OS差异也无统计学意义,这与Zhang等[18]回顾性报道一致。至于肿瘤长度对食管癌预后的影响,Yendamuri等[19]认为,肿瘤病变长度是影响长期生存的独立预后因素,但是在Ⅲ期患者中并无显著性差异,Zhang等[18]认为,病变长度对早期患者的预后提示作用更强。本研究中病变<3 cm组与≥3 cm组的OS无统计学差异(P=0.249)。由于本研究是单中心,化疗方案82%为紫杉类联合铂类,而吉西他滨联合铂类及氟尿嘧啶类联合铂类组的人数较少,各方案的OS差异无统计学意义,若比较不同方案的疗效及OS差异,需大规模的前瞻性的临床研究。
综上所述,晚期食管鳞癌患者预后较差,中位OS为13.9个月,5年生存率仅为4.5%。晚期食管鳞状患者中,未发生肝转移、疗效评价有效、接受放疗有益于生存,而性别、年龄、肿瘤部位、分化程度、肿瘤长度、不同化疗方案等对预后的影响差异无统计学意义。
1 张思维,张敏,李光琳,等.2003~2007年中国食管癌发病与死亡分析[J].中国肿瘤,2012,21(4):241-247.
2 高宗人,赫捷.食管癌[M].北京:北京大学医学出版社,2008:61.
3 汤钊猷.现代肿瘤学[M].上海:上海医科大学出版社,2000:797.
4 Zhang XD, Shen L, Li J, et al. A phase II trial of paclitaxel and cisplatin in patients with advanced squamous-cell carcinoma of the esophagus[J]. Am J Clin Oncol, 2008, 31(1): 29-33.
5 Muro K, Hamaguchi T, Ohtsu A, et al. A phase II study of singleagent docetaxel in patients with metastatic esophageal cancer[J]. Ann Oncol, 2004, 15(6):955-959.
6 Millar J, Scullin P, Morrison A, et al. Phase II study of gemcitabine and cisplatin in locally advanced/metastatic oesophageal cancer[J]. Br J Cancer, 2005, 93(10):1112-1116.
7 Ajani JA. Contributions of chemotherapy in the treatment of carcinoma of the esophagus: results and commentary[J]. Semin Oncol,1994, 21(4):474-482.
8 Ajani JA, Ryan B, Rich TA, et al. Prolonged chemotherapy for localised squamous carcinoma of the oesophagus[J]. Eur J Cancer,1992, 28A(4-5):880-884.
9 徐光如,张起,张立新,等.72例晚期食管癌患者的化疗预后影响因素分析[J].实用肿瘤杂志,2009,24(6):569-571.
10 Yamamoto M, Yamashita T, Matsubara T, et al. Reevaluation of postoperative radiotherapy for thoracic esophageal carcinoma[J]. Int J Radiat Oncol Biol Phys, 1997, 37(1):75-78.
11 李小平,陈震,孟志强,等.食管癌肝转移的治疗疗效观察[J].肿瘤防治杂志,2004,11(5):524-526.
12 唐华燕,唐朝晖,黄洪林.食管癌调强放疗肿瘤退缩规律及其临床价值[J].实用癌症杂志,2014,29(5):561-563.
13 Minsky BD, Pajak TF, Ginsberg RJ, et al. INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy[J]. J Clin Oncol, 2002, 20(5):1167-1174.
14 吴金龙,杨长领,兰跃强,等.同步放化疗联合与单纯化疗对中晚期食管癌疗效观察[J].中国医学创新,2008,5(32):1-3.
15 Yang X, Huang Y, Feng JF. Is there an association between ABO blood group and overall survival in patients with esophageal squamous cell carcinoma?[J]. Int J Clin Exp Med, 2014, 7(8): 2214-2218.
16 Wu J, Chen QX, Zhou XM, et al. Does recurrent laryngeal nerve lymph node metastasis really affect the prognosis in node-positive patients with squamous cell carcinoma of the middle thoracic esophagus?[J]. BMC Surg, 2014, 14:43.
17 Micheli A, Mariotto A, Giorgi Rossi A, et al. The prognostic role of gender in survival of adult cancer patients. EUROCARE Working Group[J]. Eur J Cancer, 1998, 34(14 Spec No):2271-2278.
18 Zhang P, Xi M, Zhao L, et al. Unilateral cervical nodal metastasis is an Independent prognostic factor for esophageal squamous cell carcinoma patients undergoing chemoradiotherapy: a retrospective study[J]. PLoS One, 2014, 9(6): e101332.
19 Yendamuri S, Swisher SG, Correa AM, et al. Esophageal tumor length is independently associated with long-term survival[J]. Cancer, 2009, 115(3):508-516.
First-line chemotherapy of patients with advanced esophageal squamous cell carcinoma: A survival analysis of 139 cases
YAN Xiaojie, XIA Xueming, LIU Qinlan, BAI Li
Department of Medical Oncology, Chinese PLA General Hospital, Beijing 100853, China Corresponding author: BAI Li. Email: baili_0795@163.com
Objective To study the survival of patients with advanced esophageal squamous cell carcinoma (ESCC) in first-line chemotherapy and the factors related to the prognosis. Methods Clinical data about 139 advanced ESCC patients with 124 males and 15 females who received first-line chemotherapy in our hospital from January 2009 to August 2014 were retrospectively analyzed. The distribution of age range was 39 to 78 years old with median age of 58 years old. Kaplan-Meier method was used to calculate the overall survival (OS). Univariate analysis and Cox regression analysis were used to detect the influence factors of survival and prognosis. Results The response rate of 139 patients with chemotherapy was 46.8% with 1-year, 3-year, 5-year survival rates of 55.4%, 15.8%, 4.5%, respectively. The median OS of patients with advanced ESCC in first-line chemotherapy was 13.9 months. According to the results of univariate and COX multivariate analysis, OS of patients with advanced ESCC was closely associated with liver metastasis (P=0.028), curative effect of first-line chemotherapy (P=0.001) and thoracic radiotherapy (P=0.000).
Conclusion Liver metastasis, curative effect of first-line chemotherapy and thoracic radiotherapy have important influences on the prognosis of patients with ESCC. The patients who are absence of liver metastasis have better prognosis. It is beneficial to survival if patients have effective curative effect of first-line chemotherapy and receive thoracic radiotherapy.
esophageal neoplasm; squamous cell carcinoma; advanced; chemotherapy; survival; influence factors
R 735.1
A
2095-5227(2015)07-0671-05
10.3969/j.issn.2095-5227.2015.07.009
2015-02-09
闫晓杰,女,硕士,医师。研究方向:消化系统肿瘤的综合治疗。Email: yanxiaojie1221@126.com
白莉,女,博士,主任医师,博士生导师。Email: baili_ 0795@163.com
