肺腺癌EGFR与KRAS基因突变状态分析
2015-08-27张卉杨新杰秦娜李曦杨惠夷农靖颖吕嘉林吴羽华张权张新勇王敬慧周立娟张树才
张卉 杨新杰 秦娜 李曦 杨惠夷 农靖颖 吕嘉林 吴羽华 张权 张新勇 王敬慧 周立娟 张树才
表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种受体型酪氨酸激酶,在许多肿瘤中过表达和(或)发生突变,通过信号转导控制肿瘤生长,并与新生血管生成、肿瘤的侵袭和转移关系密切[1]。KRAS基因的突变直接启动了EGF通路下游的KRAS途径,并间接启动了EGF信号通路中的PI3K途径,使得非小细胞肺癌(non-small cell lung cancer,NSCLC)进展更迅速,并且使针对EGFR上游通路的药物失效[2]。目前多项研究[3-5]结果表明存在EGFR突变的NSCLC患者应用EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)具有较好的临床疗效和安全性,而KRAS基因突变也与肺癌治疗的耐药相关。因此,通过对EGFR和KRAS突变状态的检测,可以筛选出应用EGFR-TKI类药物治疗能够获得更多收益的患者。本研究通过检测分析肺腺癌患者肿瘤组织标本EGFR和KRAS基因的突变状况,以及其与临床特征之间的关系,为临床指导患者进行有针对性的治疗提供依据。
1 材料与方法
1.1 材料 收集首都医科大学附属北京胸科医院2006年1月7日-2014年3月21日收治的初治肺腺癌患者395例,所有患者均经细胞学或组织学证实并有可供检测的肿瘤组织标本。其中男性211例,女性184例。年龄20岁-82岁;吸烟(吸烟指数>20包/年)123例,轻度吸烟(0<吸烟指数<20包/年)57例,不吸烟(吸烟指数为0)215例;按2002年美国癌症研究联合会(American Joint Committee on Cancer,AJCC)癌症分期手册(第6版)NSCLC分期标准,I期52例,II期16例,III期64例,IV期263例(表1)。
1.2 主要仪器与试剂 DNA提取试剂盒(美国Promega公司);引物、探针合成(广州英韦创津生物科技有限公司);蛋白酶K(德国Merck公司);链霉亲和素-藻红蛋白、Taq酶和dNTP(美国Invitrogen公司);DNA聚合酶(美国Promega公司);微球和Luminex 200TM液相芯片阅读仪(美国Luminex公司);PCR仪(美国BIO-RAD公司);Nanodrop 1000分光光度计(美国Thermo Scientific公司);低温离心机(德国Eppendorf公司)。
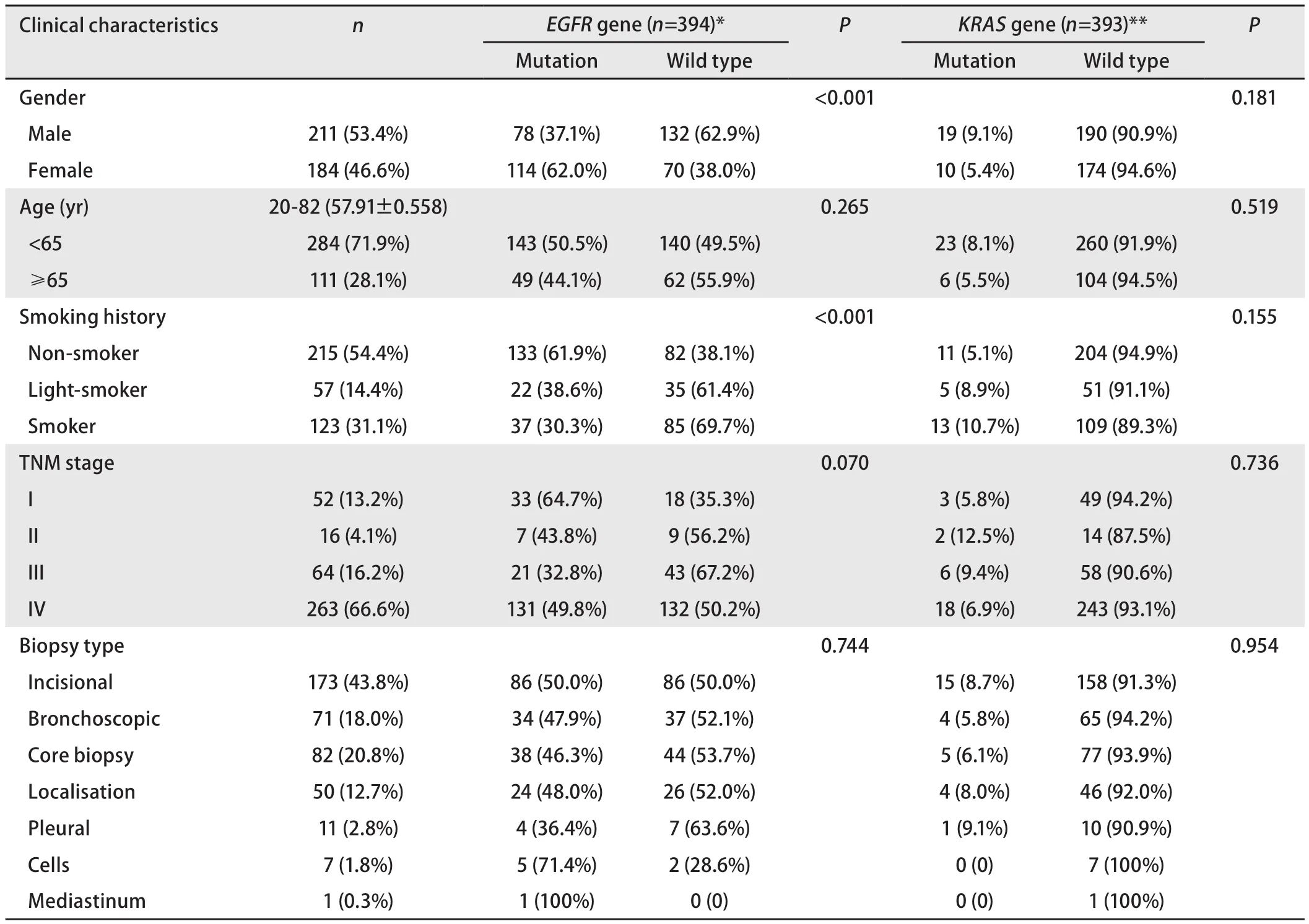
表1 EGFR与KRAS基因突变亚组分析Tab 1 Subgroup analysis of EGFR and KRAS mutation status
1.3 突变富集液相芯片法 切取5 μm石蜡包埋标本10张,用DNA提取试剂盒从样本中抽提纯化DNA(具体参照产品说明书),随后用Nanodrop 1000分光光度计对DNA浓度进行定量;所有样品所提的DNA的量足以用于检测。取纯化后的DNA作为模板进行PCR预扩增,多重PCR反应条件为,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共35个循环;预扩增产物进行酶切反应,特异切除野生型,反应条件为37 ℃ 30 min;取酶切产物作为模板进行PCR扩增富集突变型,在96 ℃条件下孵育2 min,反应条件为94 ℃ 30 s,52 ℃ 1 min,74 ℃ 2 min,共40个循环;第二次PCR产物与交联了特异探针的微球杂交,杂交反应在96孔板上进行,将PCR产物、微球混合液和杂交液加入反应管中,95 ℃ 5 min,然后60 ℃杂交15 min,加入链霉亲和素-藻红蛋白,60 ℃反应5 min[6,7];于Luminex阅读仪上读取数据。突变分析由益善医学检验所完成。
1.4 统计学方法 采用SPSS 21.0统计软件进行统计分析,EGFR与KRAS基因突变状态和临床特征分析采用χ2检验或Fisher’精确检验。以P<0.05为差异有统计学意义。
2 结果
2.1 突变检测结果 395例肺腺癌EGFR基因突变检测中,有1例检测失败;18外显子G719X突变10例(2.5%);19外显子缺失突变93例(23.5%);20外显子突变4例(1.0%);21外显子突变81例(20.5%);同时存在两种突变4例(1.0%);野生型202例(51.1%)。KRAS基因突变检测中,有2例检测失败;外显子2突变27例(6.8%);外显子3突变2例(0.5%);野生型364例(92.2%)。同时存在EGFR19外显子缺失突变合并KARS外显子2突变1例(0.3%)(表2)。
2.2 突变与临床特征的关系 女性和不吸烟的患者EGFR基因突变率高于男性和吸烟患者,其差异具有统计学意义(P<0.001,P<0.001);不同年龄、分期及病理取材标本之间差异无统计学意义(P>0.05)。与EGFR基因突变不同的是,KRAS基因突变在性别、年龄、分期、吸烟史及病理取材方式各亚组分析中都未发现差异具有统计学意义(P>0.05)(表1)。
2.3EGFR与KRAS基因突变相关性分析 在EGFR和KRAS基因都检测成功的392例患者中,EGFR基因突变阳性患者中有2例(1.0%)同时发现KRAS基因突变,而在EGFR基因野生型患者中,有27例(13.5%)发现KRAS基因突变。KRAS基因突变在EGFR基因野生型患者中发生率明显高于EGFR基因突变患者,差异具有统计学意义(P<0.001)(表3)。
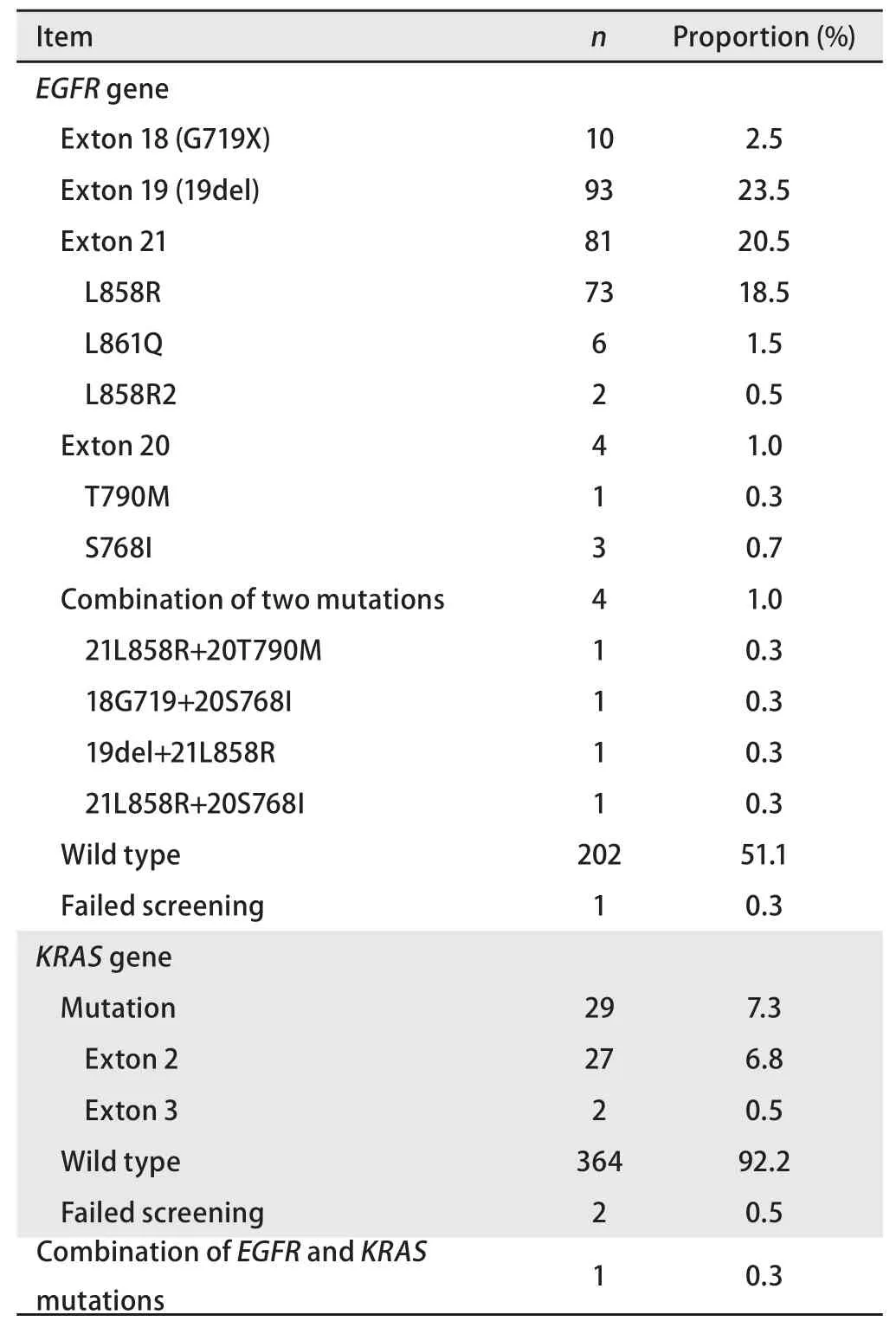
表2 EGFR及KRAS基因突变检测结果(n=395)Tab 2 Results of EGFR and KRAS mutation status (n=395)
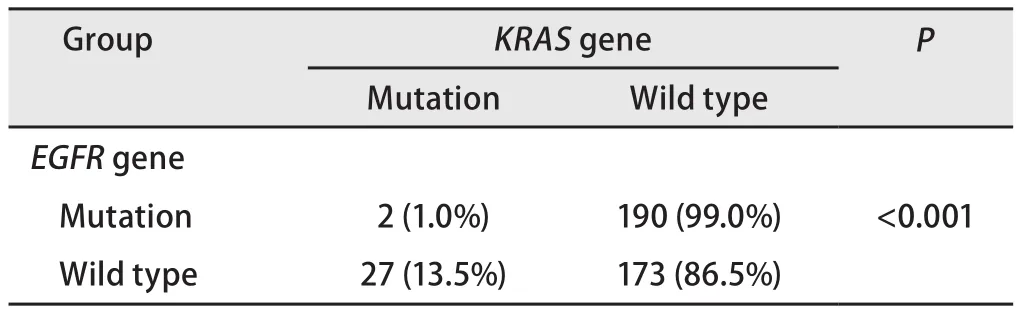
表3 EGFR基因与KRAS基因突变相关性分析(n=392)Tab 3 Analysis of the correlation between EGFR and KRAS gene mutations (n=392)
3 讨论
对于NSCLC患者,选择合理的治疗方案十分重要。美国和中国的肿瘤临床指南均明确指出使用EGFR-TKI治疗前必须进行EGFR基因突变检测。KRAS是EGFR信号转导通路下游的一个重要节点。TKI治疗耐药与KRAS基因突变以及特定的获得性EGFR基因突变(T790M突变)有关[8],所以同时检测KRAS基因突变有助于选择最能从TKI治疗中获益的患者。
在美国NSCLC患者中只有约10%有EGFR突变,然而在亚洲人中有约30%NSCLC存在EGFR基因突变[3]。Paez等[9]对119例NSCLC患者的EGFR突变进行分析后发现,在肺腺癌中EGFR基因突变率明显高于其它病理类型。本研究在对395例肺腺癌肿瘤组织标本检测中发现有48.6%患者存在EGFR突变,低于之前IPASS研究[3]中所报道的59.7%的突变率,但与最近PIONEER研究[10]报道的50.2%的EGFR基因突变率接近,原因可能是IPASS研究人群为靶向治疗优势人群(女性、腺癌、不吸烟),而PIONEER研究[10]与本研究的研究人群一致,都为确诊肺腺癌的患者。本研究中EGFR基因突变率高于之前报道的NSCLC中EGFR基因平均突变率,也说明中国人肺腺癌中EGFR突变率高于其他病理类型。Paez等[9]在进一步的亚组分析中发现,女性和不吸烟的患者EGFR基因突变率高于男性和吸烟患者。后续的多项临床研究[11,12]中,重复证实了女性、不吸烟患者中EGFR突变率明显高于男性和吸烟患者。本研究中女性、不吸烟患者的EGFR基因突变率也明显高于男性、吸烟患者(62.0%vs37.1%,61.9%vs30.3%),且差异达到统计学意义(P<0.001,P<0.001),与之前的报道结果一致。
KRAS基因突变在非亚洲人群中较为常见。Mao等[13]对22篇论著纳入的1,470例肺癌患者进行系统分析,发现231例(16%)患者存在KRAS基因突变,明显高于国内衣素琴等[14]报道的5.03%和罗炜等[15]报道的3.7%的KRAS突变率。本研究仅对肺腺癌患者进行KRAS突变检测分析,发现7.3%的患者存在KRAS基因突变,明显低于Mao等[13]研究中报告的肺腺癌中26%的KRAS基因突变率,但与国内相关研究报道[14,15]的4.4%-5.3%的KRAS突变率接近。其中差异原因可能是KRAS基因突变也与EGFR基因突变一样,在不同种族或同一种族不同地区中存在差异。本研究虽然纳入病例数较多,但主要为北京及周边地区患者,具有地域的局限性,因此尚需对多地区样本进行检测分析。目前关于KRAS基因突变与患者吸烟史的相关性报道结果尚不一致。有文献[16]报道,KRAS基因在吸烟患者中更易发生。但一项韩国研究[17]中发现KRAS基因突变与吸烟无关。本研究中也发现KRAS基因突变与是否吸烟并无相关性(P>0.05)。另外,与国内多数报道[14,15,18]结果一致的是,在对性别和年龄的亚组分析中也未发现KRAS基因突变存在差异。
大多数研究[14]认为EGFR和KRAS基因突变是相互排斥的。但在后续的一些研究中也发现KRAS基因突变可以在EGFR基因突变的情况下发生,但发生率要明显低于EGFR基因野生型患者。本研究中检测到1例患者同时存在EGFR 19外显子缺失突变和KRAS 2外显子突变,但临床应用TKI药物治疗,疗效不佳。将EGFR和KRAS基因突变相关性进行分析发现,EGFR基因突变阳性的患者中KRAS基因突变率为1.0%,而EGFR基因野生型患者中KRAS基因突变率为13.5%,两者间差异具有统计学意义(P<0.001)。也就是说,KRAS基因突变状态与EGFR基因突变状态有关,在EGFR基因野生型患者中发生率更高[19]。
目前尚无任何指南对NSCLC患者的EGFR及KRAS基因突变检测方法及检测标本做出明确规定。但大型国际多中心临床研究多采用ARMS法进行突变检测[2-4]。本研究中所采用新型的突变富集液相芯片法,灵敏度可达到0.1%[20],检测标本不仅包含手术切除的巨大肿瘤组织标本(173/395),也有支气管镜活检、肺穿刺、胸膜活检、胸水包埋等临床常见的微小组织标本(222/395)。结果仅有1例手术标本和2例支气管镜活检标本因石蜡切片中DNA断裂,导致基因突变检测失败。但各类组织标本包括胸水肿瘤细胞沉渣都可以满足突变富集液相芯片法检测EGFR和KRAS基因突变的要求,甚至我们在血浆游离DNA的基因突变检测中也取得了满意的结果[21]。
肺癌的靶向治疗时代已经来临。初治EGFR基因突变的NSCLC患者中TKI治疗有效率虽然达到70%-80%,但还有20%-30%的患者可能因为各种原因存在原发耐药,其中KRAS基因突变就是最常见的原因。因此,在NSCLC患者进行TKI药物治疗前进行EGFR和KRAS基因突变检测是非常必要的,必将成为临床的常规诊断项目。
