突变型P53蛋白在肺腺癌中的表达及其临床意义
2015-08-26卞春安李忠佑许有涛王洁许林沈洪兵
卞春安 李忠佑 许有涛 王洁 许林 沈洪兵
TP53基因作为一种非常经典和重要的抑癌基因,一直以来受到广泛的关注和研究[1]。其编码的P53蛋白是一种应激反应蛋白,可以通过调节基因转录来应对基因毒性应激、癌基因信号激活以及DNA损伤等不利因素。近来的全基因组关联研究(genome wide association study, GWAS)提示TP53基因是人类恶性肿瘤中突变频率最高的基因之一[2]。相对于其他抑癌基因突变后仅仅是丧失了抑癌功能,TP53基因突变有其独特的特性,即突变的基因获得了新的促癌功能(gain of function, GOF)[3]。目前已有许多有关TP53突变在非小细胞肺癌(non-small cell lung cancer,NSCLC)中作用的研究,但结论尚不一,而且单独对TP53突变在肺腺癌中作用的研究则更为少见[4-7]。虽然同为NSCLC,肺鳞癌和肺腺癌的基因突变谱是完全不同的,研究[8-10]发现TP53、EGFR、KARS、ALK、PIK3CA、SMAD4等基因是肺腺癌的常见的驱动基因,因此将肺鳞癌和肺腺癌分别研究更为合理。由于突变的TP53基因编码的P53蛋白半衰期较长,而野生型TP53基因编码的P53蛋白半衰期极短,所以突变型P53蛋白在细胞核内积累从而可以被免疫组化法检测,而野生型P53蛋白无法被免疫组化法检测到[11]。本研究利用免疫组化SP法检测突变型P53蛋白在肺腺癌组织中的表达情况,分析其与患者临床病理特征及预后的关系,探讨突变型P53蛋白在肺腺癌中的作用及其对预后的影响。
1 资料与方法
1.1 标本及病例资料来源 收集南京医科大学附属江苏省肿瘤医院2007年1月-2009年3月期间手术切除并经术后病理确诊为肺腺癌的石蜡标本120例。所有纳入研究的患者均有完整的病历及随访资料。随访期间死于其他疾病的患者不被纳入研究。所有患者接受的均为根治性手术,所有患者术前均未接受放疗或化疗。本研究经江苏省肿瘤医院医学伦理委员会批准。
1.2 免疫组化SP法测定突变型P53蛋白表达 鼠抗人突变型P53单克隆抗体购自Santa Cruz公司(克隆号clone SC126),SP试剂盒购自北京中山公司。染色方法采用常规SP法,突变型P53一抗工作浓度为抗体原液稀释1,000倍。采用生物素标记的二抗进行染色。用已知的阳性胰腺癌组织作为阳性对照,使用PBS缓冲液代替一抗做为阴性对照。
1.3 免疫组化结果判定 突变型P53蛋白的表达主要定位于细胞核,以胞核中有棕褐色颗粒染色为阳性(图1), 每个切片于高倍镜下随意取5个不重复视野计数,计数所有细胞,表达强度按阳性细胞所占百分比进行判断,取其平均值,以阳性细胞数≤10%为阴性,阳性细胞数>10%为阳性。免疫组化的结果判定由两个高年资病理科医生共同作出。
1.4 统计学方法 实验数据应用SPSS 17.0统计软件进行统计分析,组间率的比较采用χ2检验,单因素生存分析采用Kaplan-Meier法(Log-rank检验),多因素生存分析采用Cox风险比例模型。以P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征及预后 所有纳入研究的患者中男性58例,女性62例。手术时的平均年龄为59.4岁。截止到随访时间(2014年3月)有20.8%(25例)的患者仍存活。采用寿命表法统计出患者的1年、3年、5年的生存率分别为61%、39%、33%。肿瘤大小≤3 cm(T1)的占20%(24例),>3 cm≤7 cm(T2)的占60.8%(73例),>7 cm(T3、T4)的占19.2%(23例)。淋巴结转移的占40.8%(49例)。肿瘤高分化的占26.7%(32例)、中分化的占34.1%(41例)、低分化的占39.2%(47例)。仅有10.8%(13例)患者有胸膜侵犯。临床分期为I期、II期和III期的患者分别占30.8%(37例)、39.2%(47例)和30.0%(36例)(表1)。
2.2 突变型P53蛋白的表达及其与临床病理特征的关系 免疫组化法检测突变型P53蛋白在肺腺癌组织中的表达率为63.3%(76/120)。卡方检验显示突变型P53蛋白的表达与患者肿瘤大小(P=0.041)和临床病理分期(P=0.025)有相关(图1)。
2.3 突变型P53蛋白的表达及临床病理特征与预后的关系运用Kaplan-Meier法对120例患者进行单因素生存分析发现,肿瘤的大小(P=0.031)、淋巴结转移(P<0.001)、临床病理分期(P<0.001)、突变型P53蛋白的表达(P=0.038)与患者的总生存期密切相关(图2)。对单因素分析中P<0.05的因素进一步进行Cox风险比例模型多因素,结果显示仅有淋巴结转移(P=0.014)为肺腺癌总体生存期的独立预后因素(表2)。
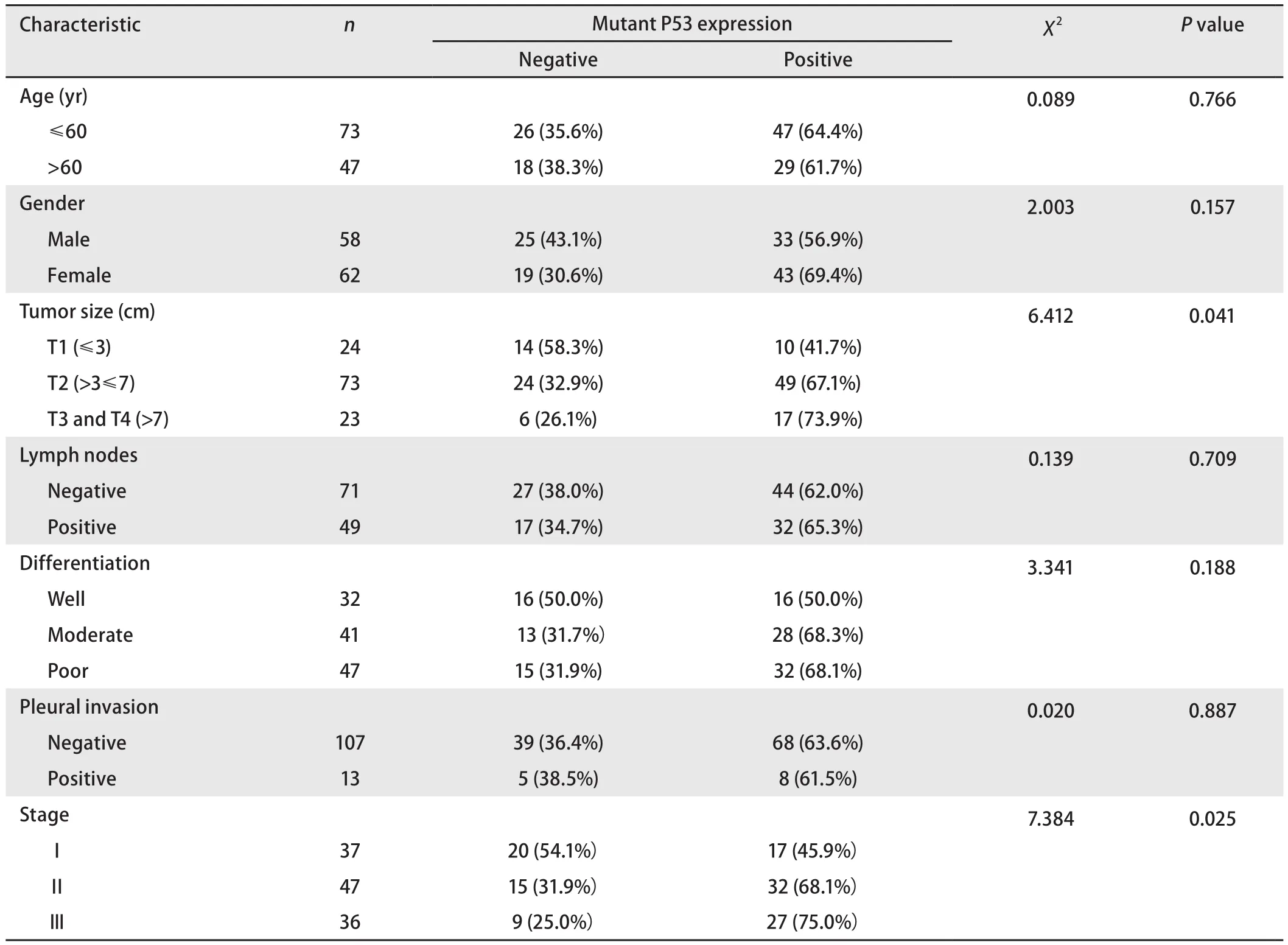
表1 突变型P53的表达患者临床病理参数的关系Tab1 Mutant P53 expression in relation to clinicopathological parameters (n=120)
3 讨论
肺癌是当今世界上发病率和死亡率最高的恶性肿瘤之一[12],并且流行病学统计发现肺癌中的肺腺癌发病率越来越高,目前已经取代肺鳞癌成为发病率最高的NSCLC[13]。长期以来,以肺鳞癌和肺腺癌为代表的NSCLC的预后无明显改善,直到近十年来,随着分子生物学的进展,EGFR、KARS、TP53等一批肺腺癌驱动基因被陆续发现[14],导致一些靶向治疗药物的出现,极大地改善了肺腺癌患者的预后[15,16]。人类TP53基因定位于17号染色体p13,全长16 kb-20 kb,含有11个外显子,转录2.8 kb的mRNA,编码蛋白质为P53,是一种核内磷酸化蛋白。TP53是迄今为止发现的与人类肿瘤相关性最高的基因。过去一直把它当成一种癌基因,直至1989年才发现起癌基因作用的是突变的P53,后来证实野生型P53是一种抑癌基因,在正常情况下,细胞中野生型P53蛋白的含量很低,且半衰期极短,所以很难检测出来。一直以来,TP53基因都是生物学界研究的热点,有关野生型的TP53基因的抑癌作用和突变型的TP53的致癌功能,已经得到公认。众多临床证据[17]也显示TP53基因突变与多种恶性肿瘤的不良预后有关。尽管如此,突变的TP53在肺癌中的意义尚不明确。Ding等[18]发现45%的肺腺癌患者的TP53基因存在突变,而本研究中肺腺癌组织中测得的TP53突变率为63.3%,较其报道的突变率略高。Ahn等[11]报道TP53的突变与NSCLC的预后无关。而另一些报道[19-22]则认为TP53突变是NSCLC的不良预后标志。本研究中亦发现TP53的突变与患者不良的总生存期预后有关,但并不是独立预后因素,猜测可能是因TP53基因是一个关键基因,调控多种基因的转录表达、作用及机制较为多样复杂所致。另外,有报道[23,24]在动物实验中发现含有TP53突变的小鼠肿瘤更具侵袭性更容易转移。但本研究中未发现TP53突变与肿瘤转移相关,仅与肿瘤的大小及临床病理分期相关。对于肺癌中TP53突变的作用各个研究得出的结论不一,我们认为可能与分子的异质性、TP53突变的各种不同基因型以及实验采用的不同方法、不同分组、样本量的大小不同有关。故今后需要进行更大样本量的实验,更加完善的实验方法,以取得较为可靠一致的结论。
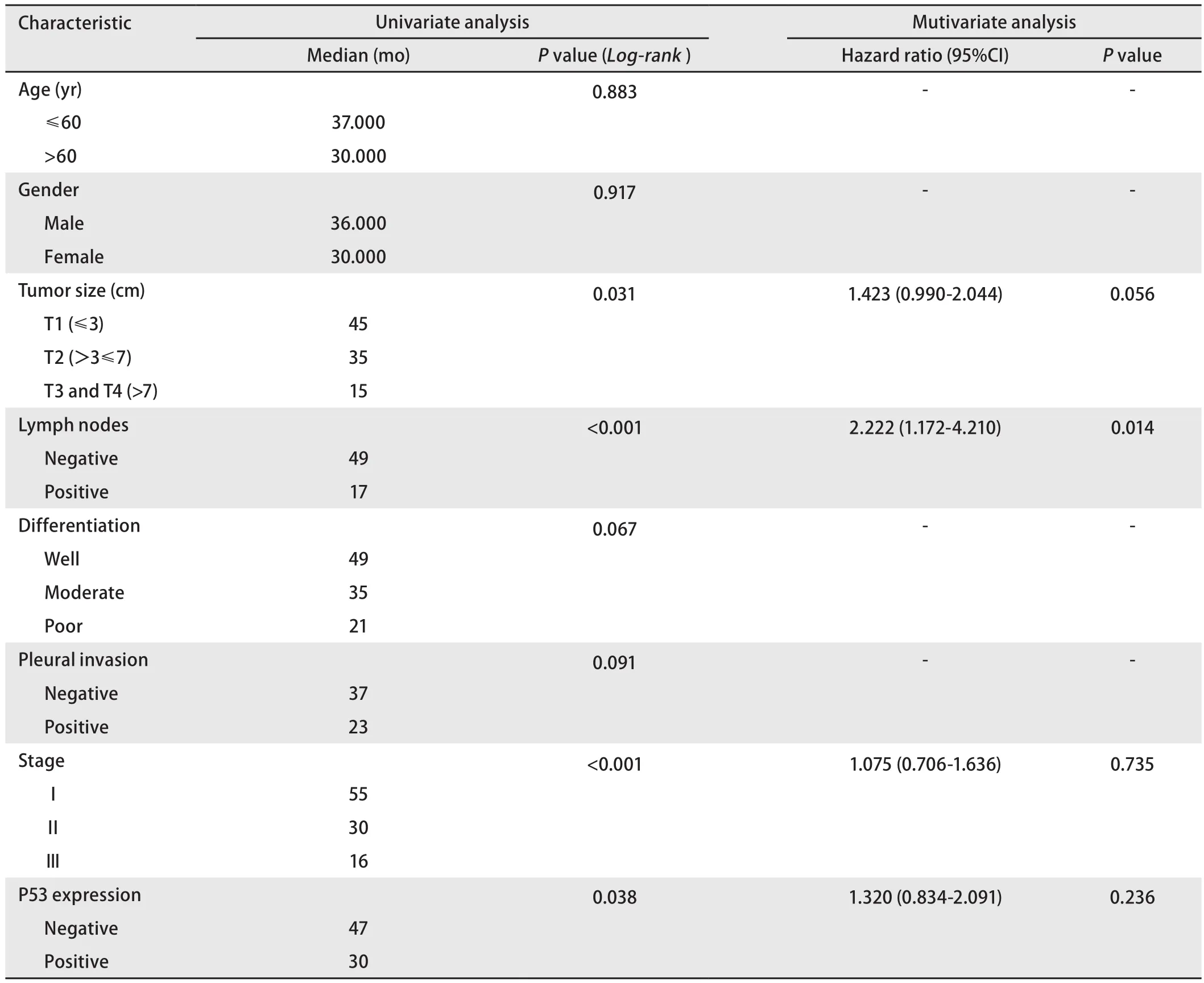
表2 患者总生存期的单因素及多因素分析Tab2 Univariate and multivariate analyses of overall survival (n=120)
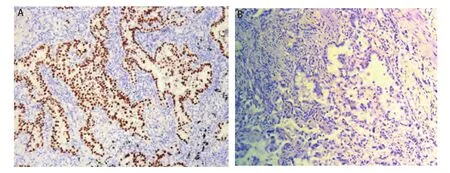
图1 突变型P53在肺腺癌组织中的免疫组化(SP法,×100)。A:突变型P53阳性表达(细胞核棕黄色染色);B:突变型P53阴性表达。Fig1 Mutant P53 expression in lung adenocarcinoma by immunochemistry (SP, ×100). A: Positive mutant P53 expression (staining was detected in nucleus); B: Negative mutant P53 expression.
综上所述,本研究应用免疫组化法对120例肺腺癌患者的突变型P53蛋白进行了检测,发现其与患者的肿瘤大小,临床病理分期及总生存期有关。本研究结果提示TP53突变是肺腺癌患者不良预后的一个重要因素,未来值得对相关机制进一步进行研究。

图2 突变型P53蛋白表达与总生存期的生存曲线Fig2 The overall survival curve of patients according to mutant P53 expression
