水源切换对水厂出水细菌群落的影响
2015-08-25张明露刘文君李翠萍李玉仙顾军农北京工商大学环境科学与工程系北京100048清华大学环境学院北京100084北京市自来水集团北京10001
张明露,刘文君,李翠萍,李玉仙,顾军农(1.北京工商大学环境科学与工程系,北京 100048;.清华大学环境学院,北京 100084;.北京市自来水集团,北京 10001)
水源切换对水厂出水细菌群落的影响
张明露1,2,刘文君2*,李翠萍2,李玉仙3,顾军农3(1.北京工商大学环境科学与工程系,北京 100048;2.清华大学环境学院,北京 100084;3.北京市自来水集团,北京 100031)
针对水源切换可能造成水厂出水微生物风险的问题,以北京某水厂由本地水源切换为河北水源期间原水和出厂水为研究对象,采用焦磷酸测序技术对水中的微生物种群结构和潜在致病菌进行分析.结果显示,出厂水的细菌多样性显著低于原水,原水和出厂水中的优势菌均为变形菌门(Proteobacteria),所占比例为11.99%~95.48%,其中包括α,β和γ变形菌纲(α, β, γ-Proteobacteria),但相对丰度有较大差异.水源切换后的原水中优势菌为蓝藻门(Cyanobacteria),且该菌在切换后的出厂水中也存在.出厂水中检测到部分潜在致病菌,优势菌包括不动杆菌(Acinetobacter)和代尔夫特菌(Delftia),增加了饮用水的微生物安全风险.PCoA结果显示,水源切换前后原水中细菌群落结构变化较大,但改变水源对出厂水的微生物群落影响较小,水厂能够维持稳定的运行.
水源切换;微生物安全性;焦磷酸测序;致病菌
随着城市水资源的日益匮乏和水质持续恶化,单一水源往往不能保证供水量,许多城市特别是北方地区缺水城市,常采用多水源联合供水的方式,如季节性的水源切换和长距离调水工程等.然而,由于各水源之间水质存在差异,使城市供水系统面临各种水质安全问题.研究表明,不同水源切换时,由于水质化学组成的差异有可能引起管网水中铁腐蚀产物的释放量增加[1],导致用户端水质恶化,如浊度和色度升高、产生异味,发生“黄水”问题等[2-4].
除了水质化学的变化,不同水源的生物组成也有差异.我国南方地区的一些水源中微生物数量较多、微型水生动物过度孳生[5-7],已成为威胁饮用水水质安全的潜在风险因素.然而,目前对水源切换过程中微生物安全性研究较少.为保证水源切换期间水厂出水持续达标,保障管网微生物安全性,研究水源切换前后出水的微生物变化规律,特别是病原微生物的存在,是预防和治理微生物污染的基础.
近年来,高通量测序技术为环境微生物生态研究提供了新的手段,它能克服传统纯培养技术的缺陷,对样品进行深度测序,全面解析样品中微生物的群落结构.目前,国内外已在饮用水系统的微生物研究方面开展了一些应用,但尚处于初级阶段[8-11].本文以北京某水厂水源切换期间原水和出厂水的微生物群落为研究对象,采用454焦磷酸测序分析了水源切换对出厂水微生物多样性的影响,旨在为多水源水厂的运行和管理提供参考.
1 材料与方法
1.1样品采集

表1 原水和出厂水水质参数Table 1 Water quality parameters of raw and finished water
于2011年7月~8月采集北京某地表水厂在水源切换期间的原水和出厂水,该水厂切换前水源为本地水库水,其主要处理工艺为絮凝、沉淀、煤砂滤池、活性炭吸附和氯消毒.7月30日开始切换为河北水库水.表1为切换前后原水和出厂水的常规水质参数.切换后原水pH值下降,浊度和色度均有所升高.分别于7月22和7月26日采集切换前原水(J1和 J2)和出厂水(C1和 C2), 于7月31日,8月2日,4日和6日采集切换后的原水(J3, J4, J5和J6)和出厂水(C3, C4, C5和C6).
使用无菌塑料桶采集水样5~10L,2h内返回实验室并立即过滤.将水样通过0.22µm孔径,直径为90mm的滤膜(GSWP,Millipore),将滤膜取下后放入50mL无菌离心管中,加入10mL PBS缓冲液涡旋振荡洗脱,将洗脱液8000r/min,离心10min,沉淀重悬于1~2mL PBS缓冲液中,置于-80℃冰箱中备用.
1.2总DNA的提取
使用Soil DNA提取试剂盒(MO-Bio,美国)提取水样中 DNA,操作按照试剂盒的说明进行.DNA浓度采用Nanodrop 2000在260nm下测定(Nano-drop Technologies, Wilmington, DE).
1.3454高通量测序
应用高通量测序平台 Barcoded 454GSFLX Titanium对DNA样品进行测序.使用带8bp样本标签的引物扩增16SrRNA的V1-V3区.上游引物为 28F5'-TTTGATCNTGGCTCAG-3',下游引物为519R 5'-GTNTTACNGCGGCKGCTG-3'[12]. PCR反应采用Hot Start and HotStar high fidelity Taq polymerases混合酶进行扩增.反应体系为50μL,反应条件为 95℃预变性 2min,95℃ 30s, 55 30s,72 30s℃℃,循环30次;72℃延伸5min,PCR产物回收定量后应用454 测序平台测序.
1.4数据处理
测序结果采用 QIIME软件进行分析[13].对GS-FLX测序的序列进行测序质量和长度筛选,去掉含有不确定碱基(N)的序列,去掉长度小于200bp的序列.与RDP数据库中的序列进行比对,以序列相似性 97%为阈值,将序列分为可操作分类单元(OTU).通过基于UniFrac距离和加权组平均法进行主坐标分析(PCoA).选取相似度在97%条件下的OTU生成物种稀疏曲线.Good's覆盖率按(1-n/N)×100计算,n为单一序列的数目,N为样品含有的序列总数.
2 结果与讨论
2.1细菌多样性
采用高通量测序法对水源切换前后的 6个原水和6个出厂水进行16SrDNA基因片段序列分析,共获得有效序列63946条,序列平均长度为468bp.通过计算多样性指数Shannon和物种丰富度指数 Chaol来评估文库所代表的微生物多样性,序列信息及多样性指数见表 2.种群个体分配越均匀,Shannon指数值就越大,Chaol为估计群落中的OTU数目.由表2可见,无论是丰富度指数Chaol还是Shannon指数,原水均显著高于出厂水(t检验, P<0.05).以Good's覆盖率结合物种稀疏曲线来评估所构建的文库对样品中微生物多样性的体现,如表2和图1所示,12个样品文库的覆盖率均大于95%,且稀疏曲线趋向于平缓,说明测序深度能够较真实地反映样本的细菌多样性.同时,稀疏曲线显示原水稀疏曲线明显比出厂水陡峭,说明原水中的微生物种类显著高于出厂水.

表2 测序信息及物种多样性指数比较Table 2 Comparison of sequential analysis and diversity indices from the pyrosequencing analysis

图1 水样的物种稀疏曲线Fig.1 Rare faction curves of water samples
2.2细菌群落结构分析
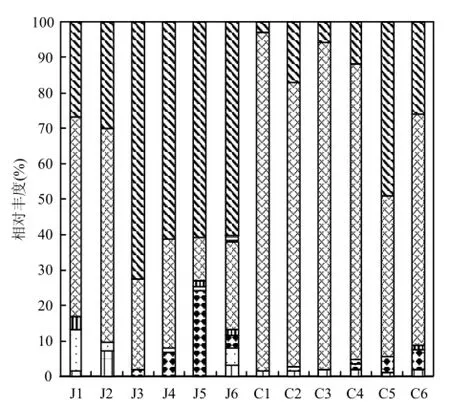
图2 原水和出水中细菌门水平相对丰度Fig.2 Relative abundance of different phyla in raw waters and finished water

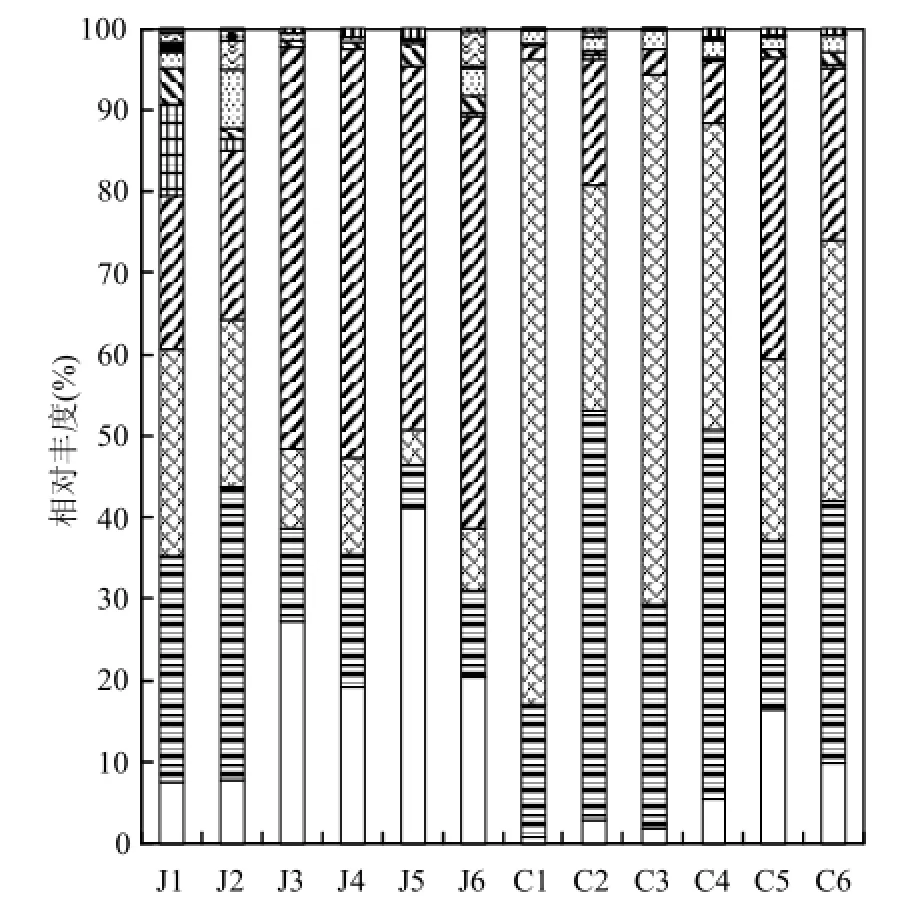
图3 原水和出水中细菌纲水平相对丰度Fig.3 Relative abundance of different classes in raw waters and finished water

以门为分类单元分析水样中细菌群落的结果如图 2所示.12个水样中优势细菌(相对丰度>1%)共包括 7个门,分别是放线菌门(Actinobacteria),拟杆菌门(Bacteroidetes),蓝藻门(Cyanobacteria),厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetes),变形菌门(Proteobacteria)和疣微菌门(Verrucomicrobia).原水中除了 J5,其余 5个水样中的第1优势细菌均为变形菌门,其相对丰度为24.90%~59.96%,该菌在水样J1中相对丰度最高.J5中第1优势细菌为蓝藻门,其相对丰度为 24.23%,且该菌在切换前的原水中未发现.由图2可以看出,水源切换前后原水中细菌群落的变化较大.切换前原水中特有的细菌包括放线菌门和拟杆菌门,切换后原水特有的细菌除蓝藻门外,还包括厚壁菌门.6个出厂水中的第1优势细菌均为变形菌门,所占比例最高的为 C1,达 95.48%.水源切换前后变形菌门和放线菌门在 6个出厂水中一直存在.此外,蓝藻门细菌在水源切换后的出厂水中均能检测到.
以纲为分类单元分析12个水样的细菌群落结果如图3所示.12个水样中优势细菌覆盖了33个纲,其中相对丰度大于1%的包括10个纲.水源切换前,原水J1和J2中第一优势细菌均为γ变形菌纲(Gammaproteobacteria),相对丰度分别为 27.77%和35.91%,其次为β变形菌纲(Betaproteobacteria)和α变形菌纲(Alphaproteobacteria);水源切换后,原水中第一优势菌为 α变形菌纲,相对丰度达 44.74%~50.55%.水源切换后,原水中未知细菌的比例明显升高,其相对丰度在J5水样中最高,达40.96%.切换前后出厂水中细菌种类和比例变化较小,优势细菌均为α,β和γ变形菌纲.
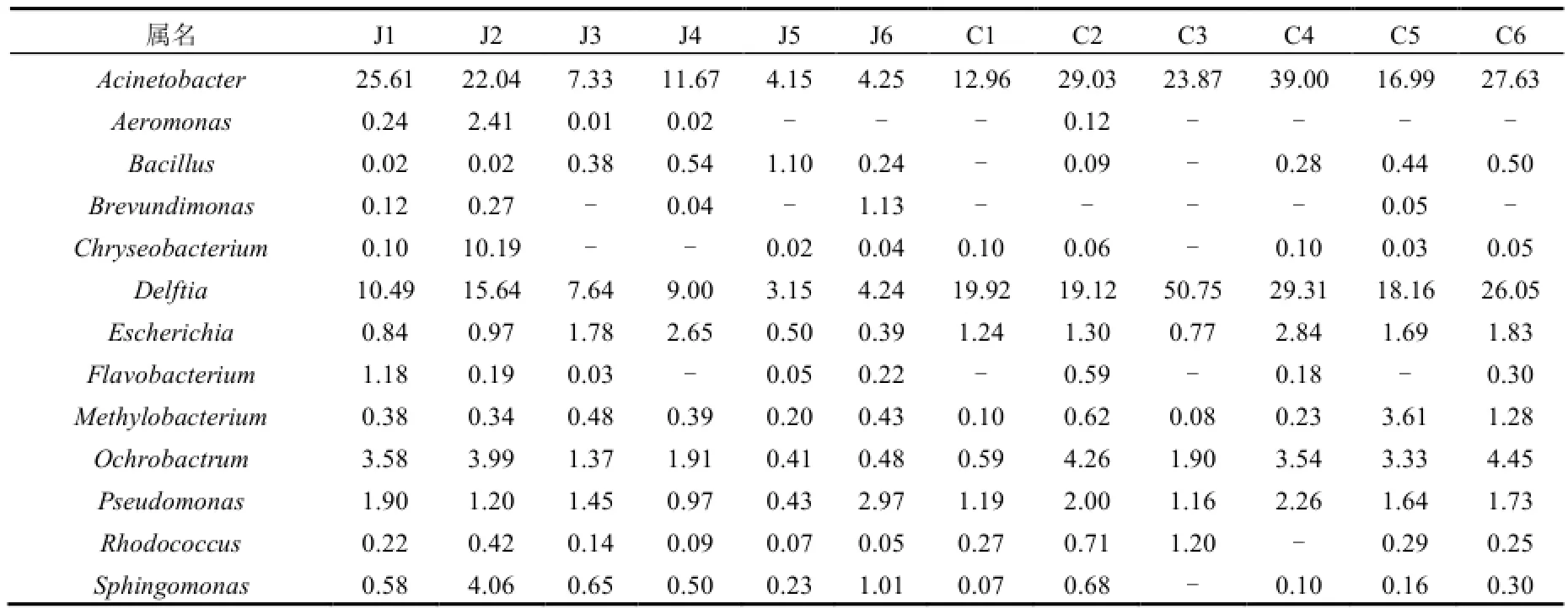
表3 原水和出厂水中潜在病原菌种类及丰度Table 3 Taxonomic composition and relative abundance of potential pathogens in raw water and finished water
2.3水样中潜在病原菌多样性
12个水样中含有的优势潜在病原菌种类和相对丰度见表3.共检测到13种潜在致病菌,其中5种为WHO《饮用水水质准则》中所列出的致病菌[14],分别为不动杆菌(Acinetobacter),气单胞菌(Aeromonas),芽孢杆菌(Bacillus),大肠杆菌(Escherichia)和假单胞菌属(Pseudomonas).在 12个样品中相对丰度最高的潜在致病菌为不动杆菌和代尔夫特菌(Delftia).原水中丰度最高的潜在病原菌为不动杆菌,在J1中占25.61%;出厂水中丰度最高的为代尔夫特菌,在C3中占50.75%,而且这两种菌在出厂水中的含量均显著高于原水(t 检验, p<0.05).其它潜在致病菌数量较少,在出厂水中的比例范围为0.03~4.45%.
2.4水样中细菌群落组成差异分析
采用PCoA分析衡量样本间物种组成的相似度,用加权重(weighted)计算方法获得结果.由图 4可见,12个水样聚类成3个群,52.42%和18.72%的微生物群落差异可以由PCo1轴和PCo2轴解释.水源切换前的两个原水J1和J2距离最近,分布于第四象限,切换后的4个原水J3~J6相似度较高,聚类于第二象限;水源切换对出厂水影响较小,6个出厂水相似度较高,分布于第一象限.
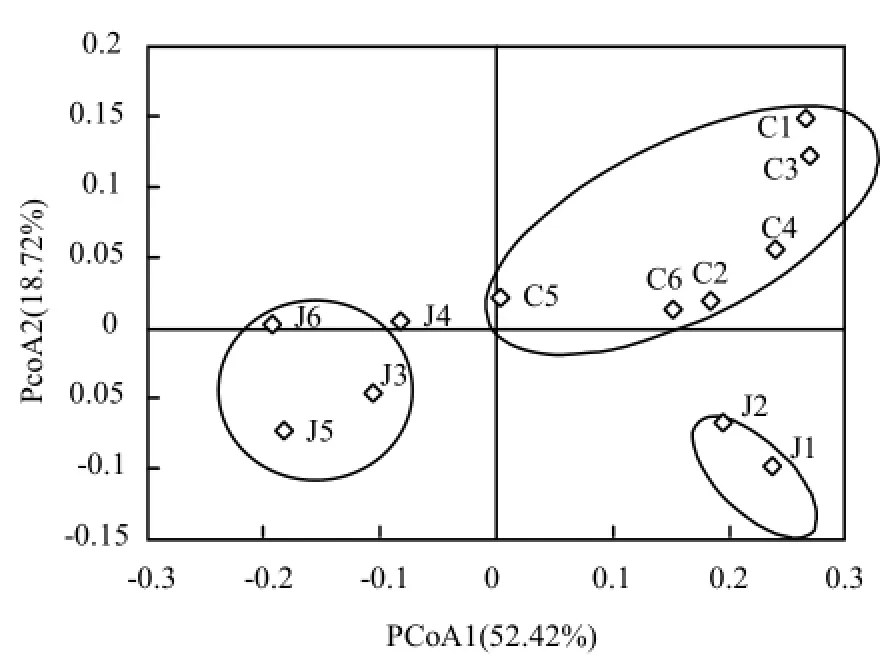
图4 水样细菌群落的主坐标分析Fig.4 Principal coordinates analysis (PCoA) of bacterial communities in water samples
2.5讨论
本研究采用焦磷酸测序技术分析水源切换对水厂出水微生物安全性的影响.新一代测序技术突破了传统微生物分离纯化方法的局限性,能较全面揭示各种生态环境中微生物多样性,目前焦磷酸测序法已成功应用到食品[15],土壤[16],污水[17]和饮用水[18]等领域微生物群落研究中.本文对12个水样的测序覆盖率达到95.86%~98.14%,稀疏曲线也趋于平缓,说明测序深度可以充分的表征样品中细菌的群落结构和多样性,满足对饮用水贫营养环境中细菌群落的研究需求,特别是对数量较少的病原微生物的分析.
通过比较水源切换前后原水中的细菌种群发现,北京水库和河北水库中的微生物群落结构差异明显,存在部分共同的优势菌,但相对丰度不同.原水中的优势菌包括变形菌门和蓝藻门,所占比例最高分别达59.96%和24.23%,这2类细菌均为饮用水系统中的常见菌属[19-20].蓝藻门在切换前的原水中并没有发现,水源切换后的4个原水和 4个出厂水中均检测到不同丰度的蓝藻门细菌,说明本地水库水源中不含有蓝藻门细菌,而在切换后的河北水库水源中蓝藻门细菌所占比例较高.蓝藻在水体中过量增殖可能引发水华,导致水质下降,并且水中藻毒素的含量会升高[21-22],对公众健康产生潜在危害,提示水处理厂在切换为河北水库水源时应注意监测藻类数量,以便及时采取适当处理措施.此外,原水中还发现含有大量无法确定其分类位置的序列,表明原水中存在大量未被认知的细菌类群,其对给水处理系统的影响及病原特征尚有待进一步研究.
对水样中潜在病原菌的分析发现多种致病菌或条件致病菌,如不动杆菌、代尔夫特菌、气单胞菌和芽孢杆菌等,前两者为优势菌.不动杆菌属细菌广泛存在于土壤、淡水及污水环境中, 97%的天然地表水样品中均可分离到该菌,占饮用水样品中HPC菌群的1.0~5.5%[23].该菌为条件致病菌,可引起泌尿道感染、肺炎、菌血症、继发性脑膜炎以及伤口感染,多发于免疫力低下人群,如新生儿和老年人[24].出厂水中的不动杆菌比例较高(12.96%~39%),应引起水厂的关注.
出厂水中另一种优势菌为代尔夫特菌,比例为18.16%~50.75%,但该菌在原水中比例为 3.15%~15.64%,说明该菌在水处理过程中得到了富集和累积.代夫特菌属是1999年建立的一个新菌属,属于变形菌β纲,广泛分布于土壤、水源等自然环境,为少见的人类机会致病菌,主要在免疫力抑制或在侵入性操作时易发生感染.代尔夫特菌属由食酸代夫特菌和 Delftiatsuruhatensis两个菌种组成,后者尚未见分离于临床标本的报道.近年来,食酸代尔夫特菌感染在我国时有发生,可导致肺炎,败血症等[25-26].该菌在饮用水中已被多次发现[9,26].本研究发现的代尔夫特菌包括上述食酸代夫特菌和Delftiatsuruhatensis,相似度最高达到97%.
比较水源切换前后原水和出厂水中细菌群落组成发现,本地水源与河北水源细菌群落结构明显不同,在主坐标图中分为两个群,但出厂水的细菌群落相似度很高,说明原水微生物组成对出厂水影响不大,切换水源后水厂仍能平稳运行.
3 结论
3.1通过对北京某地表水厂水源切换期间的原水和出厂水的分析发现,本地水源与河北水源细菌群落结构明显不同.水处理厂的原水和出厂水中细菌群落具有较高的多样性,分布在7个门,出厂水中细菌多样性显著低于原水.原水和出厂水中优势菌均为变形菌门,包括α,β和γ变形菌纲.此外,切换后的河北水源中优势菌还包括蓝藻门和大量未确定的细菌.
3.2在原水和出厂水中均存在部分致病菌或条件致病菌.其中不动杆菌和代尔夫特菌所占比例较高,增加了饮用水的健康风险,应引起水厂关注以保障饮用水供水安全.
3.3切换水源对水厂原水中细菌群落影响较大,但对出厂水中细菌群落的影响较小,切换前后出厂水的细菌群落相似度较高.在水源切换期间出厂水能维持微生物群落稳定,确保居民用水安全.
[1] Sarin P, Snoeyink V L, Bebee J, et al. Physico-chemical characteristics of corrosion scales in old iron pipes [J]. Wat. Res., 2001,35(12):2961-2969.
[2] Husband P S, Boxall J B. Asset deterioration and discolouration in water distribution systems [J]. Wat. Res., 2011,45(1):113-124.
[3] 王洋,张晓健,陈超,等.水源切换引起给水管网黄水问题原因分析 [J]. 环境科学, 2009,30(12):3555-3561.
[4] Shi B Y, Taylor J S. Iron and copper release in drinking-water distribution systems [J]. J. Environmental Health, 2007,70(2):29-36.
[5] 王研,唐克旺,徐志侠,等.全国城镇地表水饮用水水源地水质评价 [J]. 水资源保护, 2009,25(2):1-4.
[6] 李玉英,高宛莉,王庆林,等.南水北调中线水源区生物监测研究[J]. 安徽农业科学, 2008,36(16):6929-6931.
[7] 祝玲.给水处理中臭氧—活性炭工艺微生物安全性研究 [D].北京:清华大学, 2010.
[8] Liu G, Bakker G L, Li S, et al. Pyrosequencing reveals bacterial communities in unchlorinated drinking water distribution system: an integral study of bulk water, suspended solids, loose deposits, and pipe wall biofilm [J]. Environ. Sci. Technol., 2014,48(10):5467-5476.
[9] Liao X, Chen C, Wang Z, et al. Bacterial community change through drinking water treatment processes [J]. International Journal of Environmental Science and Technology, 2014:1-8. DOI 10.1007/s13762-014-0540-0.
[10] Prest E I, El-Chakhtoura J, Hammes F, et al. Combining flow cytometry and 16S rRNA gene pyrosequencing: A promising approach for drinking water monitoring and characterization [J]. Wat. Rese., 2014,63(10):179-189.
[11] 郭建宁,陈磊,张锡辉,等.臭氧/陶瓷膜对生物活性炭工艺性能和微生物群落结构影响 [J]. 中国环境科学, 2014,(3):697-704.
[12] Lane D J. 16S/23S rRNA sequencing. In Nuecleic acid techniques in bacterial systematics eds. Stackebrandt, E. and Goodfellow, M [M]. Chester, England: John Wiley and Sons., 1991,115-147.
[13] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature Methods, 2010,7(5):335-336.
[14] World Health Organization. Guidelines for drinking water quality. Fourth edition [S]. Geneva, 2001.
[15] Roh S W, Kim K H, Nam Y D, et al. Investigation of archaeal and bacterial diversity in fermented seafood using barcoded pyrosequencing [J]. ISEM Journal, 2010,4(1):1-16.
[16] Buee M, Reich M, Murat C, et al. 454 Pyrosequencing analyses of forest soils reveal an unexpectedly high fungal diversity [J]. New Phytologist, 2009,184(2):449-456.
[17] Ye L, Shao M F, Zhang T, et al. Analysis of the bacterial community in a laboratory-scale nitrification reactor and a wastewater treatment plant by 454-pyrosequencing [J]. Wat. Res., 2011,45(15):4390-4398.
[18] Buse H Y, Lu J R, Lu X X, et al. Microbial diversities (16S and 18S rRNA gene pyrosequencing) and environmental pathogens within drinking water biofilms grown on the common premise plumbing materials unplasticized polyvinylchloride and copper [J]. FEMS Microbiology Ecology, 2014,88(2):280-295.
[19] Henne K, Kahlisch L, Brettar I, et al. Analysis of structure and composition of bacterial core communities in mature drinking water biofilms and bulk water of a citywide network in Germany [J]. Appl. Environ. Microbiol., 2012,78(10):3530-3538.
[20] Westrick J A, Szlag D C, Southwell B J, et al. A review of cyanobacteria and cyanotoxins removal/inactivation in drinking water treatment [J]. Anal. Bioanal. Chemi., 2010, 397(5):1705-1714.
[21] Zamyadi A, Dorner S, Ndong M, et al. Application of in vivo measurements for the management of cyanobacteria breakthrough into drinking water treatment plants [J]. Environmental Science-Processes and Impacts, 2014,16(2):313-323.
[22] Cheung M Y, Liang S, Lee J. Toxin-producing cyanobacteria in freshwater: A review of the problems, impact on drinking water safety, and efforts for protecting public health [J]. Journal of Microbiology, 2013,51(1):1-10.
[23] Narciso-da-Rocha C, Vaz-Moreira I, Svensson-Stadler L, et al. Diversity and antibiotic resistance of Acinetobacterspp. in water from the source to the tap [J]. Applied Microbiology and Biotechnology, 2013,97(1):329-340.
[24] 胡子鉴.不动杆菌属感染的研究进展 [J]. 医学综述, 1999, 5(1):3-5.
[25] 季宝建,曹德生,于小汇.代尔夫特食酸菌引起肺部感染合并血液感染1例 [J]. 中国实用医药, 2011,10:189.
[26] 汪铮,李秀,许友松,等.科泽氏枸橼酸杆菌和代尔夫特食酸菌(食酸丛毛单胞菌)肺部感染1例 [J]. 临床肺科杂志, 2013,9:1742-1743.
[27] Pindi P K, Yadav P R, Shanker A S. Identification of opportunistic pathogenic bacteria in drinking water samples of different rural health centers and their clinical impacts on humans [J]. Biomed. Research International, 2013,348250.
Effect of water switch on the bacterial community structure of finished water in a drinking water treatment plant.
ZHANG Ming-lu1,2, LIU Wen-jun2*, LI Cui-ping2, LI Yu-xian3, GU Jun-nong3(1.Department of Environmental Science and Engineering, Beijing Technology and Business University, Beijing 100048, China;2.School of Environment, Tsinghua University, Beijing 100084, China;3.Water Quality Monitoring Center, Beijing Waterworks Group, Beijing 100031, China).
China Environmental Science, 2015,35(8):2517~2522
To evaluate the microbial safety during the source water switch in a drinking water treatment plant in Beijing, bacterial community compositions and potential pathogensin the raw water and finished water were analyzed by pyrosequencing. The bacterial diversity of finished water was significantly lower than raw water. Proteobacteria were observed as one of the most dominant populations both in raw water and finished water, ranging from 11.99% to 95.48%. Alphaproteobacteria, Betaproteobacteria and Gammaproteobacteria dominated in this group. However, the relative abundance varied in raw water and finished water. Cyanobacteria were found in raw water and finished water after water switch. Several potential pathogens were detected in the finished water and the majorbacteria were Acinetobacterand Delftia. The occurrence of pathogens was associated with increased health risk. PCoA results showed that bacterial community structure in raw water before switch was significantly different from that after water switch, but water switch had little effect on the bacterial composition of finished water. The water treatment plant operated stably during water switch.
water switch;microbial safety;pyrosequencing;pathogen
X52,R123
A
1000-6923(2015)08-2517-06
2015-02-05
国家水专项(2012ZX07404002);国家自然科学基金资助项目(51408010)
* 责任作者, 教授, wjliu@tsinghua.edu.cn
张明露(1982-),女,黑龙江哈尔滨人,讲师,博士,主要从事饮用水的微生物安全研究.发表论文10余篇.
