三峡大坝建成后长江河流表层沉积物中有机物组成与分布特征
2015-08-25马倩倩华东师范大学河口海岸国家重点实验室上海0006东莞星火教育科技有限公司广东东莞53000
马倩倩,魏 星,吴 莹*,张 经(.华东师范大学,河口海岸国家重点实验室,上海 0006;.东莞星火教育科技有限公司,广东 东莞 53000)
三峡大坝建成后长江河流表层沉积物中有机物组成与分布特征
马倩倩1,魏星2,吴莹1*,张经1(1.华东师范大学,河口海岸国家重点实验室,上海 200062;2.东莞星火教育科技有限公司,广东 东莞 523000)
利用气相色谱法对2009年长江河流(干流和主要支流)表层沉积物样品中的正构烷烃(n-alkanes)和脂肪酸(fatty acids)进行测定和分析,结合粒度、OC%、δ13C等参数,研究样品中有机质的组成和分布特征,并对其来源及影响因素,特别是三峡大坝对其的影响进行了初步分析.结果显示,长江表层沉积物粒度组成主要以粉砂(45.8%)和砂(41.4%)为主,OC%值为0.08~1.99%, OC 的δ13C值为-31.9‰~-21.4‰.正构烷烃含量以干重计为0.71~13.69 μg/g,以OC计为0.05~1.99mg/g.脂肪酸含量以干重计为2.77~32.52μg/g,以OC计为0.16~40.58mg/g,其中饱和脂肪酸含量最多,含量最少的是支链脂肪酸.水动力分选、粒径是控制支流沉积有机质含量与分布的重要因素.干流中下游较上游具有丰富的水生植物源贡献,并且降解程度低.三峡大坝对陆源有机质的输送和改造具有重要影响.
长江流域;表层沉积物;正构烷烃;脂肪酸
河流是连接陆地与海洋的枢纽,是物质从陆地向海洋输送的重要途径[1].研究表明,每年通过河流向海洋输送的碳通量约为 0.9×1015gC/a,其中有机碳占 40%[2].因此研究河流体系中有机质的含量以及分布,对于揭示全球碳循环具有至关重要的作用[3].另一方面,考察人类活动对有机物迁移输送的影响,河流是重要的研究区域.长江作为中国第一大河,对其表层沉积物中有机质含量及分布的研究,有助于了解长江流域的物质循环特征,也可以为区域碳循环及人类活动对生物地球化学循环的影响研究提供重要信息.三峡大坝工程意义深远,对区域有机碳循环有显著的影响.由于其建成时间较短,对这些影响研究仍处于起步阶段.
研究区域有机碳的地球化学循环,生物标志物示踪法是常用的方法.正构烷烃和脂肪酸是有机地球化学研究中常用的生物标志物.根据它们的含量及组成情况可以追踪有机质的来源,了解其迁移、转化和循环过程.另一方面,这些生物标志物的组成与分布特征可以有效反映研究区域的生态环境状况[4].正构烷烃普遍存在于各种地质体中,其组成可以用来进行物源区分[5].脂肪酸是构成生物体的主要有机成分之一,某些特殊的脂肪酸成分具有高度的生物专一性,因而也可以用来判断沉积物中有机质的来源[6].近些年来,国内外许多地球化学家利用脂肪酸和正构烷烃进行物源示踪,在湖泊[7]、河流[8]和海洋[9]等区域对有机碳循环进行了广泛的研究,但在长江流域,仅有对溶解态和颗粒态中脂肪酸和正构烷烃的研究[10-11],对表层沉积物的研究尚未见报道.
本文对长江河流中表层沉积物的正构烷烃和脂肪酸组成、分布等特征,特别是脂类化合物的含量和组成进行了研究,着重分析了沉积物中脂类生物标志物的含量和组成特征,结合基本地球化学参数,探讨了长江不同区域沉积物中有机质的含量和组成特征,旨在表征长江流域有机物来源并探讨三峡大坝对沉积有机质分布的影响,丰富长江流域有机碳循环的相关认知.
1 材料与方法
1.1样品采集
长江表层沉积物样品采集于 2009年 9~10 月,从 3200km左右的上游一直延伸到下游的徐六泾区域(101.7°E~121.1°E,26.1°N~33.0°N),共22个站位(包括长江干流、南、北部主要支流),采样站位如图1所示.表层沉积物样品采用抓泥斗法采集,样品采集后移取至自封袋内,赶掉空气后立即在-20℃冷冻保存,直至在实验室分析.
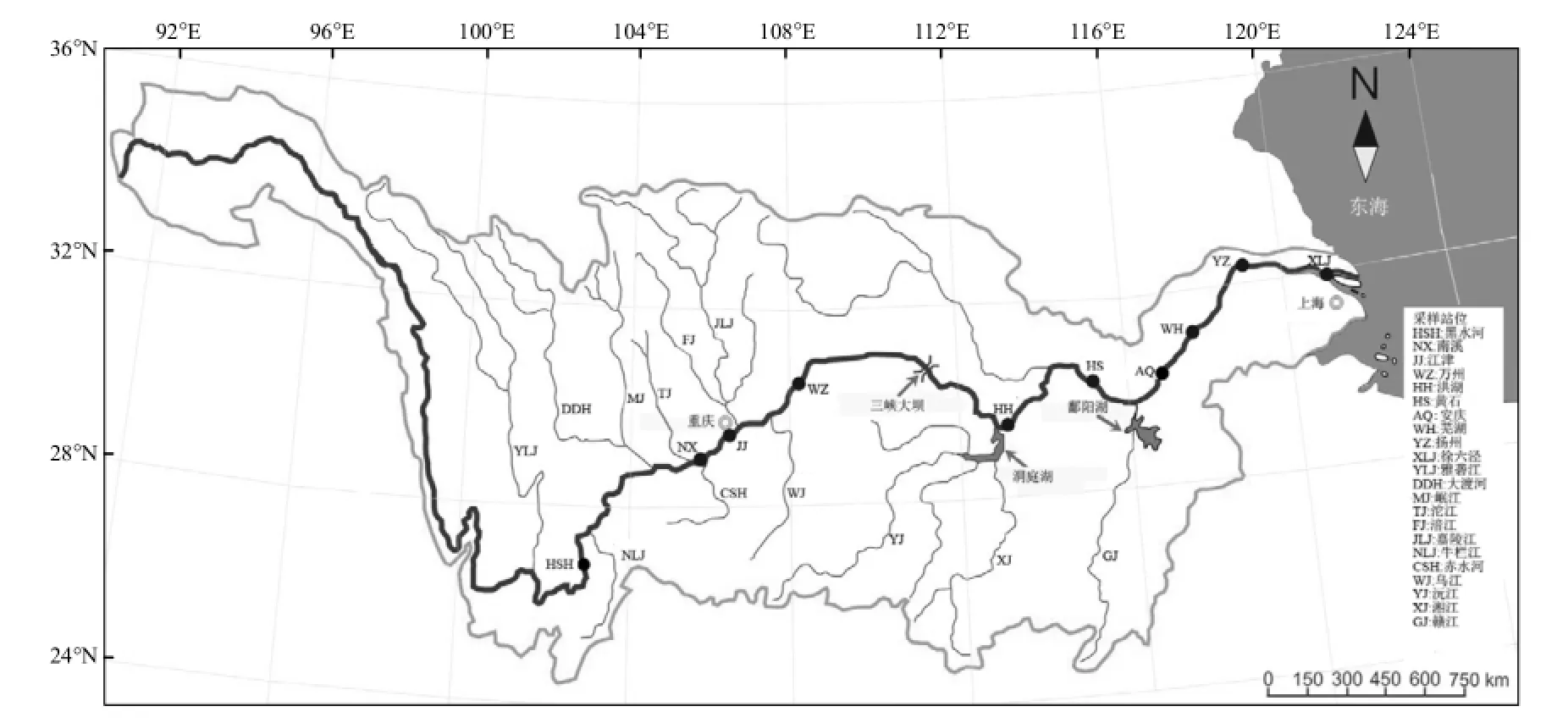
图1 长江流域采样站位Fig.1 Sample stations of sediment matter
1.2基本参数测定(粒度、OC%、TN%和δ13C)
沉积物样品在实验室烘干,其中一小部分直接用于粒度测定.粒度使用 LS100Q粒度仪进行测定[12].另一部分样品进行研磨、过筛,取适量用元素分析仪(Vario EL Ш)测定总氮(TN),分析精度为±8%;测定有机碳及碳同位素样品,用1mol/LHCl酸化12h,去除无机碳后,进行干燥、包样,用Delta plus XP稳定同位素质谱仪(GF-IRMS)测定 OC%和 δ13C,OC%的相对标准偏差<5%,δ13C的分析精度为±0.2‰.
1.3生物标志物测定(正构烷烃和脂肪酸)
称取适量干燥研磨后的沉积物样品,以CH2Cl2/CH3OH(2:1,V/V)混合溶液为萃取剂,用微波消解法进行消解.消解后的样品经过离心将固液分离,并重复此过程四遍,将收集到的上清液旋转浓缩至近干,然后向浓缩后的总脂样品中加入1mol/L的KOH /CH3OH溶液,70ºC下皂化2h.冷却后用正己烷萃取6次,分层后取上层液体进行旋转蒸发浓缩,用硅胶柱净化分离,用正己烷淋洗得到正构烷烃样品.余下的下层溶液(酸性部分,含脂肪酸)用浓盐酸调节至 pH=2,用正己烷萃取6次,然后加入5% HCl-MeOH,70℃避光加热12h进行甲酯化反应.甲酯化完成后冷却至室温,用正己烷萃取,氮气吹扫浓缩,加入定量内标 C19:0脂肪酸甲酯,用气相色谱测定.实验中用到的所有玻璃仪器均事先在酸缸中浸泡48h, MilliQ水清洗干净后,在马弗炉中500℃灼烧5h.硅胶柱中所用的硅胶在烘箱中150℃烘烤48h,按95g硅胶加入5mL水的比例加入MilliQ水活化,充分摇匀,在正己烷中保存.正构烷烃与脂肪酸均采用Varian3800气相色谱分析,具体色谱条件和升温程序详见孙蕴婕(2011)[13].
2 结果与讨论
2.1基本参数(粒度、OC%、TN%、C/N和δ13C)根据长江流域的地理特征,将研究区域划分为四个部分,分别为长江干流的上游 (图 1中南溪、江津、万州站位)、长江干流的中下游(图1中洪湖、黄石、安庆、芜湖、扬州、徐六泾站位)、长江北部支流(图1中雅砻江、黑水河、大渡河、岷江、沱江、涪江、嘉陵江站位)、长江南部支流(图1中牛栏江、赤水河、乌江、沅江、湘江、赣江站位).

表1 研究区域不同位置的物理化学基本参数Table 1 physical and chemical parameters from the different sites of the study area
颗粒物的粒径大小是控制有机物含量高低的重要因素[14],长江表层沉积物样品粒径以粉砂和砂为主,粉砂的平均百分含量为 45.8%,砂的平均百分含量为 41.4%,黏土的百分含量只为12.8%.在长江主流中下游洪湖、黄石和芜湖均发现平均中值粒径大于130μm.由表1可知,长江不同区域的粒径分布有差异,干流上游的粒径明显低于中下游,南部支流的粒径低于北部支流.
表层沉积物OC%的范围为0.08%~1.99%,平均值为 0.62%,最大值和最小值分别出现在南部支流的赣江站和长江干流下游的黄石站.由表 1可知,干流上游表层沉积物 OC%为(0.46±0.31),高于中下游的(0.37±0.32),这是由于表层沉积物中的有机质大多来自于沿岸土壤的贡献[15].与此同时,长江南部支流的 OC%值要高于北部支流,与于灏等[15]对长江干流沿岸土壤以及南北支土壤的研究结果一致.样品的总氮含量(TN%)范围较广(0.003%~0.159%),平均值是0.06%,与OC有着较好的正相关关系(R2=0.90,P<0.01),表明沉积物中OC和TN的来源可能是一致的.
根据沉积物中的C/N值可以区分有机物的来源,C/N值为 5~7时,表示有机质来自于藻类;C/N值>15时,表示有机质来自于陆源高等植物[16].在本研究中,样品的C/N值在6.3~16.7之间,平均值为10.5,较高的C/N值表明,陆地高等植物是沉积有机质的主要来源.南部支流的C/N值显著高于北支,这是因为南部支流所属区域大都气候温暖湿润,植被覆盖率高,陆地植物对沉积物的贡献较多.
由于陆地植物和海洋浮游植物利用大气中的二氧化碳进行光合作用合成新的有机碳途径上的不同,造成陆源生物和海源生物碳稳定同位素(δ13C)组成上的差异.一般来说,海源δ13C值为-19‰~-21‰,陆源 C3植物的 δ13C值范围为-25‰~-28‰[1],淡水浮游植物相对陆地 C3植物而言具有更加偏负的碳同位素值(δ13C为 -30‰~-40‰)[17],而 C4植物(玉米、甘蔗、高粱等)较偏正为-9‰~-16‰,平均值是-13‰[18].在本研究中,赣江站位的δ13C值最偏负,为-31.8‰,结合其较高的 OC含量(~ 2%),推测浮游植物是该站位有机质的主要来源;大渡河站位的δ13C值为-21.41‰,是本次观测中最为偏正的值;其他站位的δ13C值多在-23.19‰~-24.77‰之间,差别不大.整体而言,陆地 C3植物是长江流域表层沉积有机质的主要来源.与世界其他河流沉积物的 δ13C相 比 ,如Yenisei River(-26.5‰~-27.4‰)[19], Mackenzie River (-26.2‰~-26.9‰)[20],长江流域的δ13C值较为偏正.这一现象也同样出现在珠江三角洲(-22.6‰~-24.2‰)和 Mississippi River(-19.7‰~-21.7‰),这可能是由于来自陆地上 C4植物碎屑和 C3植物碎屑的混合所致[21-22].除此之外,研究表明土壤有机质及化肥等肥料也是导致农耕区域样品δ13C偏正的原因[23-24].Yu[22]对珠江三角洲及珠江口表层沉积物的研究表明,较偏正的δ13C值一方面是由于农业的输入,另一方面是由于随着流域城市化、工业化以及开垦回收的迅速发展所带来的人为影响增加.因此,长江河流沉积物样品整体较为偏正的δ13C值也可能与这两方面因素有关.
2.2沉积物中的正构烷烃
样品中的正构烷烃(碳数范围为 C14~C36)以沉积物干重计浓度范围为 0.71~13.69μg/g,平均值是5.27μg/g.以OC计为0.05~1.99mg/g,平均值是 1.08mg/g.长江流域沉积物中的正构烷烃含量总体来说比西伯利亚的 Yenisei River低(3~17μg/g)[19],但比日本的 Shinano River高(0.16~3.53μg/g)[25].样品中总正构烷烃浓度的最大值和最小值分别出现在北支上游的沱江站(13.69μg/g)和干流中下游的芜湖站(0.71μg/g).
所有样品的正构烷烃主峰碳为C16或C18、C29或C31.正构烷烃的峰群分布类型可分为三类:第一类是单峰型,指示现代陆源沉积物,以C29或C31为主峰碳;第二类是双峰型,指示正构烷烃以陆源和水体自生源的混合来源类型,前峰群在C14~C21,主峰碳为 C16或 C18,后峰群在 C25~C36,主峰碳为C29或C31;第三类也是单峰型,主峰碳为C16或C18.在本研究中,大部分样品归于上述前两类.此外,部分样品的色谱图中还有一类称为不溶复杂有机混合物 UCM(Unresovlved complex mixture),是化石燃料燃烧产物中常见的组分,主要由高度支链化的烷烃和环烷烃组成,在烷烃气相色谱图中表现为基线隆起的鼓包[26].在本研究中,许多站位(如万州、扬州、徐六泾等)的样品气相色谱图中均有 UCM组分存在,这与长江流域(尤其是中下游区域)常年通航,导致化石燃料排放到江中所致有关.
正构烷烃的特征指数 L/H,即短链正构烷烃与长链正构烷烃含量的比值.藻类、浮游植物和石油源产品的L/H值一般为1.0,而沉积细菌、海水、海洋动物、高等植物的比值较低[27].在本研究中,所有站位的L/H值(除DDH站)都小于0.8,平均值约为0.53(如图2所示),表明以陆源高等植物的输入为主.
碳优势指数(CPI)是正构烷烃中最常用的一项指标.一般来说,中短链(C15~C21)正构烷烃来源于藻类等水生浮游生物,且以 C15或 C17为主,没有明显的奇偶优势,CPI1值应接近于1.然而,长江河流大部分沉积物样品的中短链正构烷烃的碳优势指数 CPI1值都非常小,平均值约为 0.27(图2),表明短链正构烷烃具有明显的偶碳优势,这与前人对海洋和淡水沉积物中正构烷烃特征的研究结果不同.有研究认为这种特征是由于样品中具有各种各样的生物来源,包括浮游生物、微生物以及新产生的生物源脂肪酸或其他脂类物质[28].其中,微生物输入被认为是造成低碳数正构烷烃分布不寻常的主要原因[29-31].一般来说,海洋沉积物中C12-C22正构烷烃的偶碳优势主要原因可能是藻类、细菌、真菌和酵母菌的生物源贡献[29-30],也可能是由于原油污染所致[32].实际上,中短链正构烷烃偶碳优势的现象在我国的一些研究区域,如长江口[33]、黄海[9]中等已有报道.

图2 长江流域沉积物中正构烷烃及其特征指数Fig.2 Ratios of L/H、CPI1and CPI2of n-alkanes in sediment of the Yangtze river basin
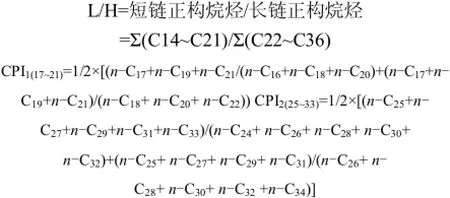
CPI2值也是表征正构烷烃来源的一种常用指标.一般来说,来源于维管束植物的正构烷烃CPI2值为2~6[34],较低的CPI2值常被认为与沉积物中细菌等微生物来源、有机质再生产或者船舶泄漏引起的化石燃料污染有关[35].长江河流表层沉积物样品中的CPI2值,芜湖站和大渡河站的值较小,接近于 1,其中芜湖站由于常年通航使得化石燃料污染严重导致其值较小,而大渡河站由于水体常年处于静水状态使得沉积物中细菌等微生物含量较高导致其值偏小.除此之外,雅砻江站位的CPI2值较高为9.89,其余大都在2~6之间(图2),平均值为2.74.这样的CPI2值显示长江河流表层沉积物样品中的长链正构烷烃主要来源于陆地高等植物,其次是细菌源及化石燃料贡献.
2.3沉积物中的脂肪酸
通过气相色谱检测出了链长在 C4~C30的脂肪酸,多数站位的C4和C6脂肪酸含量极低而未检出,C8、C10的含量也很低.样品中的脂肪酸浓度变化幅度较大,以沉积物干重计浓度范围为2.77~32.52μg/g,平均值为 13.63μg/g,最大值和最小值分别出现在扬州站和大渡河站.以 OC计为0.16~40.58mg/g,平均值为 5.19mg/g.长江干流下游脂肪酸浓度要高于上游,其值分别为 20.44± 10.29μg/g和12.28±11.19μg/g;北部支流的总脂肪酸浓度(10.42±4.76μg/g)比南部支流(10.94± 4.62μg/g)略小.表层沉积物的脂肪酸谱图各站位主峰都是C16:0,这主要是因为C16:0是很多有机组织如浮游植物和高等植物[36]的主要组成成分.另外主要来源于硅藻和蓝藻的C16:1n7、褐藻的C18:1n9和陆源植物的C18:2n6含量也很高.
根据来源的不同,脂肪酸常被分为以下类别[37]:(1)、陆生植物:长链饱和脂肪酸 LCSFA (C≥22);(2)、浮游生物和细菌:短链饱和脂肪酸SCSFA(C<22);(3)、细菌源:支链脂肪酸(异构和反异构C15和C17脂肪酸)及18:1n7;(4)、藻类和浮游动物:单不饱和脂肪酸MUFA;(5)、浮游生物产生不稳定的或新鲜有机质:多不饱和脂肪酸PUFA.从长江表层沉积物的脂肪酸组成类别来看,饱和脂肪酸SFA是脂肪酸组分中含量最多的,约占脂肪酸总量的 70.5%±9.5%,其中短链脂肪酸 SCSFAs多于长链脂肪酸 LCSFA(46.2%± 9.4%,24.3%±14.3%),表明水体自生源(浮游生物和细菌)是大多数站位脂肪酸的主要来源,陆地高等植物次之.单不饱和脂肪酸MUFA普遍存在于浮游动物、藻类、细菌和底栖真菌中[38],所以其所占总脂肪酸浓度的比例也较高,为 11.9%± 4.9%;多不饱和脂肪酸和细菌脂肪酸所占总脂肪酸的比例分别为5.4%±4.6%,2.1%±0.1%.

图3 长江流域表层沉积物脂肪酸组成主成分分析的因子载荷Fig.3 Plots of loadings of factor1, and factor2from principal component analysis for fatty acids of the surface sediment in Yangtze river basin. Abbreviations and sources of each compound are in table 2
利用SPSS16.0软件对各站位脂肪酸含量进行了主成分分析(PCA),如图 3所示.factor1和factor2共占所有变量的 67%,其中 factor1占46%,C14:0,C16:1n7和硅藻标志性脂肪酸 C20:5n3对factor1的贡献较大,除了C18:2n6,其余脂肪酸都与 Factor1呈正相关;C12:0,C18:2n6, LCFAs对 factor2的贡献较大,大部分脂肪酸与Factor2呈正相关,而 C20:5n3、C22:6n3和C16:1n7与Factor2呈负相关(图4).Factor1表征的可能是浮游植物和水体碎屑贡献,特别是硅藻;Factor2 表征的可能是陆地植物输入的影响.
2.4水动力作用等对长江流域沉积有机质的影响
沉积物粒径大小是控制有机质含量高低的重要因素,颗粒物粒径越小,黏土百分含量越高,颗粒物的比表面积就越大,因而能吸附的有机质含量就越多,也更利于有机质的保存[14].沉积物中的有机质在通过河流向远处输送过程中,由于河流地形地势、水位落差以及地貌等不同的因素作用,通过水动力分选作用,沉积物中的颗粒物由于粒径大小不同而被分选开.在本研究中,沉积物中的有机碳含量、总正构烷烃含量以及总脂肪酸含量与黏土百分含量呈很好的正相关关系(图4a、4b、4c),这表明在长江流域沉积物的粒径大小是控制流域沉积有机质含量高低的重要因素.
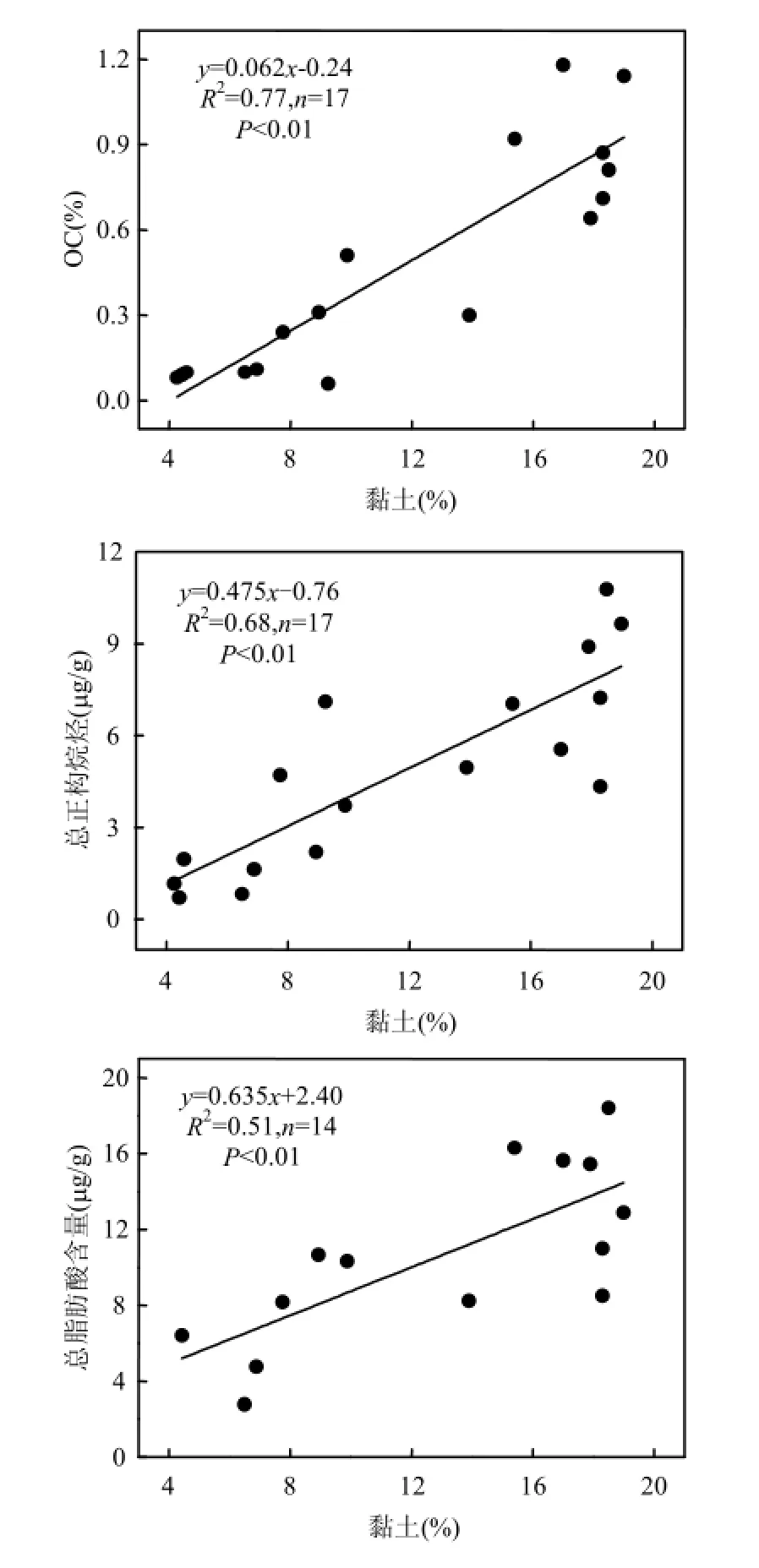
图4 黏土百分含量与有机碳量(OC%)(a),正构烷烃含量(b),脂肪酸含量(c)的相关性Fig.4 The ratio of Clay% verse OC%(a)、Total n-alkanes (b),and Total FA(c)
有研究表明:三峡水库蓄水以来,沉积物粗化现象自大坝下可延伸至城陵矶(离大坝约300km)[39],因此在有机质成分上,受粒度控制中下游样品总有机碳的含量比较低.同时,表征陆源输送的长链正构烷烃在中游有最低值出现.粒度粗化的第二个可能原因是中下游采砂的生产活动,从正构烷烃的CPI值普遍较低(如芜湖站),以及细菌改造明显来看,这可能与受到采砂生产的扰动有关.从脂肪酸及其正构烷烃与黏土成分关系的离散度来分析,正构烷烃具有更好的相关性,可能与正构烷烃较脂肪酸更为稳定有关,从侧面指示沉积物中有机质经历了一定的降解过程.
2.5长江干流陆源有机质的降解和转化
正构烷烃中的Paq参数可以用来区分陆源中的水生植物和陆生植物[40-41],主要是依据沉水和浮水大型植物常富含较多的C23和C25正构烷烃,而挺水大型植物和陆生植物中的长链正构烷烃则相对较丰富.Paq值定义如下:
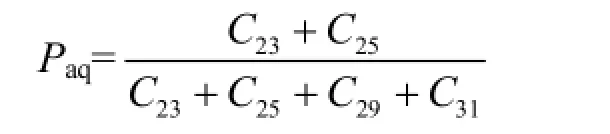
典型陆生植物的 Paq值为 0.09,大型挺水植物为 0.25,大型沉水/浮水植物为0.69[40].由图 5a所示,长江干流上游样品的 Paq值总体要低于中下游样品.而长江中下游站位较高的 Paq值表明该区域水生植物较为丰富,且以挺水植物为主,对沉积有机质的贡献也较大.

图5 长江干流表层沉积物样品的正构烷烃参数Paq值(a)和长链正烷酸/长链正构烷烃值(b)沿着长江水流方向变化趋势(图中距离为0处为徐六泾)Fig.5 Spatial distribution of Paq(a)and HMW n-alkanoic acids/HMW n-alkanes (b) along the Changjiang WaterMass (Distance epual to 0 is XuliuJing)
长链正烷酸(HMW n-alkanoic acids)(链长在C20~C30之间的正脂肪酸之和)与长链正构烷烃(HMW n-alkanes)(链长C20~C30之间的正构烷烃之和)的比值可用来表征陆源有机质的降解程度[41-42],该比值越小,所表征的陆源有机质的降解程度则越高.由图 5b可知,长江干流表层沉积物中,上游站位样品的比值沿着径流方向逐渐减小,表明陆源有机质的降解程度逐渐增高;而与此相对,中下游站位样品的比值沿着径流方向逐渐增大,表明陆源有机质的降解程度逐渐较小,这与中下游区域来自于支流以及人为输入的新鲜有机物的贡献有关.靠近三峡大坝的万州(WZ)和洪湖(HH)站位的比值最小,这是由于三峡大坝的蓄水作用,使得库区的微生物有足够的时间对陆源有机物进行降解,而经高度降解的有机物通过三峡大坝后依然保持原有信号,表明三峡大坝对有机物的改造和输送具有重要影响,在长江流域的有机质“源”和“汇”方面发挥着重要作用.
3 结论
3.1长江流域不同地理区域样品的基本物理化学特征是有差异的:干流上游的OC%、正构烷烃和脂肪酸含量均比干流中下游站位高,南部支流比北部支流高.
3.2陆源是整个长江有机质的主要来源,对有机质的组成与分布影响较大,此外,长江常年通航带来的石油化石燃料污染也是影响有机物组成与分布的重要因素.
3.3粒径是长江河流中沉积有机质含量高低的主要影响因素,采砂的影响需要进一步考证.
3.4长江干流中下游的表层沉积物较上游拥有较丰富的水生植物源,降解程度低.三峡大坝对陆源有机质的改造和输送具有影响,表现在近大坝样品的降解程度高,同时坝后沉积物的粗化使得沉积物含量及其降解指数明显有别于周边站位.
[1] Hedges J I, Keil R G, Benner R. What happens to terrestrial organic matter in the ocean? [J]. Organic Geochemistry, 1997, 27(5/6):195-212.
[2] Meybeck M. Riverine transport of atmospheric carbon: Sources, global typology and budget [J]. Water, Air, & Soil Pollution, 1993, 70(1-4):443-463.
[3] Cole J J, Prairie Y T, Caraco N F, et al. Plumbing the global carbon cycle: Integrating inland waters into the terrestrial carbonbudget [J]. Ecosystems, 2007,10(1):172-185.
[4] O'Reilly S S, Szpak M T, Flanagan P V, et al. Biomarkers reveal the effects of hydrography on the sources and fate of marine and terrestrial organic matter in the western Irish Sea [J]. Estuarine, Coastal and Shelf Science, 2014:157-171.
[5] 吴莹,张经.类脂分子标志物在海洋有机地球化学中的研究应用 [J]. 海洋环境科学, 2001,20(1):71-77.
[6] Carrie R H, Mitchell L, Black K D. Fatty acids in surface sediment at the Hebridean shelf edge, west of Scotland [J]. Organic Geochemistry, 1998,29(5-7):1583-1593.
[7] Poerschmann J, Koschorreck M, Górecki T. Organic matter in sediments of an acidic mining lake as assessed by lipid analysis. Part I: Fatty acids [J]. Science of the Total Environment, 2012,414: 614-623.
[8] Oliveira D R P, Cordeiro L G M S, Carreira R S. Characterization of organic matter in cross-margin sediment transects of an upwelling region in the Campos Basin (SW Atlantic, Brazil) using lipid biomarkers [J]. Biogeochemistry, 2013,112(1/3):311-327.
[9] Hu L, Shi X, Guo Z, et al. Sources, dispersal and preservation of sedimentary organic matter in the Yellow Sea: The importance of depositional hydrodynamic forcing [J]. Marine Geology, 2013, 335:52-63.
[10] 戚艳平.长江及其邻近海域中颗粒态及溶解态正构烷烃的分布[D]. 上海:华东师范大学, 2006.
[11] Ying W, Jing Z, Sumei L, et al. Particulate n-alkanes and fatty acids in the ChangJiang river system [J]. Acta Oceanologica Sinica, 2007,26(2):36-48.
[12] 宋兵,李珍,李杰,等.越南红河水下三角洲北区表层沉积物类型及分布特征初探 [J]. 海洋通报, 2009,28(6):78-83.
[13] 孙蕴婕,吴莹,张经.海南八门湾红树林柱状沉积物中有机生物标志物的分布和降解 [J]. 热带海洋学报, 2011,30(2):94-101.
[14] Keil R G, Tsamakis E, Giddings J C, et al. Biochemical distributions (amino acids, neutral sugars, and lignin phenols) among size-classes of modern marine sediments from the Washington coastal [J]. Geochimica et Cosmochimica Acta, 1998, 62(8):1347-1364.
[15] 于灏,吴莹,张经,等.长江流域植物和土壤的木质素特征[J]. 环境科学学报, 2007,27(5):817-823.
[16] Meyers P A. Organic geochemical proxies of paleoceanographic, paleolimnlogic and paleclimatic processes [J]. Organic Geochemistry, 1997,27:213-250.
[17] Onstad G D, Canfield D E, Quay P D, et al. Sources of particulate organic matter in rivers from the continental usa: lignin phenol and stable carbon isotope compositions [J]. Geochimica et Cosmochimica Acta, 2000,64(20):3539-3546.
[18] Pancost R D, Boot C S. The palaeoclimatic utility of terrestrial biomarkers in marine sediments [J]. Marine Chemistry, 2004, 92(1-4):239-261.
[19] Fernandes M B, Sicre M A. The importance of terrestrial organic carbon inputs on Kara Sea shelves as revealed by n-alkanes, OC and d13C values [J]. Organic Geochemistry, 2000,31(5):363-374.
[20] Goñi M A, Yunker M B, Macdonald R W, et al. Distribution and sources of organic biomarkers in arctic sediments from the Mackenzie River and Beaufort Shelf [J]. Marine Chemistry, 2000, 71(12):23-51.
[21] Goñi M A, Yunker M B, Macdonald R W, et al. Distribution and sources of organic biomarkers in arctic sediments from the Mackenzie River and Beaufort Shelf [J]. Marine Chemistry, 2000, 71(12):23-51.
[22] Yu F, Zong Y, Lloyd J M, et al. Bulk organic δ13C and C/N as indicators for sediment sources in the Pearl River delta and estuary, southern China [J]. Estuarine, Coastal and Shelf Science, 2010,87(4):618-630.
[23] O'Leary M H. Carbon isotope fractionation in plants [J]. Phytochemistry, 1981,20(4):553-567.
[24] Hedges J I, Oades J M. Comparative organic geochemistries of soils and marine sediments [J]. Organic Geochemistry, 1997, 27(7/8):319-361.
[25] Hori T, Shiota N, Asada T, et al. Distribution of polycyclic aromatic hydrocarbons and n-Alkanes in surface sediments from Shinano River, Japan [J]. Bulletin of Environmental Contamination and Toxicology, 2009,83(3):455-461.
[26] Almeida Azevedo D D, Silveira Moreira L, Soares De Siqueira D. Composition of extractable organic matter in aerosols from urban areas of Rio de Janeiro city, Brazil [J]. Atmospheric Environment, 1999,33(30):4987-5001.
[27] Chandru K, Zakaria M P, Anita S, et al. Characterization of alkanes, hopanes, and polycyclic aromatic hydrocarbons (PAHs) in tar-balls collected from the East Coast of Peninsular Malaysia[J]. Marine Pollution Bulletin, 2008,56(5):950-962.
[28] Lu Y, Meyers P A. Sediment lipid biomarkers as recorders of the contamination and cultural eutrophication of Lake Erie, 1909-2003 [J]. Organic Geochemistry, 2009,40(8):912-921.
[29] Nishimura M, Baker E W. Possible origin of n-alkanes with a remarkable even-to-odd predominance in recent marine sediments [J]. Geochimica et Cosmochimica Acta, 1986,50(2):299-305.
[30] Grimalt J, Albaigés J. Sources and occurrence of C12 C22nalkane distributions with even carbon-number preference in sedimentary environments [J]. Geochimica et Cosmochimica Acta, 1987,51(6):1379-1384.
[31] Volkman J K, Barrett S M, Blackburn S I, et al. Microalgal biomarkers: A review of recent research developments [J].Organic Geochemistry, 1998,29(5-7):1163-1179.
[32] Harji R R, Yvenat A, Bhosle N B. Sources of hydrocarbons in sediments of the Mandovi estuary and the Marmugoa harbour, west coast of India [J]. Environment International, 2008,34(7):959-965.
[33] Qiu Y J, Bigot M, Saliot A. Non-aromatic hydrocarbons in suspended matter from Changjiang (Yangtse River) estuary: Their characterization and variation in winter and summer (low- and high-flow) conditions [J]. Estuarine, Coastal and Shelf Science, 1991,33(2):153-174.
[34] Rieley G, Collier R, Jones D, et al. Sources of sedimentary lipids deduced from stable carbon-isotope analyses of individual compounds [J]. Nature, 1991,352(6334):425-427.
[35] Fang J, Wu F, Xiong Y, et al. Source characterization of sedimentary organic matter using molecular and stable carbon isotopic composition of n-alkanes and fatty acids in sediment core from Lake Dianchi, China [J]. Science of The Total Environment, 2014,473-474:410-421.
[36] Quéméneur M, Marty Y. Fatty acids and sterols in domestic waste waters [J]. Water Research, 1994,28(5):1217-1226.
[37] Zimmerman A R, Canuel E A. Bulk organic matter and lipid biomarker composition of Chesapeake Bay surficial sediments as indicators of environmental processes [J]. Estuarine, Coastal and Shelf Science, 2001,53(3):319-341.
[38] Volkman J K, Jeffrey S W, Nichols P D, et al. Fatty acid and lipid composition of 10species of microalgae used in mariculture [J]. Journal of Experimental Marine Biology and Ecology, 1989,128(3):219-240.
[39] 徐晓君,杨世伦,张珍.三峡水库蓄水以来长江中下游干流河床沉积物粒度变化的初步研究 [J]. 地理科学, 2010,30(1):103-107.
[40] Ficken K J, Li B, Swain D L, et al. An n-alkane proxy for the sedimentary input of submerged/floating freshwater aquatic macrophytes [J]. Organic Geochemistry, 2000,31(7/8):745-749.
[41] Vonk J E, van Dongen B E, Gustafsson Ö. Lipid biomarker investigation of the origin and diagenetic state of sub-arctic terrestrial organic matter presently exported into the northern Bothnian Bay [J]. Marine Chemistry, 2008,112(1/2):1-10.
[42] Vonk J E, van Dongen B E, Gustafsson Ö. Selective preservation of old organic carbon fluvially released from sub-Arctic soils [J]. Geophysical Research Letters, 2010,37(11).
Composition and distribution of organic matter in the surface sediments of the Changjiang River in Post-Three Gorges Dam period.
MA Qian-qian1, WEI Xing2, WU Ying1*, ZHANG Jing1(1.State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China;2.Science and Technology ltd of SPARK Education, Dongguan 523000, China).
China Environmental Science, 2015,35(8):2485~2493
n-alkanes and fatty acids (FA) were analyzed in the sediment samples collected in 2009 from the Changjiang River (main streams and tributaries) by gas chromatography. Combined with general geochemical parameters, e.g. grain size, organic carbon content, stable carbon isotopes etc. The characteristics of composition and distribution of organic matters were investigated. The variation of sources and control factors, especially the influence of Three Gorges Dam(TGD) were also evaluated initially. The result showed that the surface sediment matters were composed of silt (45.8%) and sand(41.4%); the content of OC% ranged between 0.08% to 1.99%; and δ13C of the OC varied -31.88‰ to -21.41‰ which were close to the signature of continental C3 vegetation. Total n-alkanes concentration varied from 0.71 to 13.69μg/g(dry weight), or from 0.05 to 1.99mg/gOC. Fatty acids (FA) concentration, from 2.77 to 32.52μg/g (dry weight), or from 0.16 to 40.58mg/gOC, the maximum was saturated FA and the minimum was branched FA compounds. Hydrodynamic sorting and grain size took an important role in the concentrations and distribution of organic matter in tributaries of the Changjiang. Compared to the upper reach of mainstream, middle and low reaches were rich in aquatic plants, and less degraded. TGD had a significant influence on the transportation and transformation of terrestrial OM in the Changjiang River system.
Changjiang;surface sediment;n-alkanes;fatty acids
X142
A
1000-6923(2015)08-2485-09
2014-12-17
国家自然科学基金创新群体项目(41021064);国家自然科学基金(41276081)
* 责任作者, 教授, wuying@sklec.ecnu.edu.cn
马倩倩(1990-),女,河南商丘人,华东师范大学硕士研究生,主要从事海洋有机地球化学方面的研究.
