五硼酸钾高温水解反应动力学的初步研究
2015-08-22卞佳杨刚王云山张金平
卞佳,杨刚,王云山,张金平
(1.天津厚普技术检测有限公司,天津 300071;2.中国科学院过程工程研究所湿法冶金清洁生产技术国家工程实验室,天津 300071)
五硼酸钾高温水解反应动力学的初步研究
卞佳1,杨刚2,王云山2,张金平2
(1.天津厚普技术检测有限公司,天津 300071;2.中国科学院过程工程研究所湿法冶金清洁生产技术国家工程实验室,天津 300071)
五硼酸钾过热的水蒸气气氛发生水解反应。其中温度与蒸汽流量是反应最重要的影响因素。温度在1173 K时,熔体的B2O3/K2O降至3.1;加大蒸汽流量,可将熔体的B2O3/K2O降至2.6。对水解反应的机理进行了初步的研究,认为在高温与蒸汽的作用下KB5O8结构中一部分硼氧键断裂与水分解后产生的H+离子结合形成挥发性的HBO2。分离出羟基与剩下的硼酸盐网络结构进行连接,在高温条件下,两个羟基中的一个O进入硼氧网络结构中,剩下的形成水释出,同时K2O的浓度相对增加。反应动力学研究表明五硼酸钾低于熔点时与水蒸汽的反应受外扩散控制;对高于熔点的动力学实验数据进行了线性拟合,获得了线性方程。
五硼酸钾;高温水解;动力学;线性拟合
1 概述
五硼酸钾,是一种非线性光学晶体,可作为良好的激光材料,已有不少的学者进行过研究[1~3]。同时五硼酸钾在特种玻璃、金属焊接、金属精炼、润滑油添加剂等领域具有较为广泛的用途,也可作为氮化硼的原料[3]。鉴于KB5O8在高温下的应用,一些学者对其高温熔融状态的性质进行了研究,包括物理性质如密度、粘度及表面张力等[4,6]。一些学者借助特定的分析仪器对K2O-B2O3体系熔融结构进行了研究,包括Raman光谱分析[7,8]、中子衍射[9]等,重点研究高温熔融态碱金属硼酸盐随碱金属氧化物浓度变化对结构的影响。Helmut Franz[10,11]曾对高温下碱金属硼酸盐熔融态蒸汽分压进行过研究,但仅限于水蒸汽在熔融态碱金属硼酸盐中溶解度的测定。本文即是借助自行设计的反应器研究在过热的水蒸汽气氛下,五硼酸钾发生了水解反应的反应机理及反应动力学,更进一步揭示此反应过程。
2 实验部分
2.1 试剂
硼酸:A·R级,北京化工厂;碳酸钾:A·R级,北京化工厂。
2.2 仪器
火焰光度计:FP 640,上海分析仪器总厂;DTA分析所用仪器:TGA92、TMA92系列高温综合热分析仪(法国SETARAM公司;升温速率:5℃/min;灵敏度:DTA:1 mV;使用气氛:空气)。
2.3 过程
取1mol碳酸钾与10mol硼酸,溶于约三倍质量的蒸馏水中,加热至沸,使物料全部溶解。在室温下放置过夜后固液分离,将获得的固体进行重结晶制得纯的KB5O8·4H2O。将KB5O8·4H2O放置在马弗炉中500℃下焙烧5h,获得KB5O8。用火焰光度计测定K+;在甘露醇存在下以碱量法滴定B2O3。进行DTA分析。
研究KB5O8在高温过热水蒸汽中的性质变化所用的实验装置见图1。将KB5O8固体用高速粉碎机粉碎,碾磨后,放入高纯氧化铝材质的反应舟中,置于预先测定的管式反应器的恒温段处。管式炉采用程序升温,保持温度变化小于±1℃,实验选择在700℃、750℃、800℃、850℃、900℃五个温度段进行。在反应物预热20min后,从蒸汽发生器产生的蒸汽(110℃左右)经过转子流量计在反应器过热后与静止的反应物接触。生成的气体产物经过水冷却器冷凝回收。
3 结果与讨论

图1 实验装置:1蒸汽发生器;2转子流量计;3管式炉;4管式反应器;5热电偶;6反应舟;7程序温度控制仪;8冷却器;9溶液回收器
3.1 反应温度及蒸汽流量对水解反应的影响
用DTA(升温速度:10 K/min)确定所制备的KB5O8的熔点,其谱图见图2,可以看出熔点为1053 K。因此反应低于此温度的反应为气固反应,高于此温度为气液反应。图3描述了反应在923 K,973 K,1023 K,1073 K,1123 K,1173 K,蒸汽流量为0.25 m3/h,反应时间120min后的B2O3/K2O,证明确实存在着KB5O8与水的反应,同时证明温度高于熔点后促进了向B2O3/K2O减小的反应。


图4不同蒸汽流量时的B2O3/K2O
图4 为反应时间保持120min,蒸汽流量改变对反应的影响。从图中可以明显看出蒸汽的流量为反应最重要的因素之一。无论温度处于熔点之上还是熔点以下,蒸汽流量均对反应有明显的作用,区别在于改变流量对气液反应的影响更大。证明反应受气膜的外扩散控制,气体速度增大,气相产物更容易从反应器中逸出,导致反应更易向正反应方向进行。由于水蒸汽与高温的影响,KB5O8发生结构的变化,气体产物从固相空隙中或熔体中的内扩散速度或者反应速度较之外扩散速度要快,因此反应受外扩散控制。
3.2 五硼酸钾高温水解反应机理的初步研究
高温水蒸汽气氛下,KB5O8可以与水发生水解反应,其反应式可以表达为:
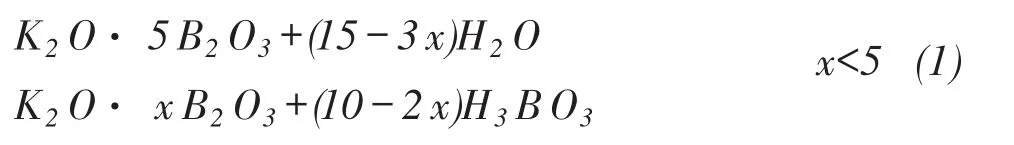
其中x表达为从0.5~5.0之间的数,可以为分数。为了确定x的数值,也做了关于钾系硼酸盐与水蒸汽的变化情况,证明当x≤2.0时,产物的B2O3/K2O与反应前一致,证明在这种反应条件下,x只能达到2.0以上的水平,为了研究动力学的方便,就确定x=2.0为反应的终点。式(1)可以写为:

反应产物证明气相的产物为H3BO3,根据文献[12]所述,高温下HBO2的挥发性较大,熔融状态下B2O3容易与水蒸汽反应形成HBO2,不易形成H3BO3。因此当KB5O8中的硼氧基团从网络结构中断裂与水蒸汽结合首先释出的为HBO2。反应机理可以表示为:

由反应式2、3、4、5加和后的反应式为:

HBO2在气相产物冷凝后很容易与水反应形成H3BO3。

式4、8中的K2O·[B4O3]6+,式8、9中的K2O·2B2O3·3H2O为中间产物的总的化学表达式,并不代表实际的结构,过程中存在着更多复杂的中间过程,比如连串反应、平行反应等,这里只是用化学式进行了简单代替,实际反应中更多的中间产物这里并没有进行表示。其中式3.4只是表达了K2O·5B2O3结构发生改变后,产物中B2O3/K2O最终达到2.0时需从结构中脱离6个BO-2离子,而中间产物的B2O3/K2O会经历从5.0到2.0的复杂反应过程。
3.3 五硼酸钾高温水解反应的反应动力学的初步研究
反应中蒸汽的流速均控制在0.3 m/s(蒸汽通过管式反应器中反应物所处截面的平均速度,下同),KB5O8在高温水蒸汽气氛下的水解反应处于熔点以下为固体,为气固反应,而在熔点以上为气液反应,因此分别以气固反应与气液反应两种反应过程进行研究。
在熔点以下的气固反应仍然采用Shrinking-Core模型分析拟合反应温度923 K、973 K、1023 K时的反应动力学数据。从此模型中得到包括内、外扩散及表面反应的缩核模型数学表达式为10式。从图5可以看出,转化率x与温度时间t呈线性关系,证明反应受外扩散的控制。由此结果可以证明反应为何受蒸汽流量影响的实验结果。由于改变蒸汽的流量后对反应后的B2O3/K2O影响很大,说明加大蒸汽流量,即加大蒸汽通过固体KB5O8层时的线速,将使颗粒外围气膜减薄,外扩散加快。因此可以判断本反应受气膜扩散的控制。根据各直线的斜率求出外扩散系数kg,见表1。

表1 各温度下的反应速率常数

式中:t-反应总时间;CS0-固体初始浓度;CA0-气体初始浓度;R-粒子直径;ks-单位表面上的化学反应速率常数;De-产物层中A的有效扩散系数;x-转化率。

作lnkg-1/T(K-1)的Arrhenius图,见图6,其扩散的活化能为8.15 kJ/mol,外扩散传质系数的温度关系式为:kg=0.00298exp(-8150/RgT)(相关系数=1)。

当温度达到1073 K以上时,反应变为气液反应。目前关于气液反应的专著及文章很多,其中气液反应宏观动力学是气液反应的最基本的理论,而气液反应宏观动力学最基本的理论分析方法是在扩散方程的基础上加入反应项,构成扩散-反应方程(即气液传质和液相中反应之间互相影响的数学描述),再用气液传质模型(包括膜模型、渗透模型、表面更新模型等)去解析扩散-反应方程。由于气液反应机理十分复杂,只有对一级反应才能得到传质-反应微分方程的解析解,其他场合只能做近似解或数值解。限于实验条件及缺乏高温下KB5O8传质系数等参数,加之反应机理尚不清楚,不能确定此反应的本征反应速率方程,因此还不能用以上的研究方法确定扩散-反应方程。为了反映反应中产物B2O3/K2O随时间的变化的规律,对动力学数据进行线性拟合。
设待定的反应级数为n,速率用下式表达:
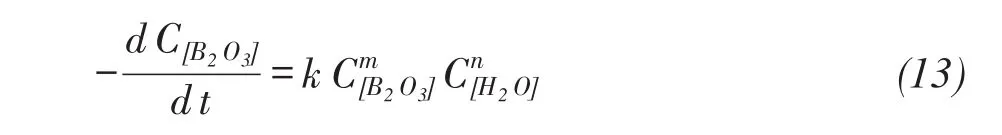
式中C[B2O3]为固体产物中B2O3的质量浓度减少量,C[H2O]为水蒸气的浓度,m、n为待求的反应级数,k为反应速率常数,由于水蒸汽在实验中大大过量,因此浓度变化不大,因此可以看作反应与水蒸汽浓度无关的,此时式13可以简化为

式3.13通过微分进行线性化,对上面微分速率式两边取对数,得出线性方程如下:

用实验数据对上式待求参数进行线性回归,得出不同反应温度下的线性方程分别为:

式中,Y为B2O3减少量随时间变化的对数值;X为B2O3减少量的对数值。式中的相对系数说明拟合结果很好。
如图7所示,实验点在双对数图上分布情况良好。
4 结论
4.1 过热的水蒸气气氛下,五硼酸钾发生了水解反应,温度在1173 K时,熔体的B2O3/K2O降至3.1。蒸汽流量也是重要的影响因素,加大蒸汽流量,可将熔体的B2O3/K2O降至2.6。
4.2 由于高温条件及高温水蒸气的作用,KB5O8结构中一部分硼氧键断裂,加上水分解后产生的H+离子与断裂的BO-2结合形成挥发性的HBO2。KB5O8中的更多硼氧键断裂,形成HBO2释出,由于高温的作用,分离出羟基与剩下的硼酸盐网络结构进行连接,在高温条件下,两个羟基中的一个O进入硼氧网络结构中,剩下的形成水释出,同时K2O的浓度相对增加,二者的综合作用决定了这个化合物的物质结构的改变。
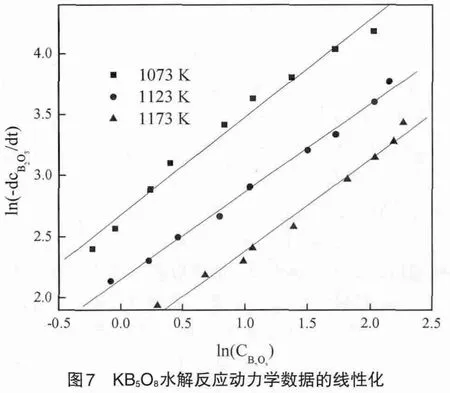
图7 KB5O8水解反应动力学数据的线性化
4.3 利用Shrinking-Core模型分析了五硼酸钾在熔点温度以下时反应受外扩散控制,加大蒸汽流量使颗粒外围气膜减薄,外扩散加快。对五硼酸钾在熔点温度以上的动力学试验结果进行了线性拟合,得出了不同温度下的线性方程,与实验结合拟合。
[1]Thamizharasan K,Jesu Raja S X,Xavier F P,Sagayaraj P.Growth,Thermal and Microhardness Studies of Single Crystals of Potassi⁃um Penta Borate(KB5)[J].Cryst.Growth.,2000,218:323-326.
[2]Rajasekar S A,Thamizharasan K,Arul Pragasam A J,J.Julius P,Sagayaraj P.Growth and Characterization of Pure and Doped Po⁃tassium Ppentaborate(KB5)Single Crystals[J].Cryst.Growth.,2003,247:199-206.
[3]李丽霞,王继扬,袁多荣,魏景谦.五硼酸钾晶体喇曼谱的研究[J].中国激光,1990,17(11):27-30.
[4]刘志甫.六方氮化硼合成方法及性能研究[D].北京:北京科技大学,2000.
[5]Shartsis L,Capps W.Surface Tension of Molten Alkali Borates[J].Am.Ceram.Soc.,1952,35(7):169-172.
[6]Leedecke C J,Bergeron C G.Borate Glass:Structure,Properties and Applications.Pye L D,Fréchette V D,Kreidl N J Ed.,[M].New York:Plenum,1978.413-426.
[7]Kamitsos E I,Chryssikos G D.Alkali Sites in Glass[J].Solid State Ionics,1998,105:75-85.
[8]Akagi R,Ohtori N,Umesaki N.Raman Spectra of K2O-B2O3Glass⁃es and Melts[J].Non-Cryst.Solids,2001,293-295:471-476.
[9]Handa K,Kita Y,Kohara S,Suzuya K,Fukunaga T,Misawa M,Iida T,Iwasaki H,Umesaki N.Structure of M2O-B2O3(M:Na and K)Glasses and Melts by Neutron Diffraction.[J].Phys.Chem.Sol⁃ids,1999,60:1465-1471.
[10]Franz H.Solubility of Water Vapor in Alkali Borate Melts[J].Am.Ceram.,1966,49(1):473-477.
[11]Franz H.Borate Glass:Structure,Properties and Applications.Pye L D,Fréchette V D,Kreidl N J Ed.,[M].New York:Plenum,1978.567-575.
[12]Pradyot Patnaik.Handbook of Inorganic Chemicals[M].New York:McGraw-Hill,2002:121.
Preliminary study on hightemperature hydrolysis kinetics of potassiumpentaborate
BIAN Jia1,YANG Gang2,WANG Yun-shan3,ZHANG Jin-ping4
(1.Tianjin Hope Technonogy Testing Co.,Ltd;2.Institute of process engineering-Chinese Academy of Sciences-National Engineering Laboratory for clean production technology in hydrometallurgy,Tianjin,300071)
Abstract:The hydrolysis reaction of potassium pentaborate superheated steamatmosphere.Effects of temperature and steam flow is the most important factor.When the temperature is at 1173 k,B2O3/K2O of its melts is to 3.1;increase the steamflow,B2O3/K2O of melts can be down to 2.6.Undertook a preliminary study on themechanism of hydrolysis reactions,it is considered that under the action of high temperature and steam parts of boron-oxygen bond in the structure of KB5O8cleavage and combine with H+ions generated from water decomposition to form volatile HBO2.Isolated hydroxyl groups connected with the remaining borate's network structure.In high temperatureconditions,one oxygen of two hydroxyl groups entered the network structure of boronoxygen,the rest being released,and K2O's concentration was increased.Reaction kinetic studies have shown that when potassiumpentaborate below the melting point its reacting with water vapour is control by external diffusion.We take the linear fitting of dynamic theexperimental data under high melting point,access to the linear quation.
potassium pentaborate,high-temperature hydrolysis,kinetics,linearfitting
10.3969/j.issn.1008-1267.2015.03.006
TQ128+.54
A
1008-1267(2015)03-0015-05
2014-12-28
