麻类脱胶高效菌株DCE01的Pel4I8基因克隆与表达
2015-08-21李琦成莉凤曾洁刘朝阳刘正初
李琦,成莉凤,曾洁,刘朝阳,刘正初,*
(1.湖南农业大学植物保护学院,长沙410128;2.中国农业科学院麻类研究所,长沙410205;3.湖南利尔康生物股份有限公司,湖南岳阳414100)
纤维作物的生物脱胶 (例如苎麻脱胶)关键控制因素之一就是果胶酶[1]。果胶酶是一类能够降解果胶物质的生物酶的总称,是一种重要的工业酶制剂。果胶酶还广泛应用于果汁澄清、植物提取、废水处理、纸浆漂白[2]等工业领域。按照作用底物的不同,果胶酶可以分为果胶甲基半乳糖醛酸酶 (PMG)、聚半乳糖醛酸酶 (PG)、果胶裂解酶 (PL)、聚半乳糖醛酸裂解酶(PGL)、果胶酯酶或果胶甲酯酶 (PE)、原果胶酶等。按照酶作用的最适pH情况,又分为酸性果胶酶、中性果胶酶与碱性果胶酶。为适应工业化应用的高要求,果胶酶的研究热点正逐步由菌种筛选、酶学性质测定、分离纯化研究转向基因工程、蛋白质工程等分子生物学内容。发掘天然优秀菌株中的优质果胶酶基因,是分子生物学的基础工作之一。
实验室筛选到了拥有14个果胶酶基因的麻类脱胶高效菌株DCE01。为了更好的研究各果胶酶的特性,采用PCR技术克隆了该菌株的一个果胶酶基因Pel4I8,将其与大肠杆菌表达载体pET-28a连接,在E.coli BL21(DE3)中进行了表达。
1 材料与方法
1.1 材料与仪器
菌株DCE01由中国农业科学院麻类研究所工程酶项目组提供;E.coli BL21(DE3)购自Novagen公司;载体pET-28a购自TransGen公司;聚半乳糖醛酸钠、橘子果胶 (不同酯化度)购自Sigma公司;高保真聚合酶购自TransGen公司;UNIQ-10柱式细菌基因组等试剂盒购自上海生工公司;DNA Marker购自Tiangen公司;其他常规生化试剂均为分析纯,购自国药集团。
PCR仪购自BioRad公司;SPX-250B型生化培养箱购自上海博讯公司;LDZX-50KBS型不锈钢立式压力蒸汽灭菌器购自上海申安医疗器械厂。
1.2 实验方法
1.2.1 菌种培养
DCE01菌种的活化[3]方法:从斜面保藏菌种挑取一环接种到5mL改良肉汤培养基,充分悬匀,35℃ 静置培养5-8h。稀释涂布固体改良肉汤培养基,35℃静置培养18-20h,分离单菌落。挑选生长旺盛的单菌落接种于5mL LB培养基,35℃,180r/min培养15-18h,供基因组DNA提取或其他用途。
1.2.2 基因组DNA的提取
参照UNIQ-10柱式细菌基因组DNA抽提试剂盒说明书进行。
1.2.3 果胶酶pel4I8基因的扩增
采用软件Primer premier 5设计引物。上游引物带BamH I酶切位点,下游引物带Hand III酶切位点。

以DCE01菌株基因组DNA为模板,扩增体系参照试剂说明书。扩增参数设置为:95℃ 预变性4.0 min,94℃变性30s、55℃退火30 s、72℃延伸1.0 min,共30个循环,72℃保温10 min。采用1%琼脂糖凝胶电泳检测并回收PCR产物。质粒提取、DNA酶切、连接、转化、DNA片段回收等操作按相关试剂盒说明进行。
1.2.4 果胶酶的诱导表达及粗酶液的制备
挑取阳性基因工程菌株接种培养 (培养条件:37℃、220 r/min)。当OD600达到0.6,添加IPTG进行诱导。发酵液在3500 r/min,4℃的条件下离心10 min,分别收集菌体和上清液。上清液即为胞外酶液。
用适量预冷的生理盐水洗涤菌体并重悬,在4℃下用超声波破碎仪破壁后,14℃、10000 r/min条件下离心10 min,收集上清液即为胞内酶液。
1.2.5 SDS-PAGE电泳
采用12%的分离胶和5%的浓缩胶。根据蛋白质样品的浓度,上样量为5.0-20.0μL。浓缩胶的电压为100V,电流10mA。待进入分离胶后,电压不变,电流调节为25mA。
1.2.6 果胶酶活力单位定义
50℃、pH值9.0条件下,底物每分钟释放出相当于1.0μmol半乳糖醛酸的还原糖所需的酶量为1个酶活力单位,以“U/mL”表示。
1.2.7 果胶酶酶学性质分析
在50℃下测定重组果胶酶在pH 7.5-11.0时的酶活性,确定其最适pH值;在pH 9.0条件下,分别测定其在40-65℃条件下的酶活。
2 结果与分析
2.1 基因克隆
以基因组DNA为模板,获得的PCR产物琼脂糖凝胶电泳检测结果显示:果胶酶基因Pel4I8电泳条带清晰,目的基因克隆成功。测序结果标明,该基因含有1632个碱基。
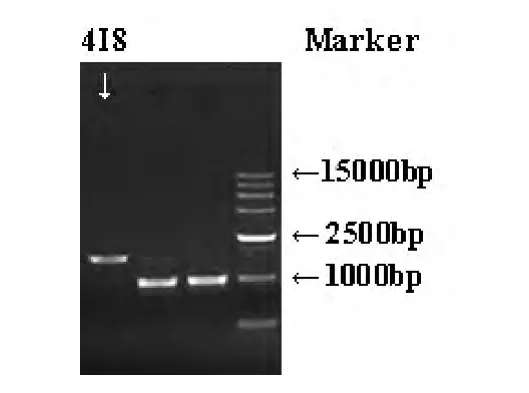
图1 果胶酶基因PCR扩增Fig.1 PCR amplification of pectate lyase gene
2.2 质粒转化与酶切
提取转化后阳性菌株的质粒,并在37℃酶切30 min。以质粒DNA为模板进行PCR鉴定。用琼脂糖凝胶电泳检测酶切产物及阳性克隆菌种的质粒PCR产物。结果表明:果胶酶基因Pel4I8已经转化成功,条带大小与目标基因相符。
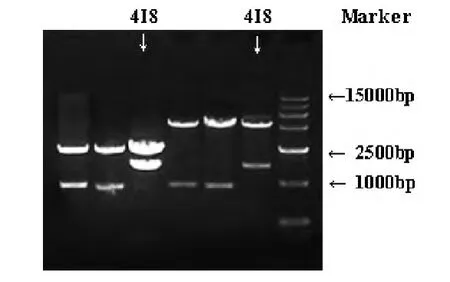
图2 质粒PCR鉴定与扩增检测Fig.2 Detection of recombinants by PCR
2.3 诱导产酶结果
重组菌株经IPTG诱导8h、21h后的蛋白质SDS-PAGE电泳结果表明:第21h的条带较第8小时的明显,这说明蛋白的表达量随着诱导时间的延长而增多。果胶酶Pel4I8基因编码543个氨基酸,预测的分子量约为63kDa。
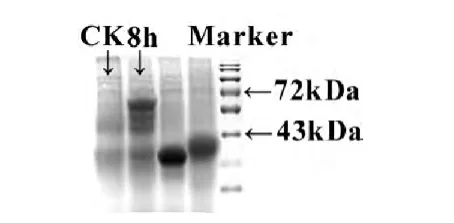
图3 果胶酶SDS-PAGE电泳Fig.3 SDS-PAGE of recombinant pectate lyase
2.4 碱性果胶酶的酶学性质
生物酶的作用随着温度和pH的变化而变化,一般来说,温度越高,催化效果越好,但是温度过高,又会破坏蛋白质的结构,甚至使蛋白质失去活性。结果显示,该酶的最佳反应温度为55℃、最佳反应pH为pH 9.5。
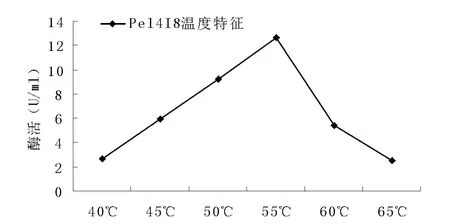
图4 温度对重组果胶酶活力的影响Fig.4 Effect of temperature on the activity of recombinant pectate lyase

图5 重组果胶酶的pH值稳定性Fig.5 pH stability of recombinant pectate lyase
工业应用中,人们常常通过比较酶活来评价一个酶的催化效率。然而,酶活的检测往往受到底物等多种因素的影响。这在果胶酶Pel4I8上尤为明显。分别采用四种酯化度各不相同的橘子果胶为底物,检测到的酶活相差较大。用酯化程度在55%-70%的橘子果胶作底物检测时酶活最高,以酯化程度≥85%的橘子果胶为底物时,几乎检测不到酶活。
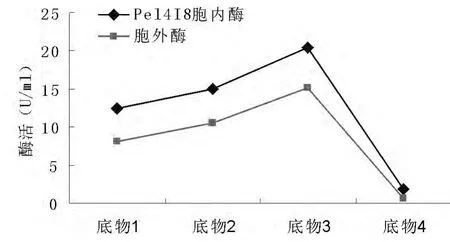
图6 不同底物对酶活力的影响Fig.6 Effect of substrates on enzyme activity
3 讨论
自然界中的产果胶酶微生物往往可以分泌多种不同类型的果胶酶,这些酶的酶学特性往往有很大的差别,认真分析和研究这些差异性,既是拓展工业酶精细化应用的需要,也是开发新型高效酶制剂的基础。酶法脱胶中更偏向于选择碱性果胶酶而不是酸性果胶酶,因为碱性环境下纤维素降解会受到抑制[4]。在麻类脱胶工序中,果胶酶与果胶酶之间有协同作用,果胶酶与其它酶复合使用,更能降低能耗,提高生产性能。Kaur等在红麻生物制浆中利用果胶酶与木聚糖酶协同作用,提高了纸浆性能[5]。因此,实际应用中,既要考虑果胶酶的酶学特性,还要考虑起协同作用的其它酶制剂的酶学特性,只有各酶种的特性类似,组合使用时才能发挥最佳效率,否则,会或多或少降低某一种酶的催化效率,造成浪费。
进行蛋白表达时,有些胞内酶不能正确折叠和修饰,还会形成包涵体,即使纯化出来也不一定能成功复性[6]。据报道,采用pEASY-E1载体进行该酶基因的表达时,尚未检测到胞内酶活性和胞外酶活性[3],而采用pET-28a载体时,两者均检测到了活性。表达载体的选择可能对该酶的表达影响较大。
通过Blast序列分析发现,在核酸序列上,Pel4I8基因与来自Dickeya dadantii 3937的pelW基因[7]相似程度为93%,有109个差异点,而在氨基酸序列上的差异性要小一些,有9个氨基酸不同,相似度为97%。
据报道,尽管不同来源的果胶酶酶学性质存在差异,但是,大部分碱性果胶酶最适pH值为8.0~l0.0,最适温度范围为50~60℃[8]。Li Zuming等[9]报道的果胶酶最适反应pH值为10.0;徐伟等报道的果胶酶最适pH值为9.0~9.5,在pH 7.0~10.0之间催化性质较稳定;最适作用温度范围为45~55℃[10]。本研究中的果胶酶最适pH值为9.5,但在pH 9.0及10.0时,酶活仅为高峰时的61%和42%,这说明外部pH对酶的影响较大。在40-55℃温度区间,酶活稳定上升,最适温度为55℃,这与已报道的研究相吻合。
工业应用中,用酶环境较复杂,温度和pH一般都有一定的波动范围,这对工业酶的推广与普及是一个挑战。设计一个在较宽的温度和pH范围内相对稳定的酶蛋白是今后工业酶制剂开发的一个方向,此外,还将加强提高酶的表达量及催化效率方面的研究,为该酶的工业化应用打下基础。
[1]郑科,刘正初,段盛文,等.果胶酶在麻类脱胶中的应用及其作用机理[J].生物技术进展,2012,2(6):404-410.
[2]Murad HA,Azzaz HH.Microbial pectinases and ruminant nutritior[J].Research Journal of Microbiology,2011,6(3):246-269.
[3]成莉凤.DCE-01菌株果胶酶基因克隆与表达及其多样性研究[D].北京:中国农业科学院,2013.
[4]白延坤,刘秉钺,何连芳.韧皮纤维生物脱胶的研究进展[J].造纸科学与技术,2006,25(2):34-38.
[5]Kaur A,Mahajan R,Singh A,et al.Application of cellulase-free xylano-pectinolytic enzymes from the same bacterial isolate in biobleaching of kraft pulp [J].Bioresour Technol,2010,101(23):9150 -9155.
[6]Jayani RS,Saxena S,Gupta R.Microbial pectinolytic enzymes:A review [J].Process Biochemistry,2005,40(9):2931-2944.
[7]Glasner JD,Yang CH,Reverchon S,et al.Genome sequence of the plant-pathogenic bacterium Dickeya dadantii 3937 [J].Journal of Bacteriology,2011,193(8):2076–2077.
[8]Pedrolli DB,Monteiro AC,Gomes E,et al.Pectin and pectinases:production,characterization and industrial application of microbial pectinolytic enzymes[J].The Open Biotechnology Journal,2009,7(3):9 -18.
[9]Li Zuming,Bai Zhihui,ZhangBaoguo,et al.Purification and characterization of alkaline pectin lyase from a newly isolated Bacillus clausii and its application in elicitation of plant disease resistance [J].Applied Biochemistry Biotechnology,2012,167(8):2241-2256.
[10]徐伟,付大伟,姚晓静.基因工程菌Escherichia coli BL21/pET-pel重组果胶酶的纯化及酶学性质[J].食品科学,2014,35(23):245-248.
