新疆贝母属药用贝母ISSR-PCR体系的确立和优化
2015-08-09詹羽姣张鹏葛安露莎
詹羽姣,盛 萍,张鹏葛,安露莎,张 煊
(新疆医科大学中医学院,新疆乌鲁木齐 830011)
贝母属(Fritillaria L.)为百合科多年生草本植物,全世界约有130种,分布于北温带,尤以地中海地区、亚洲东部至中部和北美洲的种类为多。我国有贝母属植物61种,50个变种,5变型,其中具药用价值的植物有20余种,主要分布于四川、新疆、甘肃、湖北、安徽、浙江等省。该属大多数鳞茎供药用,有清热润肺,止咳祛痰的功效,在我国有悠久的用药历史[1]。《中国药典》2010年版收载的贝母药材有川贝母、浙贝母、伊贝母等,其中伊贝母包括新疆贝母Fritillaria walujewii Rege.、伊犁贝母 F.pallidiflora Schrenk 2种植物的干燥鳞茎[2]。因其野生品种仅分布在新疆[3],故当地人也将此2种植物的干燥鳞茎统称为新疆贝母。而实际上,新疆分布量较丰富的其他6种贝母如黄花贝母F.verticillaea、额敏贝母F.meleagris等的干燥鳞茎也同时入药使用。新疆贝母属的药用贝母主要分布于新疆塔城地区、吉木萨尔县、新源县、霍城县、巩留县、吉木乃等的山区及草地,分布范围广泛,生态分布多样,具有较好的资源基础,因此,对新疆贝母属药用贝母植物资源的开发及遗传研究具有重要的意义。
近年来新型分子标记技术ISSR(Inter simple sequence repeat内部简单序列重复区间扩增),已广泛应用于植物品种鉴定及遗传多样性分析等研究中[4-6]。但其反应体系受到多种因素的影响,故ISSR-PCR反应体系的建立及优化是重要的前提和基础。2012年王果平等[7]通过改良的CTAB法提取基因组DNA,利用单因素和L9(34)正交试验建立了新疆贝母ISSR-PCR体系,但对于体系的延长时间和循环次数未见考察,且CTAB法提取的总基因组纯度较试剂盒法低。因此,本实验采用课题组已优化的总基因组提取方法试剂盒法提取总DNA,结合单因素试验和L16(45)正交设计实验,对ISSR-PCR反应体系的影响因素:Mg2+、dNTPs、引物浓度、Taq DNA聚合酶、模板DNA浓度进行优化,并确定最适循环次数、延伸时间和退火温度。综合评价以确立最优的新疆贝母属药用贝母ISSR-PCR体系,为新疆贝母属8种药用贝母的遗传多样性分析提供依据。
1 材料与仪器
实验材料于2012年5—6月从新疆不同产地采集,每个产地随机选取样品植株,每株采集其幼嫩叶置于硅胶袋中迅速干燥,然后置-20℃冰箱中保存,试验样品经新疆贝母专家段咸珍及新疆医科大学盛萍教授鉴定,样品信息见表1,凭证标本存放于新疆医科大学中医学院中药资源教研室。

表1 新疆贝母属药用贝母供试种类及产地
Plant Genomic DNA Kit(TIANGEN BIOTECH)(离心柱型)试剂盒,Taq DNA聚合酶,dNTPs,Mg2+,10 × Buffer,2000 kb DNA Maker,Gelview,琼脂糖凝胶等。引物根据加拿大哥伦比亚大学公布的第9套ISSR引物序列,由上海生工有限公司合成。
Anke TGL-16C离心机(上海安亭科学仪器厂);DYY-7C型电泳仪(北京六一仪器厂);Bio-Rad C1000 PCR扩增仪(BIO-RAD美国);琼脂糖凝胶成像仪(上海培清科技有限公司);K5500核酸蛋白测定仪等。
2 方法与结果
2.1 方法
2.1.1 总DNA的提取及检测
通过课题组前期对贝母属药用贝母总DNA提取方法(改良的CTAB法、改良的SDS法与试剂盒法)的比较研究,得出试剂盒法最佳。故实验采用试剂盒Plant Genomic DNA Kit(离心柱型)提取植物基因组总DNA,操作步骤参照说明。所得基因组DNA用0.8%的琼脂糖凝胶电泳检测其完整性,用核酸蛋白测定仪检测其浓度及纯度,并将总DNA浓度稀释至50 ng/μL至4℃冰箱备用。
2.1.2 ISSR-PCR反应体系单因素试验
经预实验初步从74条引物中选出条带清晰多态性好的UBC853引物,伊犁贝母基因组作为模板DNA,用于单因素考察,对影响新疆贝母属植物总DNA的 ISSR-PCR反应的 Mg2+、Taq DNA聚合酶、dNTPs、Primer和模板DNA因素分别设置8个不同梯度的处理:Mg2+浓度设置为0.5 mmol/L、1.0 mmol/L、1.5 mmol/L、2.0 mmol/L、2.5 mmol/L、3.0 mmol/L、3.5 mmol/L、4.0 mmol/L;Taq DNA聚合酶浓度设置为 0.5 U、0.75 U、1.0 U、1.25 U、1.5 U、1.75 U、2.0 U、2.25 U;dNTPs浓度设置为0.05 mmol/L、0.1 mmol/L、0.15 mmol/L、0.2 mmol/L、0.25 mmol/L、0.3 mmol/L、0.35 mmol/L、0.4 mmol/L;Primer 浓度设置为 0.1 μmol/L、0.2 μmol/L、0.4 μmol/L、0.6 μmol/L、0.8 μmol/L、1.0 μmol/L、1.2 μmol/L、1.5 μmol/L;模板 DNA 浓度设置为0.1 ng/μL、0.25 ng/μL、0.5 ng/μL、1.0 ng/μL、1.5 ng/μL、2.0 ng/μL、2.5 ng/μL、3.0 ng/μL。每个因素最佳水平范围确定后作为后续正交设计因素水平的基础条件。退火温度考察:在PCR仪上设置 8个梯度,即 54.0℃、53.6℃、52.8℃、51.5 ℃、49.8 ℃、48.4 ℃、47.5 ℃、47.0 ℃;循环次数考察:设定循环次数为35 cycle、38 cycle、40 cycle、45 cycle;延长时间考察:设定延长时间为 5 min、6min、7 min、8 min、9 min、10 min、11 min、12 min。反应体系 50 μL,每个体系包含 5 μL 10 ×Buffer。根据引物Tm值及预实验,单因素试验中反应程序设定为:95℃预变性7 min;95℃变性30 s;50℃退火45 s;72℃延伸90 s;45个循环;72℃延伸10 min;4℃保存。
2.1.3 ISSR-PCR反应体系正交设计试验
根据对ISSR-PCR各项单因素试验考察结果分析,确定影响PCR反应的Mg2+、Taq DNA聚合酶、dNTPs、Primer和模板DNA因素的最佳范围(见表2),选取引物UBC853进行5因素4水平优化,选用L16(45)正交设计实验表(见表3),表中共16个处理,每个处理做3次重复,来确定最佳反应体系。
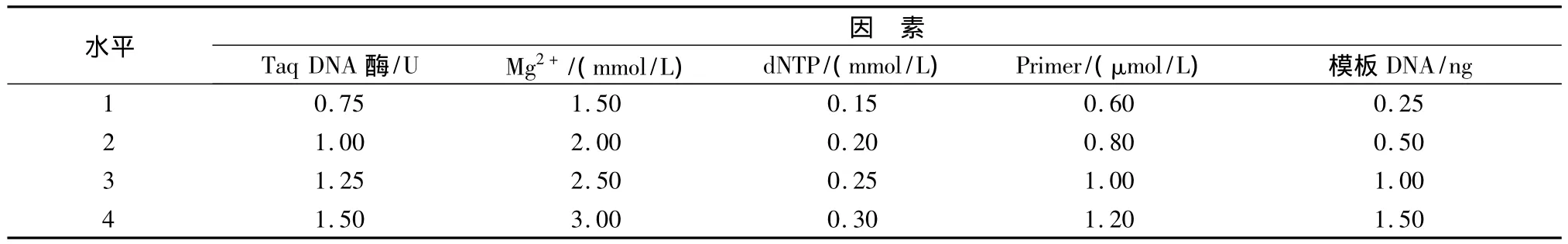
表2 ISSR-PCR反应体系的因素水平

表3 ISSR-PCR正交试验设计表L16(45)
2.1.4 扩增产物的检测
扩增所得的产物用Gelview染色,DL 2000 DNA Maker作为相对分子质量标准,用2%的琼脂糖凝胶于115 V电压下电泳50 min,在紫外凝胶成像系统下观察拍照。
2.1.5 ISSR-PCR优化体系稳定性检测
利用上述已建立的ISSR-PCR反应体系,对74条引物进行2次筛选,并选用扩增结果清晰,多态性好,稳定性高的16条引物对23份新疆贝母属8种药用贝母进行DNA扩增,对已确立的优化体系进行验证,检测其稳定性。
2.2 ISSR-PCR的单因素试验
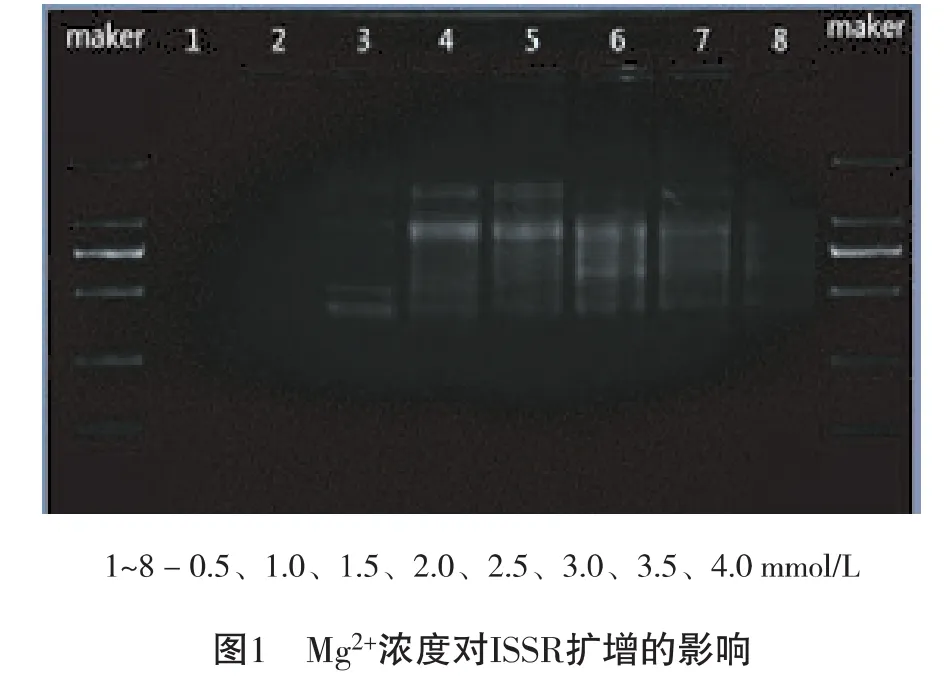
2.2.1 Mg2+浓度对ISSR-PCR反应的影响
Mg2+浓度是影响ISSR-PCR的重要因素之一,可影响引物与模板的结合率,浓度过高会增强背景干扰,过低将降低扩增产率[8]。且Taq DNA聚合酶是Mg2+依赖性酶,对其浓度非常敏感,故Mg2+浓度对PCR反应至关重要。由图1可看出:浓度为2.0 mmol/L、2.5 mmol/L 时条带最为清晰,故选择 2.0 mmol/L、2.5 mmol/L 上下的1.5 mmol/L、2.0 mmol/L、2.5 mmol/L、3.0 mmol/L 水平作为ISSR-PCR 正交试验设计的Mg2+水平范围。
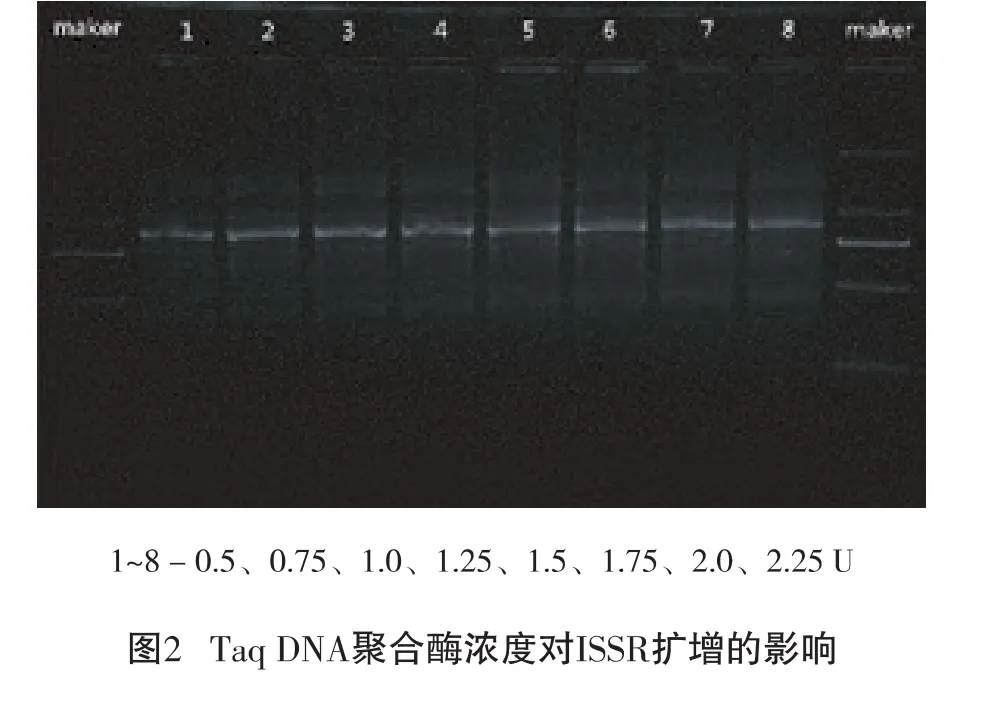
2.2.2 Taq DNA聚合酶浓度对ISSR-PCR反应的影响
Taq DNA聚合酶对ISSR-PCR扩增结果有着显著影响,浓度过高产生非特异性扩增,浓度过低会降低新链的合成效率,则无法扩增[9]。由图2可以看出:随着浓度增加条带出现弥散,故选择1.0 U上下的0.75 U、1.00 U、1.25 U、1.50 U 水平作为 ISSR-PCR正交试验设计的Taq DNA聚合酶水平范围。
2.2.3 dNTPs浓度对ISSR-PCR反应的影响
dNTPs是ISSR-CR反应中磷酸基团的主要来源,浓度过高可增加反应速度但增加碱基的错误参入率,低浓度可提高实验精确性但导致反应速度下降,甚至会因为dNTPs的过早消耗而使产物单链化。由图3可以看出:0.30 mmol/L条带丰富且清晰,0.15 mmol/L、0.20 mmol/L、025 mmol/L 条带丰富,故选择 0.15 mmol/L、0.20 mmol/L、025 mmol/L、0.30 mmol/L水平作为ISSR-PCR正交试验设计的dNTPs水平范围。
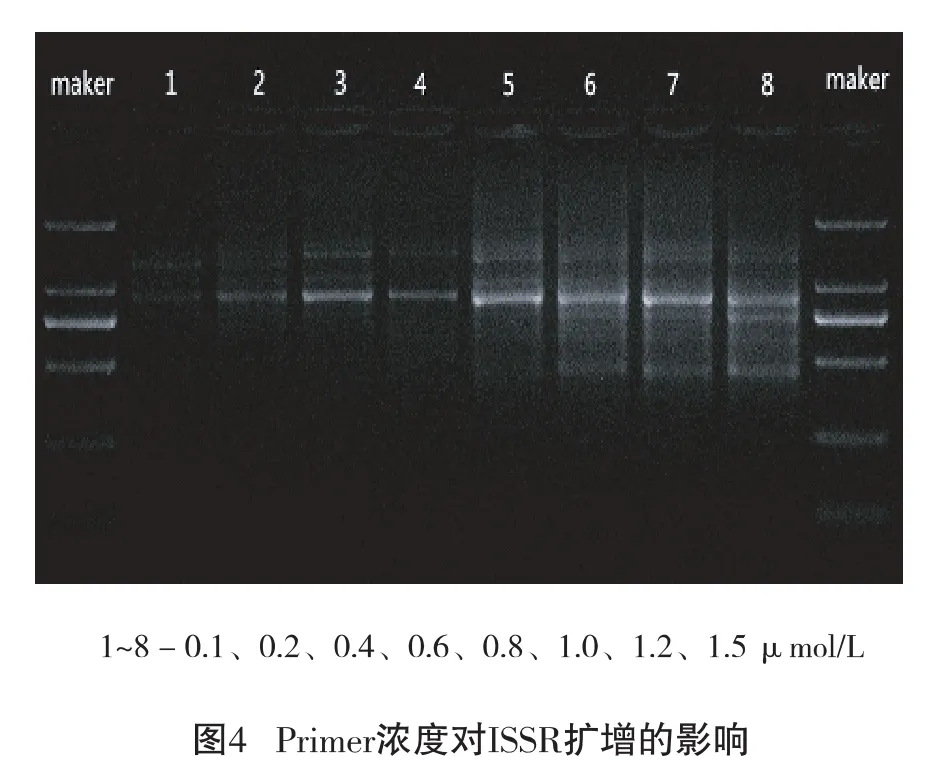
2.2.4 Primer浓度对ISSR-PCR反应的影响
不同浓度的引物对扩增结果的影响较为明显,引物浓度过低扩增引物下降,浓度过高会增加引物二聚体形成[10]。由图4 可以看出:1.0 μmol/L 条带最清晰,故选择1.0 μmol/L 上下的0.6 μmol/L、0.6 μmol/L、1.0 μmol/L、1.2 μmol/L 水平作为 ISSR-PCR正交试验设计的Primer水平范围。
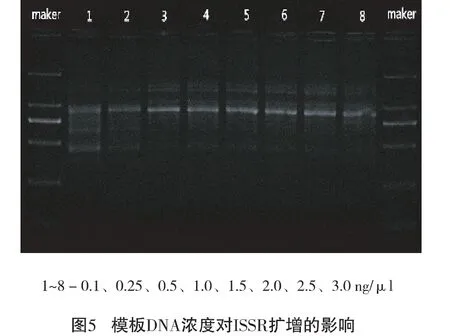
2.2.5 模板DNA浓度对ISSR-PCR反应的影响
模板DNA浓度也是ISSR-PCR反应的影响因素之一,由图5可以看出:浓度由小到大条带依次变明亮,但随着浓度增大条带略有弥散。故选择0.25 ng/μL、0.5 ng/μL、1.0 ng/μL、1.5 ng/μL 水平作为ISSR-PCR正交试验设计的模板DNA水平范围。
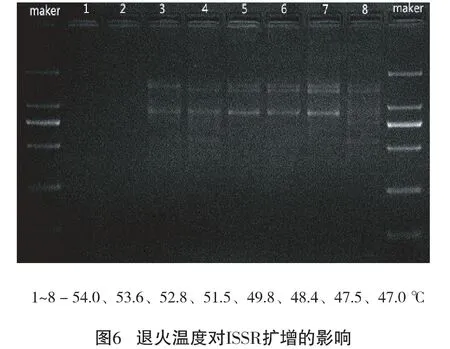
2.2.6 退火温度的确定
设定不同梯度的退火温度,由图6可以看出:54.0 ℃、53.6 ℃无条带;52.8 ℃、51.5 ℃、47.0 ℃均有不同程度的弥散;49.8 ℃、48.4 ℃、47.5 ℃条带明亮清晰,考虑引物 UBC853的理论 Tm值为53.9℃,47.5℃温度较低,故最终确立引物引物UBC853的最适退火温度为49.8℃。
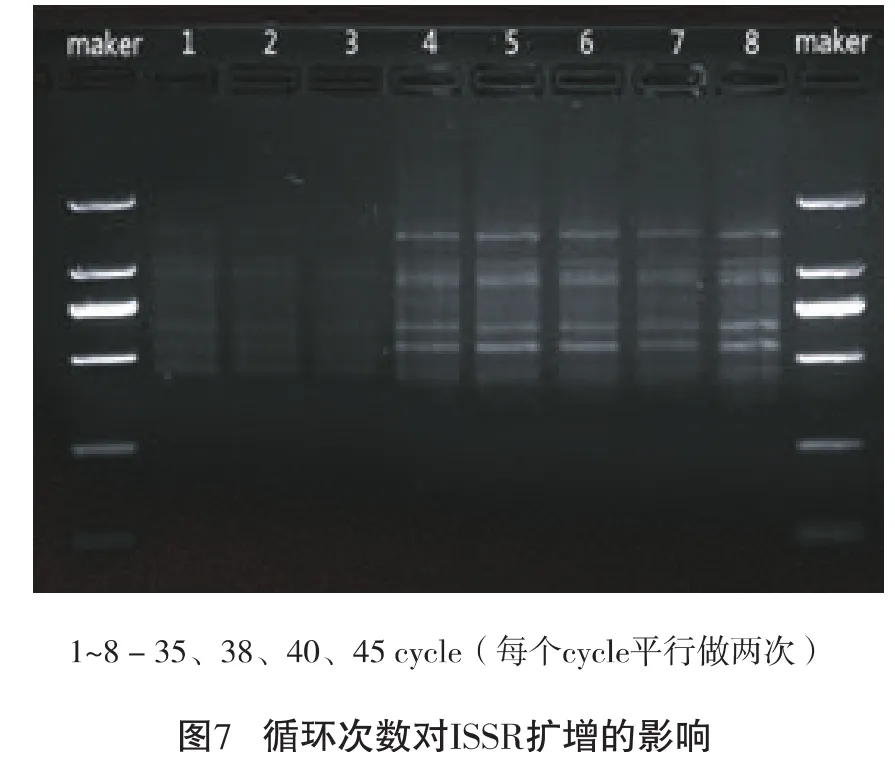
2.2.7 循环次数的确定
由图7可以看出:35 cycle、38 cycle条带有弥散;40 cycle 2条条带稳定性差;45 cycle的2条条带均较丰富且明亮清晰,说明45cycle较稳定,为最佳循环次数。
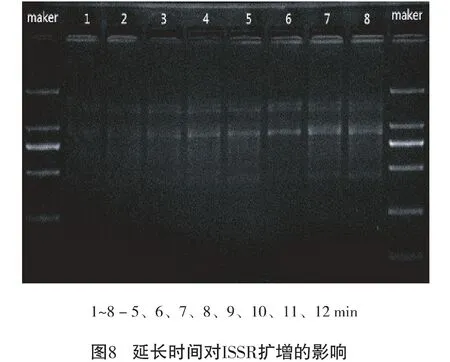
2.2.8 延长时间的确定
由图8 可以看出:5 min、6 min、7 min、11 min 条带暗;8 min、9 min、10 min、12 min 条带较丰富明亮,但8 min、9 min、12 min均出现了不同程度的弥散。综合比较,延长时间10 min的条带清晰丰富明亮,故为最佳延长时间。

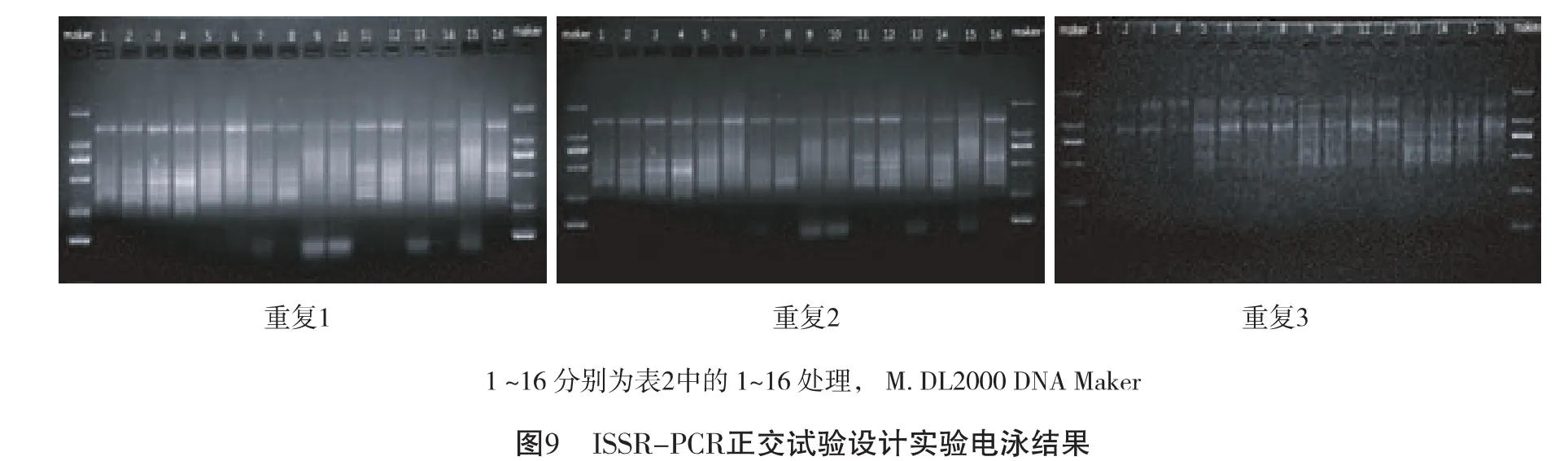
2.3 ISSR-PCR的正交试验直观分析
根据L16(45)正交试验PCR产物电泳结果(图9),16个处理3组重复均有谱带产生。依据谱带的强弱和杂带的多少对PCR扩增结果依次打分。条带数量丰富、清晰的最佳产物记16分;最差的计1分,分别对重复3次的扩增结果进行3次独立计分(见表2)。以特异普带多态性高,主带清晰,背景干扰低及实验成本为考虑原则,初步选定12组为新疆贝母属贝母ISSR-PCR的最佳反应体系。
2.4 ISSR-PCR正交试验方差分析
用SPSS 18.0软件对上述处理评分结果进行方差分析,结果见表4。由F值可看出,该正交设计中,各因素对体系的影响大小依次为:Mg2+>TaqDNA聚合酶>模板DNA>dNTPs>引物。各因素的P值均小于0.05,说明这些因素水平间均存在显著差异,可进一步进行因素内的多重比较分析。采用S-N-K法对各因素不同水平的结果进行多重比较,以确定各因素的最佳水平。
2.4.1 Mg2+浓度
随着 Mg2+浓度从1.5 mmol/L ~3.0 mmol/L 增加,评分结果均值由小变大再变小,当增加到2.5 mmol/L时均值最大,且与其他3个水平之间差异均达到极显著水平。故Mg2+选择2.5 mmol/L为最佳浓度。
2.4.2 dNTPs浓度
随着 dNTPs浓度从 0.15 mmol/L ~0.30 mmol/L增加,评分结果均值由小变大,当增加到0.30 mmol/L时均值最大,且与其他3个水平之间差异均达到极显著水平。故dNTPs浓度选择0.30 mmol/L为最佳浓度。
2.4.3 引物浓度
随着 Primer浓度从 0.6 μmol/L ~ 1.0 μmol/L增加,评分结果均值下降趋势,到1.2 μmol/L评分结果上升。0.8 μmol/L与1.0 mmol/L水平之间差异达到极显著水平,与 0.6 mmol/L、1.2 mmol/L 水平之间没有显著差异。因此,引物浓度选择0.8 μmol/L为最佳浓度。
2.4.4 Taq DNA 聚合酶
Taq DNA聚合酶在0.75 U~1.50 U之间评分结果均值呈下降趋势,且水平0.75 U与其他3个水平之间差异均达到极显著水平。故Taq DNA聚合酶最佳用量为0.75 U。
2.4.5 模板DNA浓度
模版 DNA 在0.25 ng/μL ~1.5 ng/μL 之间评分结果均值呈上升趋势,且水平 1.00 ng/μL与0.25 ng/μL、0.50 ng/μL 水平之间有显著差异,与1.50 ng/μL水平之间没有显著差异。因此,选择模版DNA的最佳浓度为1.00 ng/μL。
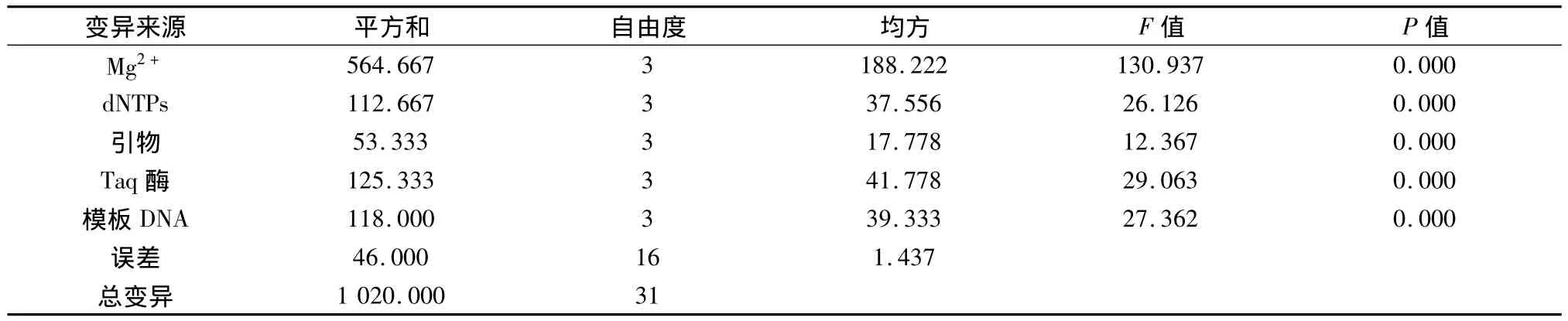
表4 正交设计方差分析
2.5 ISSR-PCR优化体系的稳定性检测
利用上述已建立的ISSR-PCR反应体系,从74条引物中筛选出16条条带清晰,多态性好,稳定性高的引物(见表5)。运用最优组合对23份新疆贝母属8种药用贝母进行DNA扩增(16条引物的ISSR-PCR扩增结果见表5,部分引物扩增产物的电泳结果见图9),以对确立的优化体系进行验证,检测其稳定性。
由表4可以看出,16条引物共扩增出条带199条,其中多态性条带195条,多数集中在250 bp~1600 bp处,不同的引物扩增出的条带数在6条~20条,每个引物的多态性百分率为 83.33% ~100%,多态性比率为97.99%。
从图9及表4中可以看出扩增条带丰富清晰,重复性好,多态性高。说明建立的新疆贝母属ISSR-PCR反应体系稳定可靠,可进一步用于后续新疆贝母属8种药用贝母的分子标记研究中。

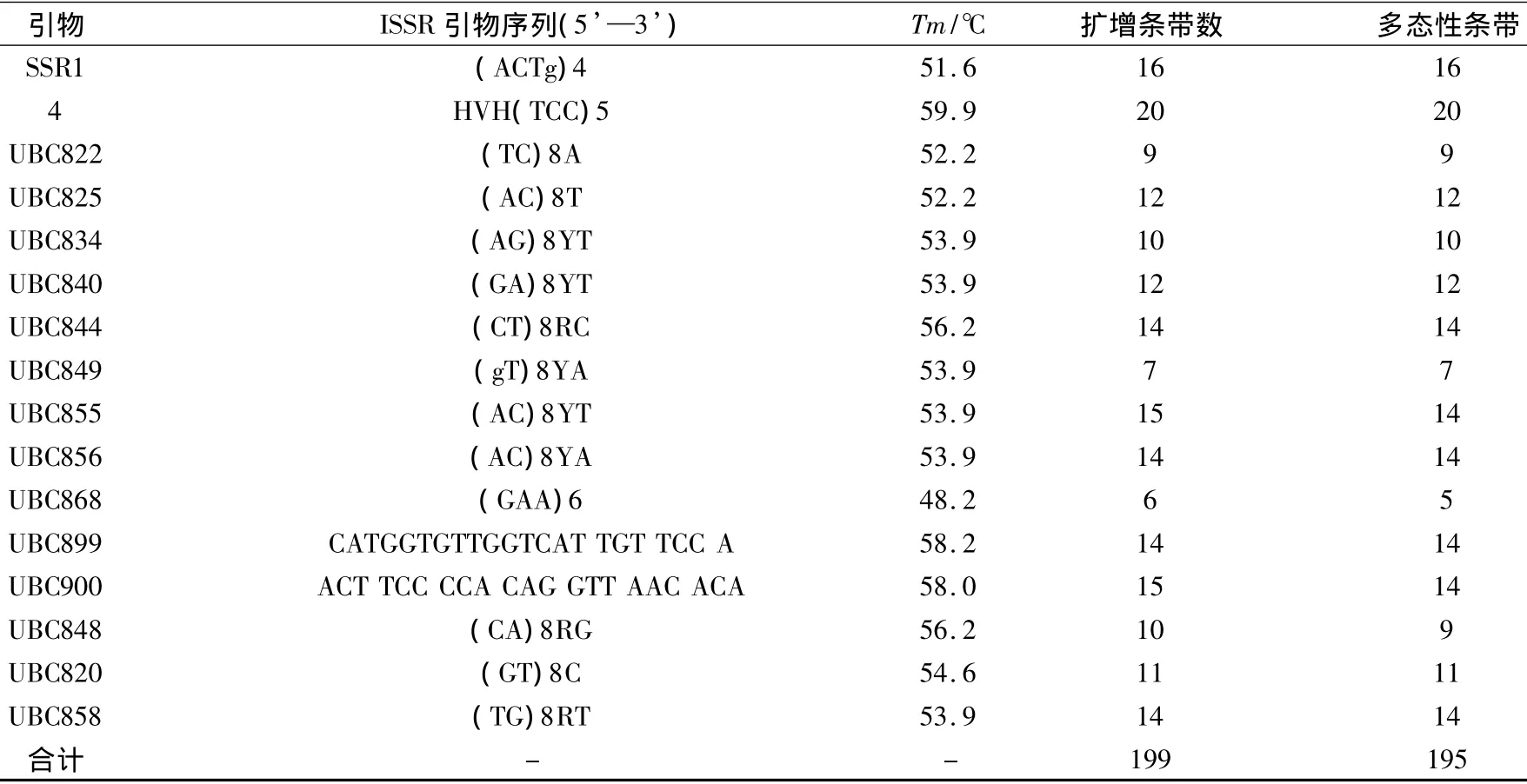
表5 用于新疆贝母属药用贝母总DNA的ISSR-PCR反应的引物序列、退火温度及扩增结果
3 讨论
ISSR是一种基于PCR反应基础的分子标记技术,其扩增结果的稳定性、特异性和重复性受到因素Taq DNA 聚合酶、dNTPs、Mg2+、引物浓度、模板 DNA含量的影响。本研究通过单因素实验确定了适合的因素水平范围,由方差分析结果得出因素Mg2+对反应体系的影响最大,其余因素的影响大小依次为TaqDNA 聚合酶、模板 DNA、dNTPs、引物。
退火温度、循环次数、延长时间对反应体系也有显著的影响。这些在王果平[7]的研究中未见考察说明。退火温度过高会影响引物和模板的结合,条带较弱;退火温度过低会产生过多杂带。退火温度实验结果显示,试验中的引物UBC853的最适退火温度为49.8℃与其理论退火温度(Tm值53.9℃)相差4.1℃,说明最适退火温度应在理论退火温度值的基础上降低4℃~5℃。本实验曾对循环次数和延长时间做过预实验,通过循环次数试验发现,在小于35 cycle时,几乎无条带,故设定循环次数为35、38、40、45 cycle,每个循环平行做两组,发现 40、45 cycle条带强弱合适,40 cycle的两组条带中一组有弥散,说明40 cycle稳定性略差,45 cycle条带均较好,稳定性好。延长时间同样影响着扩增结果,延长时间过短,谱带暗淡,过长谱带不稳定,而10 min得到的条带强弱合适,清晰可辨,故延长时间为10 min最佳。
单因素试验设计可直观快速的表现出各因素对反应体系的影响,正交试验能体现各因素间互作效应的特性。本实验较王果平[7]研究中单因素的5水平梯度,将水平设定增加至8个梯度,考察范围更加广泛;正交试验设计为5因素4水平重复3次进行评分,降低主观因素的影响, 最终结合单因素试验与正交设计试验,确定新疆贝母属药用贝母的ISSR-PCR最佳反应体系(50 μL):5 μL 10 × Buffer 、2.5 mmol/L Mg2+、0.30 mmol/L dNTPs 、0.8 μmol/L 引物、0.75 U Taq 酶、1.0 ng/μL 模板 DNA、33.35 μL ddH2O。这与王果平[7]的研究结果 20 μL 体系有所不同,50 μL 体系虽耗用试剂较多,但增加了实验的精准性,降低操作中由移液器带来的不可避免的误差,更加稳定可靠。UBC853的最适退火温度为49.8℃,体系循环次数为45 cycle,延伸时间10 min。且通过此体系筛选出了16条适合于新疆贝母属药用贝母的ISSR引物,对新疆贝母属8种药用贝母共23份样品进行ISSR-PCR扩增加以验证,得到结果重复性好,多态性高,说明确立的ISSR-PCR优化体系适用于新疆贝母属药用贝母,为进一步研究新疆贝母属8种药用贝母的遗传多样性打下基础。
[1]中国科学院中国植物志编辑委员会.中国植物志:第14卷[M].北京:科学出版社,1980.
[2]国家药典委员会.中国药典:一部[S].北京:化学工业出版社,2010:132.
[3]新疆生物土壤沙漠研究所.新疆药用植物志[M].乌鲁木齐:新疆人民出版社,1977:186-199.
[4]张磊,张含国,李雪峰,等.落叶松种间及无性系间ISSR鉴别技术的研究[J].植物研究,2008,28(2):216-221.
[5]Huo Guang,Li Defang,Chen Anguo.Genetic diversity analysis of 44 shares of hibiscus Cannabinus germplasm resources using ISSR molecular marker[J].Agricultural Science & Technology,2009,10(3):63-67.
[6]吴晨炜,周凌瑜,王秀丽,等.小苍兰种质遗传多样性的ISSR分析[J].植物研究,2009,29(3):357- 361.
[7]王果平,樊丛照,李晓瑾,等.新疆贝母DNA提取及ISSRPCR 体系的建立与优化[J].种子,2012,31(8):27-30,35.
[8]宋丽,刘友平.花椒RAPD-PCR反应体系的建立与优化[J].中国药房,2011,22(31):2889-2891.
[9]张福生,郭顺星.金线莲ISSR反应体系的建立与优化[J].中草药,2011,42(1):137-142.
[10]徐奭,张耀川,李树成,等.银杏ISSR-PCR反应体系的建立与优化[J].生物技术通报,2012,23(1):80.
