人毛囊干细胞分离培养与鉴定方法的研究
2015-08-09姜金豆胡葵葵陈容容夏学颖李丽燕张碧芳
姜金豆, 胡葵葵, 陈容容, 夏学颖, 孙 赛, 李丽燕, 张碧芳
毛发移植
人毛囊干细胞分离培养与鉴定方法的研究
姜金豆, 胡葵葵, 陈容容, 夏学颖, 孙 赛, 李丽燕, 张碧芳
目的实现毛囊干细胞的高效快速分离。方法将人头部皮肤标本显微分离毛囊隆突区组织由中性蛋白酶消化后,将其直接接种于Matrigel包被的培养板中培养。细胞迁出后,待细胞融合达到60%~70%时,传代培养。取传代培养4周的人毛囊干细胞进行流式细胞学分析及克隆形成能力测定,鉴定毛囊干细胞的表型及增殖潜能。结果分离培养所得毛囊干细胞呈铺路石样生长,细胞胞体较大,细胞核大而明显,具有较高的核质比,干细胞细胞学特征明显。流式细胞仪鉴定毛囊干细胞表面标记物Lgr5阳性率为84.02%,Lgr6阳性率为66.32%。细胞增殖能力及克隆形成能力测定结果显示,毛囊干细胞具有较强的增殖潜能,可由单细胞生成明显的克隆集落。结论本研究通过显微解剖结合消化法, 实现了人头皮毛囊干细胞的高效快速分离培养。采用显微分离培养获得毛囊隆突区细胞,细胞表型分析证实其Lgr5及Lgr6阳性干细胞比率、细胞形态、细胞周期及克隆形成能力均符合干细胞特性。
人毛囊干细胞; Lgr5; Lgr6; 细胞增殖
毛发移植是目前治疗各种原因所致的毛发缺损性疾病较为常用的手术方法,手术主要以枕部毛发为供区来源,但对于大面积秃发且供区不足的患者,该技术的应用及效果会受到严重的影响。毛囊组织工程的研究为这些问题的解决带来了希望。研究表明,Lgr5标记的干细胞可参与所有毛囊细胞系的再生[1]。在哺乳动物中存在一种与Lgr5相类似的基因,即Lgr6[2]。目前研究者已经明确了部分鼠毛囊干细胞(hair follicle stem cells, HFSCs)特异性表面标记物,而人类毛囊与鼠还存在着一定的表型差异,相关HFSCs分选方法尚未完全确定。为了能够分离出适用于临床应用的HFSCs,自2013年12月起,我们对干细胞相关表面标记物进行了系统深入的研究,目的在于分析人HFSCs,应用Lgr5及Lgr6鉴定人毛囊隆突区细胞。
1 材料来源
人毛发组织来源于广东省妇幼保健院医学美容科眉毛移植术残余的耳后毛囊组织及面部提升术切除的额颞部毛发组织。共12例患者。男性2例,女性10例;年龄21~39岁。面部提升术者1例,眉毛种植者11例。所有患者均签署手术同意书,同意将手术残存组织用于非营利性科学研究。
2 实验试剂
细胞培养试剂:胎牛血清(SH30087.01,美国HYCLONE公司)、DMEM(SH30023.01B,美国HYCLONE公司)、青链霉素(SH30010,美国HYCLONE公司)、PBS磷酸钾缓冲液(SH30256.01B,美国HYCLONE公司)、Annexin V-APC细胞凋亡检测试剂盒(KGA106,南京KEYGEN公司)、cellTiter96AQ单溶液细胞增殖检测试剂(G3582,美国PROMEGA公司)。
3 实验方法
3.1 培养基的制备 自制培养基由DMEM与Ham′s F-12培养基3∶1配制,添加5%胎牛血清、1.00%Gluta-MAX、1.00%非必须氨基酸、0.10%青霉素-链霉素。20 ng/ml碱性成纤维细胞生长因子,10 ng/ml表皮生长因子(美国INVITROGEN公司)在换液或传代时加入,以减少培养基对生长因子的吸收。
3.2 干细胞的原代分离培养 人头皮标本先由复方氯化钠润洗,去除多余脂肪,显微剪分离处于毛囊峡部和毛球上部之间的隆突区组织,其深度起始位距表皮约1.00 mm,延伸深度约1.80 mm[3],将分离的少量隆突区组织行免疫荧光染色HFSCs表面标记物鉴定后,将大批量隆突区组织应用 10 ng/ml 中性蛋白酶37 ℃下消化45 min后接种。将组织直接接种于Matrigel包被的培养板中,在37 ℃、5%CO2饱和湿度的孵箱中培养。细胞迁出后待细胞融合达到60.00%~70.00%时,以0.25%胰酶37 ℃下振荡消化5~10 min,收集细胞传代培养。每3~4 d换液1次,观察细胞的增殖能力及形态学特征。细胞每2周传代1次。取传代培养4周的HFSCs进行流式细胞学分析及克隆形成能力测定,鉴定其表型及增殖潜能。
3.3 细胞表型检测 收集细胞,用0.25%胰酶消化,重悬细胞,制成单细胞悬液,并计数。用PBS洗涤细胞,加入对应抗体,避光、孵育后洗涤并离心收集。加入100 μl Fix&Perm 中的Reagent A(即固定液), 室温避光孵育15 min。加入200 μl PBS准备上机。
3.4 细胞周期分析 离心收集细胞,弃上清,洗涤后加入预冷70%乙醇固定过夜。PBS洗涤细胞后加入500 μlPBS,内含50 μg/ml溴化丙锭(7-AAD),100 μg/ml RNase A, 0.2%Triton X-100, 4 ℃避光孵育30 min。以标准程序用流式细胞仪检测,一般计数2×104~3×104个细胞,结果用细胞周期拟和软件ModFit分析。3.5 克隆形成实验 消化细胞后吹打成单细胞悬液,细胞计数,稀释成1×103个细胞/ml接种于96孔板,吸50 μl接种即50个细胞/孔,吸100 μl接种即100个细胞/孔,吸200 μl接种即200个细胞/孔。接种完毕,各孔补加培养基至300 μl/孔。培养7 d后, PBS漂洗后加200 μl结晶紫充分覆盖20 min,后将96孔板冲洗固定后计算集落数。
4 结果
4.1 HFSCs的定位、分离培养及鉴定 平均每次实验分离60~100个完整毛囊, 免疫荧光显示毛囊隆突区部分Lgr6免疫荧光阳性(图1),显微分离法结合消化法所获取的隆突区组织在培养第3天开始有细胞迁出,第7天时细胞迁出明显(图2)。传代后细胞呈铺路石样生长,细胞胞核大而明显,具有较高的核质比(图3)。经细胞免疫荧光染色,发现了部分Lgr6/CD200双阳性细胞(图4),流式细胞仪鉴定HFSCs表面标记物Lgr5阳性率为84.02%,Lgr6阳性率为66.32%,CD200阳性率为55.31%。结果表明,实验显微解剖结合消化法所获取的毛囊隆突区细胞是一种由多种干细胞亚群组成的复合细胞群。Lgr6、CD200、Lgr5不同标记物之间存在部分表达重叠现象。4.2 细胞周期分析 流式细胞仪细胞周期分析结果显示,HFSCs的G1、G2及S期比率分别为59.82%、7.01%及33.17%,S/G2/M期细胞比率较高,细胞周期分析结果符合干细胞特性(图5)。4.3 克隆形成能力测定 显微分离结合酶消化法获得的HFSCs具有较高的克隆形成能力,约(72.00±9.00)%,克隆集落形成面积较大,集落数较多,大面积克隆集落单位所占比率较高,表明所分离细胞具有较强的增殖潜能,其特征符合干细胞特性(图6)。
5 讨论
本研究细致深入地探索了体外培养的人HFSCs特异性标记物的表达,对体外培养环境下人HFSCs的增殖、细胞周期变化及细胞克隆形成能力进行了系统性分析。与胚胎干细胞及骨髓间充质干细胞等相比,HFSCs来源极为广泛,易于获取,无致癌性,在伦理学问题等诸多方面具有其他组织来源干细胞所不可比拟的优点。毛囊隆突区具有干细胞微环境的特点,隆突区角质细胞增殖缓慢,细胞周期较长。隆突区是毛囊的恒定组成部分,隆突区之下的结构可随毛囊周期变化而在退行期发生凋亡退化。人毛囊拔出后,可去除隆突区之下的大部分毛囊上皮结构,毛发仍可再生[4]。隆突区基底膜部分可起到保护隆突区角质细胞的作用。新的研究表明,隆突部位的干细胞具有多向分化潜能,可分化为角质细胞、神经元细胞、神经胶质细胞、平滑肌细胞、黑色素细胞及软骨细胞[5]。
干细胞疗法为再生医学提出了一个新的研究方向,然而现实中缺乏足够量的多向分化潜能干细胞来修复组织损伤,这使得数量上相对充足的HFSCs应用受到重视。在自体移植之前,HFSCs的体外扩增尤为重要。而HFSCs的相对静止特性使其体外增殖缓慢,临床应用存在诸多限制。目前,尚未有报道建立大规模HFSCs的细胞团培养方法。HFSCs的分离方法复杂、耗时,常需要在显微镜下操作或单个毛囊进行处理,效率不高,分离后由于受外根鞘及真皮纤维结缔组织鞘的限制,迁出率普遍偏低,且经过数次传代后,干细胞表型阳性率明显下降。针对上述问题,我们在前期相关研究的支持下,对HFSCs分离培养、筛选及功能鉴定等开展了多方面的研究。通过显微精确解剖结合酶消化法,实现了人HFSCs的高效分离培养,大大提高了隆突区细胞的迁出率,通过Matrigel包被培养,模拟体内细胞外基质环境,对培养后的人HFSCs表型、细胞周期及克隆形成能力等进行了细致深入分析,为本研究小组后续的HFSCs信号通路研究、组织工程学研究及再生医学研究等诸多方面打下了坚实的基础。
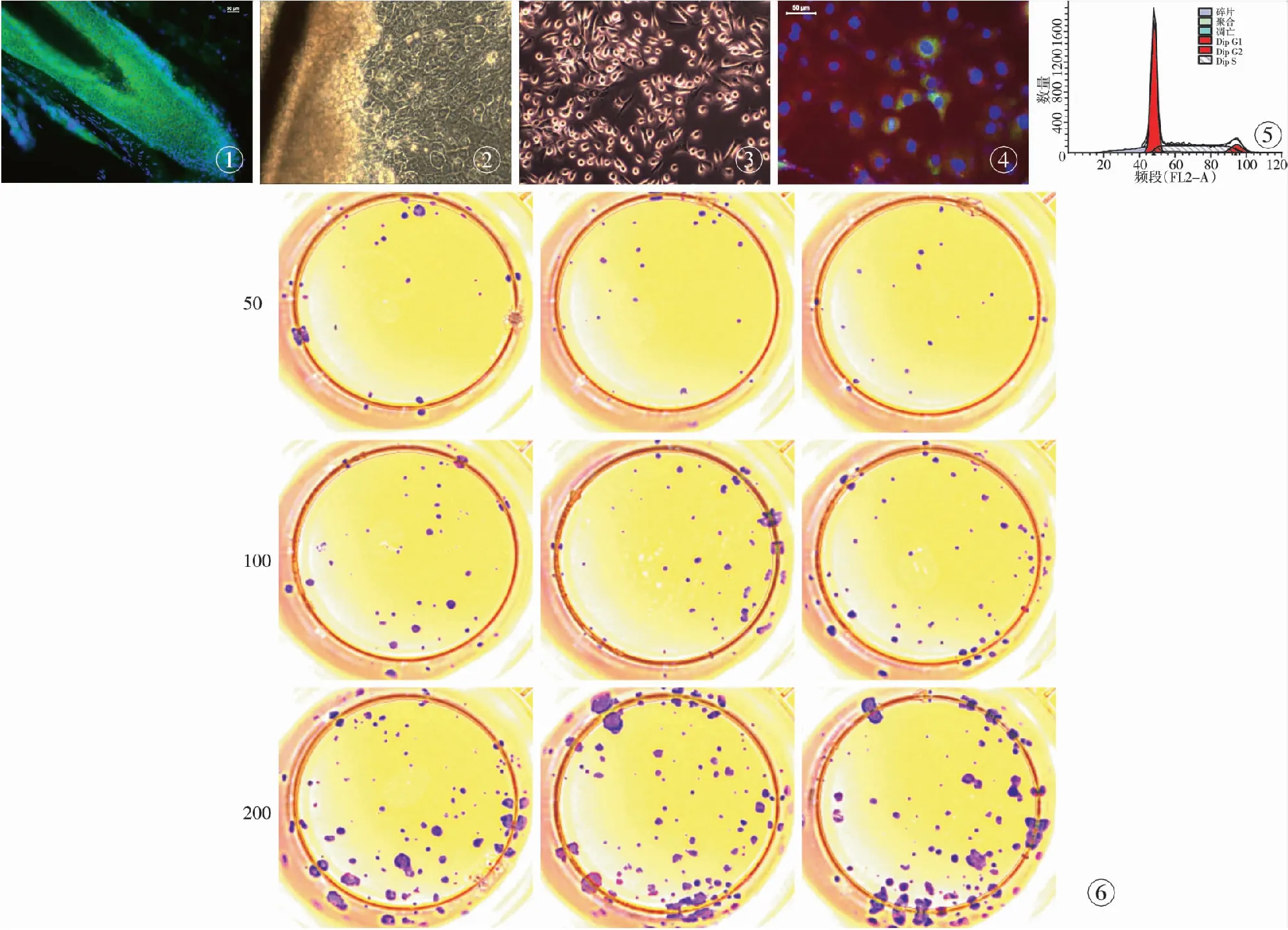
图1 毛囊外根鞘Lgr6免疫荧光染色 图2 毛囊隆突区细胞7 d时迁出情况(×100) 图3 传代培养后细胞图像P1(×100) 图4 HFSCsLgr6、CD200免疫荧光双染结果,黄色为Lgr6、CD200双阳性细胞 图5 人HFSCs细胞周期流式分析结果 图6 人HFSCs细胞平板克隆实验
人HFSCs主要定位于隆突区,起始于皮脂腺导管开口,向下延伸至立毛肌插入点之下,相关文献报道结合小组的多项免疫荧光分析结果表明,这一区域深度约距表皮1.00 mm,延伸深度约1.80 mm。头皮毛囊平均长度为4.16 mm。壶腹部长度为0.76 mm,峡部为0.89 mm,毛囊下部为2.50 mm。立毛肌插入点深度为1.65 mm。毛囊不同部位细胞的标记物表达存在明显差异,毛囊中不同分化层面的标记物差异较大。目前研究中常见的HFSCs标记物为Lgr5[1]、Lgr6[2]、CD20、CK15、CD34等[6-8]。
最新研究证实,毛囊中不同干细胞亚群沿隆突区外根鞘由上自下分化[9],其中Lgr5阳性HFSCs位于隆突区下部,具有极强的增殖能力,广泛地参与毛囊再生过程,Lgr5阳性细胞的增殖过程多为Wnt通路依赖性。Hugo等研究证实,Lgr6阳性干细胞位于隆突区上部的毛囊恒定区,与Lgr5标记物相比,Lgr6阳性干细胞移植后可再生出包括皮脂腺,表皮在内的所有皮肤细胞系,且该种细胞的增殖过程并不依赖于Wnt通路的激活[10]。部分动物研究认为,Lgr6阳性细胞可能是一种比传统隆突区细胞更为原始的干细胞群。CD200为一种传统的人HFSCs标记物,定位于隆突区中较为局限的部分,本实验中对不同标记物分析表明,Lgr6与CD200存在部分表达重叠,此种双阳性细胞亚群的增殖及分化潜能仍有待进一步研究。实验中首次将显微精确解剖结合酶消化法获取的HFSCs进行了Lgr5 、Lgr6、CD200阳性率分析,为后续的Wnt通路研究奠定了分子细胞生物学基础。
我们应用Lgr6、Lgr5、CD200作为HFSCs的特异性标记物,分离出的HFSCs具有较强的克隆形成能力。显微分离结合酶消化法所获得HFSCs克隆形成能力约为(72.00±9.00)%,克隆集落形成面积较大,集落数较多,大面积克隆集落单位所占比率较高。传代后细胞呈铺路石样生长,细胞胞核大而明显,具有较高的核质比。流式细胞仪鉴定HFSCs表面标记物Lgr5阳性率为84.02%,Lgr6阳性率为66.32%,CD200阳性率约为55.31%。符合干细胞特性。本实验所获取的毛囊隆突区细胞,研究发现显微分离所获得的毛囊隆突区细胞中Lgr5阳性率较高,而CD200表达较低,不同标记物于毛囊外根鞘的表达覆盖仍有待进一步的系统性免疫组化定位分析。本研究实现了HFSCs的高效快速分离,为HFSCs在再生医学领域的应用提供了新的研究策略。
本研究通过显微解剖结合消化法成功实现了人头皮HFSCs的高效快速分离培养。采用显微分离培养获得毛囊隆突区细胞,细胞表型分析证实其Lgr5、Lgr6、CD200阳性干细胞比率较高,且细胞形态,细胞周期及克隆形成能力均符合干细胞特性。
[1] Jaks V, Barker N, Kasper M, et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells[J]. Nat Genet, 2008,40(11):1291-1299.
[2] Van Loy T, Vandersmissen HP, Van Hiel MB, et al. Comparative genomics of leucine-rich repeats containing G protein-coupled receptors and their ligands[J]. Gen Comp Endocrinol, 2008,155(1):14-21.
[3] Jimenez F, Izeta A, Poblet E. Morphometric analysis of the human scalp hair follicle: practical implications for the hair transplant surgeon and hair regeneration studies[J]. Dermatol Surg, 2011,37(1):58-64.
[4] Moll I. Proliferative potential of different keratinocytes of plucked human hair follicles[J]. J Invest Dermatol, 1995,105(1):14-21.
[5] Sieber-Blum M, Grim M, Hu YF, et al. Pluripotent neural crest stem cells in the adult hair follicle[J]. Dev Dyn, 2004,231(2):258-269.
[6] Inoue K, Aoi N, Sato T, et al. Differential expression of stem cell associated markers in human hair follicle epithelial cells[J]. Lab Invest, 2009,89(8):844-856.
[7] Najafzadeh N, Esmaeilzade B, Dastan Imcheh M. Hair follicle stem cells: In vitro and in vivo neural differentiation[J]. World J Stem Cells, 2015,7(5):866-872.
[8] Balańá ME, Charreau HE, Leirós GJ. Epidermal stem cells and skin tissue engineering in hair follicle regeneration[J]. World J Stem Cells, 2015,7(4):711-727.
[9] Woo WM, Oro AE. SnapShot: hair follicle stem cells[J]. Cell, 2011,146(2):334-334.
[10] Fuchs E, Horsley V. More than one way to skin[J]. Genes Dev, 2008,22(8):976-985.
Thestudyofsolatedcultureandidentificationmethodofhumanhairfolliclestemcells
JIANGJin-dou,HUKui-kui,CHENRong-rong,etal.
(DepartmentofPlasticSurgery,GuangdongWomanandChildrenHospital,Guangzhou510010,China)
ObjectiveTowards efficient expansion of human hair follicle stem cells in vitro.MethodsHair follicles derived from scalp skin were incubated in Dispase. Matrigel coated flasks were designed for culture of HFSCs. HFSC grown from enzymatically digested human hair follicles were passaged after they grew with 60%~70% conflunce. Phenotype was evaluated by light microscopy and flow cytometry after 4 weeks in culture. The expression of stem cell markers, cell cycle , cell apoptosis and viability were investigated.ResultsHuman hair follicles were cultured for a week, round and phase bright cells with big nucleus migrating from the primary culture of human hair follicle bulge areas. Cell surface marker expression was profiled by flow cytometry and about 84.02% of the sorted cells were positive for Lgr5 expression, 66.32% cells were positive for Lgr6. Grown at clonogenic density showed a high self renewal capacity in colony formation.ConclusionHFSC were efficiently expanded after micro dissection and enzymatically digestion. Round, phase bright human hair follicles cells migrated from the primary culture of human hair follicle bulge areas, cell cycle, cell apoptosis and viability indicate that HFSC represent a subpopulation of cells that are positive for Lgr6, Lgr5.
Human hair follicle stem cells; Lgr5; Lgr6; Cell proliferation
510010 广东 广州,广东省妇幼保健院 医学美容科
姜金豆(1985-),男,江苏人,住院医师,博士.
10.3969/j.issn.1673-7040.2015.11.002
R329
A
1673-7040(2015)11-0644-04
2015-05-13)
