不同年龄段前列腺外周带基质细胞ARAR活性差异对前列腺上皮细胞增殖的影响*
2015-08-04邹青松梁胜杰毛师魁蒿魁元夏术阶韩邦旻上海市第一人民医院泌尿外科上海200080
邹青松 梁胜杰 高 原 毛师魁 蒿魁元 夏术阶 韩邦旻上海市第一人民医院泌尿外科(上海 200080)
·论 著·
不同年龄段前列腺外周带基质细胞ARAR活性差异对前列腺上皮细胞增殖的影响*
邹青松 梁胜杰 高 原 毛师魁 蒿魁元 夏术阶 韩邦旻**
上海市第一人民医院泌尿外科(上海 200080)
摘要目的 探讨年轻和老年前列腺外周带基质细胞AR活性差异及对前列腺上皮细胞的增殖影响。方法 不同年龄段前列腺基质细胞给予生理浓度 10nM DHT刺激,荧光素酶报告基因检测AR转录活性差异,Elisa检测AR调控因子FGF-2,KGF,IGF-1分泌差异。CCK8检测与BPH-1及LNCaP共培养后BPH-1及LNCaP增殖情况。免疫组化,Q-PCR,Westernblot探究不同年龄前列腺基质细胞ARA55表达,慢病毒干扰ARA55,给予10nM DHT刺激,Western-blot检测基质细胞AR表达差异,荧光素酶报告基因检测基质细胞AR转录活性差异,Elisa检测FGF-2,KGF,IGF-1分泌差异。CCK8检测阴性对照组(ARA55-sc)与干扰组(ARA55-sh)与BPH-1及LNCaP共培养后BPH-1及LNCaP增殖情况。结果 基质细胞给予10nM DHT刺激,老年基质细胞AR转录活性、AR调控细胞因子FGF-2,KGF,IGF-1及对上皮细胞(BPH-1、LNCaP)促增殖高于年轻人(P<0.05)。老年基质细胞ARA55表达高于年轻人。干扰基质细胞ARA55后,不同年龄段基质细胞AR表达无差异,老年基质细胞ARA55-sh较ARA55-sc AR转录活性、AR调控细胞因子FGF-2,KGF,IGF-1分泌及对上皮细胞(BPH-1、LNCaP)促增殖降低(P<0.05),而年轻人基质细胞ARA55-sh与ARA55-sc无差异(P>0.05)。结论 在10nM DHT刺激下,老年人基质细胞AR活性强于年轻人。老年基质细胞可能通过高表达ARA55增强AR转录活性和AR调控细胞因子分泌,促进BPH-1及LNCaP增殖。
关键词前列腺肿瘤; 间质细胞; 细胞因子类
前列腺癌是一种严重威胁男性健康的恶性肿瘤。2013年美国约有238 590例新增前列腺癌病人,并有约29 720人死于前列腺癌,成为危害男性健康第一位的肿瘤。前列腺癌是年龄相关性疾病,年龄被认为是前列腺癌发生的高危因素之一,在老年男性中前列腺癌的发生率逐年增高[1]。基质细胞在前列腺癌的发生,发展中发挥着重要作用,肿瘤发生和恶性转化都受到部分异常基质上皮相互作用机制的调控[2]。基质细胞通过分泌可溶性细胞因子改变前列腺基质微环境进而影响前列腺癌的进展[3]。前列腺为雄激素依赖性器官,雄激素受体(AR)信号系统对于前列腺癌的发生发展也起着非常重要的作用,基质细胞AR通过调节相关细胞因子的变化影响前列腺上皮的恶变及转移[4]。雄激素在前列腺癌的发生发展中发挥着重要的作用。然而,随着年龄增长,前列腺组织中双氢睾酮的浓度与前列腺癌发生无明显相关性[5]。该研究旨在研究不同年龄段前列腺外周带基质在生理浓度DHT刺激下AR活性差异及对前列腺上皮细胞(BPH-1、NCaP)增殖的影响并研究其相关机制。
材料和方法
一、材料
PCR引物合成:生工生物工程(上海)有限公司;SYBR Green PCR Master Mix:宝生物工程(大连)有限公司;ARA55抗体为Sata cruz公司,AR,APDH抗体为Abcam公司;CCK-8试剂盒 上海碧云天生物技术公司;慢病毒质粒为GENECHEM公司;ELISA试剂盒为RNG公司分装;ABI 7900 型荧光定量PCR 仪:美国应用生物系统公司;Luciferase测定相关试剂为Promega公司;液体闪烁计数器Luminometer,Beckman公司。
二、标本
老年人(55~75岁)[6, 7]前列腺标本取自我院因膀胱癌行根治性膀胱全切的患者共5例。tPSA均小于4 g/L,年轻人(23~29岁)前列腺标本取自遗体贡献者5例。按照McNeal 区带解剖法取前列腺外周带组织块。
三、方法
(一)免疫组化染色方法
前列腺外周带标本用10 %甲醛固定24 h , 石蜡包埋,5mm石蜡切片,常规脱蜡,逐级入水,3 % 过氧化氢孵育,0.01 mmol /L PBS(p H 7.4)冲洗3次,每次3min,热抗原修复7min,3 %过氧化氢阻断内源性过氧化物酶的活性,一抗(ARA55 1:100)过夜,PBS 洗3次,每次3min。每张切片加1滴二抗,室温下孵育20min,PBS 冲洗3 次,每次3 min,中性树脂封片。
(二)原代细胞培养
前列腺外周带组织,剪碎至约1mm2,I型胶原酶(200U/mL)于37℃、5%CO2孵箱内消化10h;149 m过滤筛过滤去除组织碎屑;770×g,4℃,离心10min; 弃上清液,加入含10%小牛血清的 RPMI-1640培养液5mL,吹打混匀后转移至25cm培养瓶,置于37℃,5%CO2孵箱培养。
(三)Q-PCR
根据Trizol试剂说明提取老年和年轻人外周带基质细胞总RNA,紫外分光光度法测定RNA浓度。按照逆转录反应试剂盒说明进行逆转录。将逆转录产物进行Q-PCR,引物序列如下:
ARA55
GAGATGAGGGTTTCCACGAG
CGCCGAGATGTAGTTATCCA
GAPDH
AGAAGGCTGGGGCTCATTTG
AGGGGCCATCCACAGTCTTC
(四)Western-blot
RIPA 裂解液冰上裂解基质细胞30min 4℃,10 000×g,10min。用蛋白定量试剂盒测定蛋白浓度,总蛋白30mg于8% SDS-PAGE gels电泳。膜封闭后进行抗原抗体反应,显影定影,分析。兔抗人AR(1:2000),兔抗人ARA55(1:1000),兔抗人GAPDH(1:2000)。
(五)CCK8
基质细胞2×104个接种于微孔双室共培养系统的下室,贴壁后加入无酚红RPMI-1640 +木炭处理过5%FBS +10nMDHT,空白组下室不接种细胞。BPH-1(或LNCaP)细胞5×103种植于上室,每孔加入无酚红RPMI-1640 200μL。上下室放在一起。培养箱中连续共培养1、2、3、4、5d。每上室内加入10mg/mL的CCK-8 20μl培养4 h。酶标仪检测各孔光密度值。
(六)慢病毒干扰
基质细胞接种于60mm皿,待细胞密度为30%时,根据慢病毒干扰说明书干扰ARA55,病毒滴度为102TU/ml,ARA55-sc为阴性对照。病毒转染12h后换液。
(七)双荧光素酶报告基因
基质细胞5×104接种于24孔板,贴壁后根据Lipofectamine2000说明书进行瞬时转染。MMTV 500ng,SV-40 5 ng共转染6h后换酚红处理的1640+木炭处理的55% FBS, 24h收获细胞,用被动裂解液裂解细胞。用Dual-Luciferase®Reporter Assay System (Promega)和液体闪烁计数器检测萤火虫荧光素酶和海肾荧光素酶的活性,取两次读数的比值作为相对转录活性,进行统计学处理。
(八)Elisa
将基质细胞2×105接种于6孔板,次日换2ml酚红处理的1640+木炭处理的5%FBS。48h后收集上清,根据ELISA试剂盒说明用双抗体夹心 ABC-ELISA法检测细胞因子FGF-2,KGF,IGF-1分泌量。
四、统计学处理(Statistical Analyses)
各组资料以x±s表示,两组间采用Student T-test进行统计学检验,各组间比较采用单因素方差分析(one way ANOVA)。P<0.05为有统计学差异。所有实验未标明重复数目者均为3次重复。
结 果
一、老年前列腺基质细胞ARAR通路活性较年轻人前列腺基质细胞高
在10nM DHT刺激24h后,荧光素报告基因检测发现:老年基质细胞AR转录活性明显高于年轻人前列腺基质细胞(P<0.05)(图1A1A)。DHT刺激基质细胞后检测上清发现:老年基质细胞AR调控因子FGF-2,KGF,IGF-1分泌高于年轻人基质细胞(P<0.05)(图1B1B、图1C1C、图1D1D)。

图1 10nM DHT 刺激下,前列腺基质细胞AR通路活性
以上结果说明老年人基质细胞AR通路活性较年轻人高,老年人基质细胞AR转录活性及AR调控因子分泌强于年轻人。
二、老年前列腺基质细胞对前列腺上皮细胞促增殖作用高于年轻人基质细胞
在10nM DHT刺激下,基质细胞与上皮细胞(BPH-1,LNCaP)共培养,年轻人、老年基质细胞都可以促进上皮细胞增殖,与上皮细胞单独培养组第2天出现差异(P<0.05)。老年基质细胞对上皮细胞的促增殖作用高于年轻人基质细胞,共培养后第2天出现差异(P<0.05)(图2A、图2B)。

图2 10nM DHT刺激下, 前列腺基质细胞对前列腺上皮细胞增殖影响
以上结果说明:在10nM DHT刺激下,前列腺基质细胞对上皮细胞增殖有促进作用,而老年人基质细胞对上皮细胞(BPH-1,LNCaP)的促增殖作用更强。
三、雄激素共调节因子ARA55在老年前列腺基质细胞中高表达
为了进一步研究老年基质细胞AR通路活性高于年轻人基质细胞机制,我们研究AR共调节因子
RA55在不同年龄段基质细胞表达情况。
在临床前列腺外周带标本中,我们通过免疫组化发现ARA55只表达于基质细胞,而不表达与上皮细胞,老年前列腺基质细胞ARA55染色强于年轻人,且核染细胞明显多于年轻人(图3A3A)。
在原代基质细胞中,激素刺激对ARA55表达无影响(图3C3C)。在10nM DHT 刺激下,Q-PCR和Westernblot同样验证了老年外周带基质细胞ARA55表达水平高于年轻人(P<0.05)(图3B3B、图3C3C)。

图3 ARA55在年轻人和老年人前列腺基质细胞中表达情况
这提示我们,激素刺激对基质细胞ARA55表达量无影响,ARA55特异性表达于前列腺基质细胞,老年前列腺基质细胞表达量高于年轻人。
四、慢病毒干扰ARA55ARA55后,基质细胞AR表达无变化
慢病毒干扰基质细胞A R A 5 5后,通过-PCR,Western-blot检测ARA55干扰效率发现:干扰基质细胞ARA55后,ARA55表达量明显下降(图4A、图4B)。基质细胞给予10nmol DHT刺激48h,Western-blot检测AR表达,年轻人和老年人基质细胞AR表达无明显差异(图4C4C)。
以上说明慢病毒可以高效干扰基质细胞ARA55,干扰ARA55并不影响基质细胞AR的表达。
五、干扰基质细胞ARA55ARA55后,10nmol DHTl DHT刺激下,老年基质细胞ARAR通路活性下降

图4 基质细胞ARA55ARA55干扰效率及干扰后对AR表达的影响
干扰基质细胞ARA55后,在10nmol DHT激素刺激下,老年基质细胞A R A 5 5-s h A R转录活性较老年ARA55-sc下降(P<0.05),而年轻人基质细胞A R转录活性A R A 5 5-s c与ARA55-sh无差异(P>0.05)(图5A5A)。老年基质细胞AR调控因子IGF-1、FGF2、KGF干扰后分泌下降(P<0.05),而年轻组干扰前后分泌无差异(P>0.05)(图5B5B、图5C5C、图5D5D)。
以上结果证明老年基质细胞高表达ARA55促进老年基质细胞AR通路活性。
六、老年基质细胞通过高表达ARA55ARA55促进前列腺前列腺上皮细胞增殖
基质细胞干扰A R A 5 5后,基质细胞与上皮细胞(BPH-1,LNCaP)共培养,老年基质细胞ARA55-sh较ARA55-sc对前列腺上皮细胞的增殖促进作用减弱,第2天增殖出现差异(P<0.05),而年轻ARA55-sh较ARA55-sc对上皮细胞增殖无明显差异(P>0.05)。基质细胞对上皮细胞的增殖较BPH-1,LNCaP单独培养增殖第2天出现差异有差异(P<0.05)(图6A6A、图6B6B)。
老年基质细胞高表达ARA55在促进上皮细胞(BPH-1,LNCaP)发挥着重要的作用。

图5 干扰基质细胞ARA55ARA55后,基质细胞ARAR通路活性差异
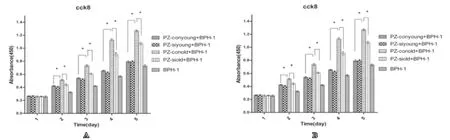
图6 干扰基质细胞ARA55ARA55后,与上皮细胞共培养,上皮细胞增殖差异
讨 论
前列腺是人体内唯一一个具有阶段性增长特征的器官[8]。不同年龄段前列腺生长速率不同,10~30岁和50~90岁为前列腺快速生长期[9]。前列腺癌也具有年龄相关性,多见于50岁以后的老年男性。我们前期研究发现,老年前列腺外周带基质细胞较年轻人能明显促进前列腺上皮细胞的生长[7]。基质细胞AR通过调控细胞因子分泌影响着前列腺微环境。AR在不同年龄段基质细胞中的作用存在差异,我们通过干扰不同年龄段前列腺基质细胞AR发现老年前列腺基质细胞R对前列腺上皮细胞的增殖作用更强[6]。
在前列腺癌的发生、发展过程中,基质上皮细胞之间的相互作用发挥着重要作用。而基质细胞主要通过分泌一系列细胞因子对上皮细胞发挥作用。
awada等[10]发现基质细胞分泌IGF-1可以促进前列腺癌的进展,小鼠前列腺基质细胞条件培养基可以使IGF-IR磷酸化进而促进前列腺癌细胞系LNCaP和U-145的增殖。而前列腺癌中IGF-1和AR信号之间存在正反馈,在HepG2和LNCaP细胞系中,AR与配体结合后,AREs与IGF1上游启动子结合,促进IGF1表达[11]。 FGF2可以通过旁分泌和自分泌的方式促进前列腺增生以及前列腺癌的发生和进展[12]。基质细胞AR通过调节FGF2,KGF,FGF10,HGF等细胞因子的分泌,改变前列腺微环境,促进前列腺癌的发生[4]。通过染色体免疫共沉淀发现,前列腺基质细胞系WPMY-1在雄激素刺激下,AR与ARA55共同结合GF的启动子上,促进KGF分泌[13]。
本研究发现前列腺基质细胞在10nM DHT刺激下,老年基质细胞较年轻人基质细胞更明显促进上皮细胞增殖,且老年基质细胞AR的转录活性及AR调控相关细胞因子分泌较年轻人高。而我们前期研究通过干扰基质细胞AR, 也证明了AR在不同年龄段基质细胞对上皮细胞增殖促进作用不同,老年基质细胞AR对上皮细胞促进增殖作用强于年轻人[6]。以上结果说明不同年龄基质细胞AR通路活性不同,引起不同年龄段前列腺微环境差异,进而引起对前列腺上皮细胞促增殖差异。
AR共调节因子通过增强(共激活因子)或抑制(共抑制因子)AR转录活性影响DHT在特定组织中的作用[14]。AR的转录活性受ARA70, ARA54 和 ARA55等雄激素受体相关蛋白调控(ARA)。
RA55是一种基质细胞特异性表达的AR共激活因子,ARA55通过调节基质细胞AR转录促进前列腺癌上皮细胞生长。ARA55以配体结合的方式与AR结合,其可以增强AR的转录活性,改变配体特异性[15]。Fujimoto等[16]通过RT-PCR发现高级别前列腺癌ARA55表达量高于低级别前列腺癌。而在雄激素难治性前列腺ARA55表达量低于未治疗的前列腺癌患者[17]。有研究者通过比较鼠的永生化成纤维细胞系(BALB/3T3和NIH 3T3)与非永生化细胞,发现随着培养代数的增加,ARA55在永生化细胞系中表达量明显低于非永生化细胞[18]。这提示我们ARA55作为一种重要的AR共激活因子可能在不同年龄段基质细胞表达存在差异。
我们通过研究基质细胞ARA55在不同年龄段基质细胞表达发现:ARA55只表达于前列腺基质细胞,老年人的基质细胞ARA55表达高于年轻人。干扰基质细胞ARA55后,给予生理浓度DHT刺激, 老年基质细胞AR信号通路活性和AR调控因子分泌功能下降,对上皮细胞的促增殖作用下降。这说明老年基质细胞高表达ARA55增强基质细胞AR通路活性,改变前列腺微环境进而促进上皮细胞增殖。
通过本研究我们发现,不同年龄基质细胞AR通路活性不同,老年基质细胞AR通路活性高于年轻人,老年基质细胞可能通过高表达共调节因子ARA55,促进AR转录活性及AR调控相关因子分泌促进前列腺上皮细胞增殖。这为我们研究老年高发前列腺癌提供了一个新的方向
参 考 文 献
1 Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA: Cancer J Clin 2013; 63(1): 11-30
2 Cunha GR, Hayward SW, Wang YZ, et al. Role of the stromal microenvironment in carcinogenesis of the prostate. Int J Cancer 2003; 107(1): 1-10
3 Barclay WW, Woodruff RD, Hall MC, et al. A system for studying epithelial-stromal interactions reveals distinct inductive abilities of stromal cells from benign prostatic hyperplasia and prostate cancer. Endocrinology 2005; 146(1): 13-18
4 Ricke EA, Williams K, Lee YF, et al. Androgen hormone action in prostatic carcinogenesis: stromal androgen receptors mediate prostate cancer progression, malignant transformation and metastasis. Carcinogenesis 2012; 33(7): 1391-1398
5 Sampson N, Untergasser G, Plas E, et al. The ageingmale reproductive tract. J Pathol 2007; 211(2): 206-218
6 Lu YY, Jiang B, Zhao FJ, et al. Androgen receptors expressed by prostatic stromal cells obtained from younger versus older males exhibit opposite roles in prostate cancer progression. Asian J Androl 2013; 15(5): 672-678
7 Wang YC, Yu SQ, Wang XH, et al. Differences in phenotype and gene expression of prostate stromal cells from patients of varying ages and their infl uence on tumour formation by prostate epithelial cells. Asian J Androl 2011; 13(5): 732-741
8 Timms BG. Prostate development: a historical perspective. Differentiation 2008; 76(6): 565-577
9 Xia SJ, Xu XX, Teng JB, et al. Characteristic pattern of human prostatic growth with age. Asian J Androl 2002; 4(4): 269-271
10 Kawada M, Inoue H, Masuda T, et al. Insulin-like growth factor I secreted from prostate stromal cells mediates tumor-stromal cell interactions of prostate cancer. Cancer Res 2006; 66(8): 4419-4425
11 Wu Y, Zhao W, Zhao J, et al. Identifi cation of androgen response elements in the insulin-like growth factor I upstream promoter. Endocrinology 2007; 148(6): 2984-2993
12 Dow JK, deVere White RW. Fibroblast growth factor 2: its structure and property, paracrine function, tumor angiogenesis, and prostate-related mitogenic and oncogenic functions. Urology 2000; 55(6): 800-806
13 Heitzer MD, DeFranco DB. Hic-5/ARA55, a LIM domain-containing nuclear receptor coactivator expressed in prostate stromal cells. Cancer Res 2006; 66(14): 7326-7333
14 Mellor J. Dynamic nucleosomes and gene transcription. Trends in genetics: Trends Genet 2006; 22(6): 320-329
15 Fujimoto N, Yeh S, Kang HY, et al. Cloning and characterization of androgen receptor coactivator, ARA55, in human prostate. J Biol Chem 1999; 274(12): 8316-8321
16 Fujimoto N, Mizokami A, Harada S, et al. Different expression of androgen receptor coactivators in human prostate. Urology 2001; 58(2): 289-294
17 Miyoshi Y, Ishiguro H, Uemura H, et al. Expression of AR associated protein 55 (ARA55) and androgen receptor in prostate cancer. Prostate 2003; 56(4): 280-286
18 Shibanuma M, Mochizuki E, Maniwa R, et al. Induction of senescence-like phenotypes by forced expression of hic-5, which encodes a novel LIM motif protein, in immortalized human fi broblasts. Mol Cell Bbiol 1997; 17(3): 1224-1235
(2014-12-08收稿)
**通讯作者, E-mail: hanbm@163.com
doi:10.3969/j.issn.1008-0848.2015.03.001
中图分类号R 737.25
*基金项目资助: 国家自然科学基金(NO.81072096)
Differential AR transcriptional activity in prostatic stromal cells from patients of varying ages and its implications in the proliferation of prostate epithelial cells*
Zou Qingsong, Liang Shengjie, GaoYuan, Mao Shikui, Hao Kuiyuan, Xia Shujie, Han Bangmin**
Department of Urology, Shanghai First People's Hospital Affi liated to Shanghai Jiaotong University, Shanghai 200080, China Corresponding author: Han Bangmin, E-mail: hanbm@163.com
AbstractObjective To investigate AR transcriptional activity in stromal cells in prostate PZ from patients of varying ages and its infl uence on the proliferation of BPH-1 and LNCaP. Methodsthods AR transcriptional activity in stromal cells treated with 10nmol DHT was identifi ed by AR dual-luciferase reporter assay and the levels of of the secreted FGF-2, KGF, IGF-1 were assessed by ELISA. The proliferation of BPH-1 and LNCaP cocultured with stromal cells was measured by Counting Kit-8. The expressions of ARA55 expression in stromal cells in prostate PZ from patients of varying ages were detected by HIC,Q-PCR, and Western blot. The expression of ARA55 in stromal cells was knocked down by lentivirus andtreated with 10nM DHT. Resultssults AR transcriptional activity and the level of the secreted AR-regulated cytokines in stromal cells treated with 10nM DHT from old patients were higher than those of young donors. The stromal cells from old patients could signifi cantly promote proliferation of BPH-1 and LNCaP. The ARA55 expression in prostate PZ from young donors and old patients were different and the expression of ARA55 was higher in old patients. The expression of AR showed no differencein in stroma cells with ARA55 inhibition in patients of varying ages. AR transcriptional activities and the levels of the secreted FGF-2, KGF, IGF-1 were lower in ARA55-sh than those in ARA55-sc in old patients (P<0.05). The proliferation of BPH-1 and LNCaP decreased cocultured with stromal cells ARA55-sh as compared with ARA55-sc in old patients (P<0.05) however, no obvious differences were shown in ARA55-sh and ARA55-sc in young donors (P>0.05). Conclusionusion AR transcriptional activity and the secretion of AR-regulated cytokines were higher in stromal cells from old patients than those from young donors. The over expression of ARA55 in stromal cells from old patients could promote the proliferation of BPH-1 and LNCaP by increasing AR transcriptional activity and the secretion of AR-regulated cytokines.
Key wordsords prostatic neoplasms; stromal cells; cytokines
