ACRV1在正常男性和弱精子症患者精液精子中的表达差异*
2015-08-01颜秋霞漆正宇赵晓英郭晓燕陈彩蓉蔡志明唐爱发广东省清远市人民医院暨暨南大学附属清远人民医院生殖中心清远558北京大学深圳医院广东省男性生殖与遗传重点实验室深圳市第二人民医院暨深圳大学第一附属医院科教科
颜秋霞漆正宇赵晓英郭晓燕陈彩蓉蔡志明唐爱发**. 广东省清远市人民医院暨暨南大学附属清远人民医院生殖中心(清远 558);. 北京大学深圳医院广东省男性生殖与遗传重点实验室;. 深圳市第二人民医院暨深圳大学第一附属医院科教科
ACRV1在正常男性和弱精子症患者精液精子中的表达差异*
颜秋霞1漆正宇2赵晓英1郭晓燕1陈彩蓉1蔡志明3唐爱发3**
1. 广东省清远市人民医院暨暨南大学附属清远人民医院生殖中心(清远 511518);
2. 北京大学深圳医院广东省男性生殖与遗传重点实验室;
3. 深圳市第二人民医院暨深圳大学第一附属医院科教科
摘要目的 研究精子顶体小泡蛋白-1(ACRV1)在正常人和弱精子症患者精液精子中的表达差异,探讨ACRV1在弱精子症发生机制中的作用。方法 采用计算机辅助精液分析(CASA)技术对精液进行常规分析,经非连续密度梯度离心分离纯化正常男性和弱精子症患者精液精子,以排除生精细胞和白细胞的污染。采用实时荧光定量PCR(Real-time PCR)和免疫印迹(Western Blot)方法,从mRNA和蛋白水平检测ACRV1的表达及其差异。结果 Real-time PCR结果表明,ACRV1 mRNA在弱精子症患者精子中的表达量明显低于其在正常对照组精子中的表达量,下降了5.9倍。Western Blot发现ACRV1蛋白在弱精子症组较正常组下降,该结果与Real-time PCR结果相一致。结论 ACRV1基因及蛋白在弱精子症患者精子中的表达下调可能与精子活力下降有密切关系,提示ACRV1基因及蛋白可能是导致弱精子症发生的原因之一。
关键词ACRV1; 聚合酶链反应; 印迹法, 蛋白质; 弱精子症
在全世界范围内,不孕不育症占育龄夫妇的15%左右,其中男性因素导致不孕不育的占50%[1, 2]。男性不育的重要原因之一就是精子活力低下所导致的弱精子症,80%的男性不育与精子活动障碍有关,其中20%与精子活动力低下直接相关[3]。弱精子症是男性不育的重要原因,表现为精子的运动能力低下,而精子头部结构的异常以及精子尾部轴丝和纤维鞘结构的异常,都可能影响精子鞭毛的运动,导致精子运动能力下降,最终导致弱精子症的发生[4]。在人和哺乳动物成熟精子中有2 000种以上不同基因的表达,它们在精子运动、精子获能和顶体反应过程中具有重要的作用[5-7]。到目前为止,一些基因如Tektin-2[8]、DNAH11[9]、AKAP4[10]、SEPT4等[11]和一些蛋白如ANXA5[12]、PRM2[13]、CLUpre[14]、SABP等[15]被证实与弱精子症的发生有关,但目前对弱精子症的病因和发病机制,尤其是精子运动和精子活动力低下的分子机理仍不清楚,因此研究精子运动和弱精子症的分子生物学机理成为一项迫切的任务。这将为探讨弱精子症发生的分子机制及寻找其治疗途径提供重要依据。
精子顶体小泡蛋白-1(Acrosomal vesicle protein 1,ACRV1)是一个精子顶体蛋白,在哺乳动物中高度保守,它在精、卵结合的顶体反应中扮演着重要角色[16-18]。我们的前期研究结果表明:ACRV1特异性地表达于小鼠和人的睾丸组织以及人睾丸组织的圆形和长形精子细胞中,这些结果提示,ACRV1可能在精子发生的过程中具有重要作用[19-21]。本研究拟采用Real-time PCR和Western Blot等技术,比较正常精子和弱精子症患者精子中ACRV1的表达差异,揭示ACRV1与精子活力的关系,以期为不育症的诊断、治疗及预后判断提供充分的分子生物学依据。
材料与方法
一、材料
RNAfast200 Kit购自上海飞捷;RevertAidTM First Strand cDNA Synthesis 试剂盒和 Taq DNA Polymerase PCR 试剂盒均购自Fermentas公司;SYBR Green qPCR master mix 购自OMEGA公司;鼠抗ACRV1一抗购自abvon公司;HRP-兔抗鼠IgG二抗购自santa公司。其他试剂均为分析纯。
二、方法
(一)精液样本收集
标本来源于广东省清远市人民医院生殖中心的门诊病人,按照第五版世界卫生组织标准[22],精液常规正常参考值:禁欲2~7d,精液量2~6mL,呈灰白色或淡黄色,pH 7.2~7.8,小于60min全部液化,精子浓度≥15 ×106/mL,精子活力:前向运动精子(PR)≥32%且PR+非前向运动精子(NP)≥40%。精子形态学检查方法:采用Diff-Quik快速染色法,油镜下观察精子形态,以正常精子形态≥4%为形态学正常诊断标准。白细胞<1×106/mL。弱精子症患者的精液标本:禁欲2~7d,精液量2~6 mL,呈灰白色或淡黄色,pH 7.2~7.8,小于60min全部液化,精子密度≥15×106/mL、精子活力PR级<32%或(PR+NP)级<40%。排除精浆抗精子抗体阳性,精浆果糖、α-糖苷酶、精浆锌和生殖激素等检查均正常。所有精液样本均排除感染、附睾或睾丸炎、系统性疾病史,且常规体格检查正常。临床标本收集经过清远市人民医院伦理委员会通过,所有标本收集前均告知患者,并获取患者知情同意。
(二)Percoll法分离精液
为避免圆形细胞的污染(生精细胞和白细胞),按文献方法[5],每次分别选取10份正常精液和10份弱精子症精液,液化后的精液经95%、76%、57%和47.5%的 Percoll非连续梯度离心 300×g,20min,收集正常组中95% Percoll以下的精子和弱精子症组中57%与76% Percoll层之间的精子, 磷酸盐缓冲液洗涤2次(600×g,5min),分离纯化后的精子储存于-80℃备用。
(三)精子总RNA提取和cDNA合成
取1~2×107精子,按照RNAfast200 Kit(上海飞捷)提取RNA。RNA提取步骤如下:(1)处理好的精子沉淀中,加入RA2液500μL,充分颠倒混匀min;(2)将样本裂解物吸入或倒入内套管,离心1min;(3)弃去外套管中液体,内套管中加入00 μL洗液,离心1min。再重复此过程洗一次;(4)取出内套管,弃去外套管中液体,仍然套回内套管,不加洗液,离心1min;(5)将内套管移入新的eppendorf管中,在膜中央加入洗脱液30μL,室温静置1min,离心1min,获得总RNA。紫外分光光度计定量后于-80℃储存备用。采用反转录反应试剂盒(Fermentas公司,美国)进行逆转录。取等量的精子总RNA 500ng,加oligo(dT)18 primer(0.5 μg/μL)1μL,加DEPC处理的水至12μl,70℃加热5 min后,加入5x反转录缓冲液4μL,RNA酶抑制剂(20u/μL)4 μL,10 mmol/L dNTP 2μL,37℃孵育5min,最后加入MMLV逆转录酶(200u/μL)1 μL 至20 μL,42℃60 min,72℃ 10 min 后,置于冰上冷却。逆转录所得的cDNA作为模板用于实时荧光定量PCR。
(四)实时荧光定量PCR(Real-time PCR)
Real-timePCR引物由华大基因公司合成(见表1)。Real-timePCR反应体系为25μL,按照试剂盒(OMEGA)的要求在冰上进行以下组分的混合:cDNA(500ng/20μl):1μL;引物(10pmol/L):0.2μL,ROX Reference Dye:0.5μL;SYBR Green qPCR SuperMix-UDG:12.5μL;DEPC-treated water:10.8μL。反应条件采用4步法:50℃2min,95℃ 2min(预变性)后进入45个循环:95℃变性15s;55℃退火30s;72℃延伸40s;延伸后60℃采集荧光;整个操作流程在ABI7000仪器上进行,每个样本重复3次,每次所检测的Ct值取其平均值。ACRV1 mRNA的表达采用△△Ct法进行相对定量分析。△△Ct =实验组目的基因△Ct值-对照组目的基因△Ct值。基因的表达差异为2-△△ct.。2-△△ct>2为表达上调,2-△△ct<0.5为表达下调,2>2-△△ct>0.5为表达无明显变化。

表1 Real-time PCR引物序列
(五)免疫印迹实验(Western Blot)
用RIPA试剂提取精子的总蛋白,超声裂解20s×5,置于冰上30min,15 000×g离心15 min。用BCA法检测蛋白浓度。10%SDS-PAGE分离蛋白。半干法转印至PVDF膜(20mA 20min),用含脱脂牛奶的TBST室温孵育1h,一抗4℃孵育过夜,PBST漂洗3次,辣根过氧化物酶标记二抗室温孵育2h,PBST漂洗3次,用免疫发光试剂盒发光,Dolphin分析软件测定灰度值,每一样本的灰度值与其相对应GAPDH灰度的比值作为该样本蛋白的相对量,用于统计分析。
(六) 数据分析
采用SPSS17.0 软件进行统计分析,试验数据以均数±标准差(x±s)表示,组间比较采用 t 检验,计数资料采用x2检验,P<0.05为差异具有统计学意义。
结 果
一、精液分析结果
对100例精液标本进行参数检测,正常人和弱精子症患者两组之间的年龄、精子浓度均无统计学差异(P>0.05);弱精子症组的PR及PR+NP精子比例较正常对照组显著降低(P<0.05)。两组精液分析的主要参数结果见表2。
二、Real-time PCR PCR 结果
应用Real-time PCR技术检测两组精子细胞内ACRV1 mRNA的表达水平。ACRV1 mRNA为目的基因,GAPDH作为内参基因作数据的标准化处理,正常组和弱精子症组的△Ct 值分别为4.60±1.21和7.14±0.93。与正常组精子比较,ACRV1 mRNA在弱精子症患者精子中的表达显著降低(P<0.05)(2-△△ct对应值分别为1和0.17),降低达5.9倍(见表3)。GAPDH作为内参在两组之间的表达无显著性差异。考虑到睾丸生精细胞和白细胞对结果的影响,我们对C-kit(生精细胞标志物)和CD45(白细胞标志物)进行扩增,未能检测到C-kit 和CD45在人精液精子中的表达,排除了圆形细胞污染的可能性。

表2 正常组和弱精子症组精液分析的主要参数结果比较(x±sxs)

表3 正常对照组和弱精子症组中ACRV1 mRRNNAA 表达量(xx±ss)
三、Western Blot lot 结果
正常对照组与弱精子症精子总蛋白的Western Blot检测结果如图1所示,两组样本在相对分子质量为29kD 处均检测到ACRV1 的蛋白条带,同时在相对分子质量为36 kD均检测到内参蛋白GAPDH的表达,两组样本GAPDH表达量基本相同,从而证明上样量基本一致,实验结果是可信的。Dolphin软件对各条带的灰度值进行对比分析后发现,与正常对照组相比,ACRV1蛋白在弱精子症组中的表达显著下降。
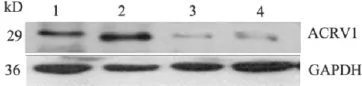
图1 Western Blot 检测AACCRRVV11蛋白在正常对照组和弱精子症患者精子中的表达
讨 论
按照第五版世界卫生组织标准,弱精子症是指精液中的PR<32%或(PR+NP)<40%的病症。精子在女性生殖道内的运行,除受女性生殖道收缩所给予的推动力外,主要依靠精子本身的主动运动,只有正常作前向运动的精子才能确保精子抵达输卵管壶腹部,并与卵子结合形成受精卵。因此,精子活力低下会严重影响生殖过程中精卵相遇及卵子穿透率,进而增加不育概率。造成精子活力低下的原因有很多,如生殖道感染、免疫因素、精索静脉曲张、精浆异常、内分泌功能异常、精子本身的结构异常、染色体异常等。引起弱精子症的机制复杂,不仅涉及精子运动结构和功能的异常,而且涉及与精子运动密切相关的能量代谢的缺陷,还涉及到信号传导通路的异常等,但其发病机制尚不清楚。对弱精子症的治疗也一直是临床医生的一大难题,各种经验性、非特异性的治疗方法被用来提高弱精子症患者的精子参数和生育能力,但效果甚微。
ACRV1位于人染色体11q24.2,通过不同剪接产生4种变异剪接亚型,其中,最长的转录本占总mRNA的53%~72%,第二长的转录本占15%~32%,第三和第四长的分别占3.4%~8.3%和8.7%~12.5%,其余的转录本占<1%。ACRV1特异性地表达于小鼠和人的睾丸组织以及人睾丸组织的圆形和长形精子细胞中[19-21],同时ACRV1还是一个睾丸特异性的分化抗原,在受精过程中可能参与了精子和卵泡的结合或者精子穿膜等过程[17]。
精子活力是指精子前向运动的能力,精子头部结构的异常以及精子尾部轴丝和纤维鞘结构的异常,都可能影响精子鞭毛的运动,导致精子运动能力下降,最终导致弱精子症的发生。本文通过Real-time PCR 技术检测ACRV1 mRNA 在正常人精子及弱精子症患者精子中的表达,结果表明ACRV1 mRNA 在弱精子症患者较正常人表达下调约5.9倍(P<0.05)。但由于生物体内mRNA 的表达与蛋白质表达丰度往往是不一致的,而真正生物学功能的执行者是蛋白质,因此我们采用Western Blot技术进一步在蛋白表达水平上对ACRV1 进行了检测,实验发现ACRV1 蛋白在弱精子症患者及正常人精子中均有表达,且在弱精子症患者中表达较正常人表达下降。实验结果说明,ACRV1基因及蛋白表达水平的异常是影响患者精子活力的一个重要因素,ACRV1在男性生殖中可能起着十分重要的作用。
总之,ACRV1在弱精子症患者精子中的表达下降,可能是导致精子活力低下的原因之一,但是尚需对ACRV1表达下调的机制、相互作用蛋白及其所处的细胞信号传导通路做进一步的深入研究。
参 考 文 献
1 Nishimune Y, Tanaka H. Infertility caused by polymorphisms or mutations in spermatogenesis-specifi c genes. J Androl 2006; 27(3): 326-334
2 Poongothai J, Gopenath TS, Manonayaki S. Genetics of human male infertility. Singapore Med J 2009; 50(4): 336-347
3 Ford WC. Glycolysis and sperm motility: does a spoonful of sugar help the fl agellum go round? Hum Rerod Update 2006; 12(3): 269-274
4 Zuccarello D, Ferlin A, Cazzadore C, et al. Mutations in dynein genes in patients affected by isolated nonsyndromic asthenozoospermia. Hum Reprod 2008; 23(8): 1957-1962
5 Martins RP, Krawetz SA. RNA in human sperm. Asian J Androl 2005; 7(2): 115-120
6 Dadoune JP, Pawlak A, Alfonsi MF, et al. Identifi cation of transcripts by macroarrays, RT-PCR and in situ hybridization in human ejaculate spermatozoa. Mol Hum Reprod 2005; 11(2): 133-140
7 Ostermeier GC, Dix DJ, Miller D, et al. Spermatozoal RNA profiles of normal fertile men. Lancet 2002; 360(9335): 772-777
8 Roy A, Lin YN, Agno JE, et al. Tektin 3 is required for progressive sperm motility in mice. Mol Reprod Dev 2009; 76(5): 453-459
9 Zuccarello D, Ferlin A, Cazzadore C, et al. Mutations in dynein genes in patients affected by isolated nonsyndromic asthenozoospermia. Hum Reprod 2008; 23 (8): 1957-1962
10 Baccetti B, Collodel G, EstenozM, et al. Gene deletions in an infertile man with sperm fi brous sheath dysp lasia. Hum Reprod 2005; 20 (10): 2790-2794
11 Ihara M, Kinoshita A, Yamada S, et al. Cortical organization by the septin cytoskeleton is essential for structural and mechanical integrity of mammalian spermatozoa. Dev Cell 2005; 8 (3): 343-352
12 Martínez-Heredia J, de Mateo S, Vidal-Taboada JM, et al. Identifi cation of proteomic differences in asthenozoospermic sperm samples. Hum Reprod 2008; 23 (4): 783-791
13 Kempisty B, Depa-Martynow M, Lianeri M, et al. Evaluation of protamines 1 and 2 transcript contents in spermatozoa from asthenozoospermic men. Folia Histochem Cytobiol 2007; 45(1): S109-113
14 Zhao C, Huo R, Wang FQ, et al. Identifi cation of several proteins involved in regulation of sperm motility by p roteomic analysis. Fertil Steril 2007; 87 (2): 436-438
15 Capková J, Elzeinová F, Novák P. Increased expression of secretory actin-binding protein on human spermatozoa is associated with poor semen quality. Hum Reprod 2007; 22(5): 1396-1404
16 Reddi PP, Flickinger CJ, Herr JC. Round spermatidspecifi c transcription of the mouse SP-10 gene is mediated by a 294-base pair proximal promoter. Biol Reprod 1999; 61(5): 1256-1266
17 Reddi PP, Shore AN, Acharya KK, et al. Transcriptional regulation of spermiogenesis: insights from the study of the gene encoding the acrosomal protein SP-10. J Reprod Immunol 2002; 53(1-2):25-36
18 Reddi PP, Urekar CJ, Abhyankar MM, et al. Role of an insulator in testis-specific gene transcription. Ann N Y Acad Sci 2007; 1120(1):95-103
19 Tang A, Yan Q, Sun L, et al. The developmental expression of ACRV1 in humans and mice. Andrologia 2012; 44(1): 16-22
20 颜秋霞, 唐爱发, 葛颂, 等. 精子顶体小泡蛋白-1 (ACRV1)在小鼠睾丸组织中的表达和定位. 生殖与避孕 2011; 31(9): 582-586
21 唐爱发, 孙亮, 颜秋霞, 等. ACRV1在人睾丸组织中的表达特征分析. 中国男科学杂志 2011; 25(7): 3-5
22 世界卫生组织主编. WHO人类精液检查与处理实验室手册. 第5版. 北京: 人民卫生出版社, 2011
(2014-12-05收稿)
**通讯作者, E-mail: tangaifa2004@163.com
doi:10.3969/j.issn.1008-0848.2015.02.003
中图分类号R 698.2e To compare the different expression of ACRV1 in ejaculated spermatozoa between normal fertile men and the patients with asthenospermia, and investigate its roles in the pathogenesis of asthenospermia. Methods Semen routine analysis were carried out using calculator assistance sperm analysis (CASA) technique. The sperms were separated and purifi ed from semen sample by Percoll discontinuous density gradients, and the relative expression of ACRV1
*基金项目资助: 广东省清远市科技计划项目资助(项目编号:2012B011204127,2014B012; 广东省医学科研基金资助(B2014426);国家自然科学基金资助(项目编号:81170613,81270740); 深圳市科技计划项目(JCYJ20140416180323426);深圳市基础研究计划杰出青年项目(JC201005260216A)
Differential expression of ACRV1 in ejaculated spermatozoa from normal fertile men and patients with asthenospermia
Yan Qiuxia1, Qi Zhengyu2, Zhao Xiaoying1, Guo Xiaoyan1, Chen Cairong1, Cai Zhiming3, Tang Aifa3**
1. Center for Reproductive Medicine, The People's Hospital of Qingyuan, The Affiliated Qingyuan People's Hospital of College of Jinan University, Guangdong 511518, China;
2.Guangdong Key Lab of Male Reproductive Medicine and Genetics, Peking University Shenzhen Hospital;
3. Department of Science and Education of Shenzhen Second People's Hospital, The First Affi liated Hospital of Shenzhen University.
Corresponding author: Tang Aifa, E-mail: tangaifa2004@163.com
AbstractObjectivewas detected by real-time PCR and western blot respectively. Resultssults The expression of ACRV1 was down-regulated by 5.9 times in asthenospermia patients as compared with that in normal fertile men (P<0.05). The expression of ACRV1 protein in the patients with asthenospermia was signifi cantly lower than that in normal fertile men, which is consistent with the results from real-time PCR. Conclusionusion The lower expression of ACRV1 in ejaculated spermatozoa of the patients with asthenospermia might be a reason for low sperm motility.
Key wordsords ACRV1; polymerase chain reaction; blotting, western; asthenospermia
