小型西瓜花药愈伤组织诱导条件
2015-07-31王玉书王欢高美玲等
王玉书 王欢 高美玲等
摘要:以2种基因型小型西瓜为试材进行花药离体培养,研究西瓜花蕾横径、不同激素配比、低温预处理、热激处理对愈伤组织诱导的影响。结果表明,西瓜花蕾横径为4.6~5.0 mm时,诱导率最高,平均诱导率达到32.67%;2个西瓜品种的花药在MS+6-BA 1.5 mg/L+NAA 1.0 mg/L上诱导率均最高,分别为45.52%、30.50%;花蕾在4 ℃条件下低温预处理48 h可以提高西瓜花药愈伤组织的诱导率,诱导率达40.67%;将接种的花药在33 ℃条件下进行 1 h 的热激处理后,愈伤组织褐化率较高,不易长出绿色致密的愈伤组织。
关键词:西瓜;花药;愈伤组织;诱导
中图分类号: Q943.1 文献标志码: A
文章编号:1002-1302(2015)03-0030-03
小型西瓜又名迷你西瓜,果型小巧外形美观,肉质鲜嫩多汁,瓜薄皮而少纤维,已成为一种高档礼品。近年来,随着人们生活水平的提高以及小型化家庭的发展,小型西瓜作为一种新兴的西瓜优良新品种,市场发展前景十分广阔,现已经成为高效农业项目之一[1]。目前,小西瓜品种主要依赖进口,种子价格很高,选育优良小型西瓜新品种是促进西瓜产业发展的重要因素[2]。采用常规育种手段选育新品种不仅耗时耗力、效率低,而且难以显著提高新品种的产量、品质及抗性等。通过花药培养获得纯系材料,是一种行之有效的育种途径,既可以大大缩短育种时间,提高育种效率,节省人力和物力,同时也可为分子标记和基因研究提供材料基础。薛光荣等研究,获得西瓜花药再生植株,但是愈伤组织的诱导率及分化率均较低,且重复性较差[3-4]。袁万良等通过改良培养基将愈伤组织诱导率从0.5%提高到94.4%[5]。魏瑛研究表明,低温预处理对西瓜花药愈伤组织诱导有促进作用[6]。缑艳霞等在西瓜花药离体培养影响因子研究中发现,适当添加激素以及4 ℃条件下低温预处理也可提高愈伤组织的诱导率[7]。有关小型西瓜花药培养至今未见相关报道。
本试验研究了花药横径大小、激素浓度组合、低温预处理、热激处理对西瓜花药培养愈伤组织诱导的影响,旨在确定西瓜花药培养的最佳条件,为西瓜花药培养体系提供依据。
1 材料与方法
1.1 材料
材料为齐齐哈尔园艺研究所西甜瓜研究室提供的2份小型西瓜种子,均为高代自交系,分别编号G1和G2。材料于 2014年 2 月初催芽播种,4 月初定植于温室,于开花期取新鲜花蕾进行试验。
1.2 方法
1.2.1 取材和消毒
于西瓜盛花期晴天08:00—09:00,选择健壮植株的花蕾,将G1花蕾按照横径不同分为4.0~4.5 mm、4.6~5.0 mm、5.1~5.5 mm 3组。首先将花蕾于70%的乙醇中表面消毒30 s,再用0.1% 的 HgCl2 浸泡 8 min,最后用无菌水冲洗 3次,每次 5 min。
1.2.2 激素处理
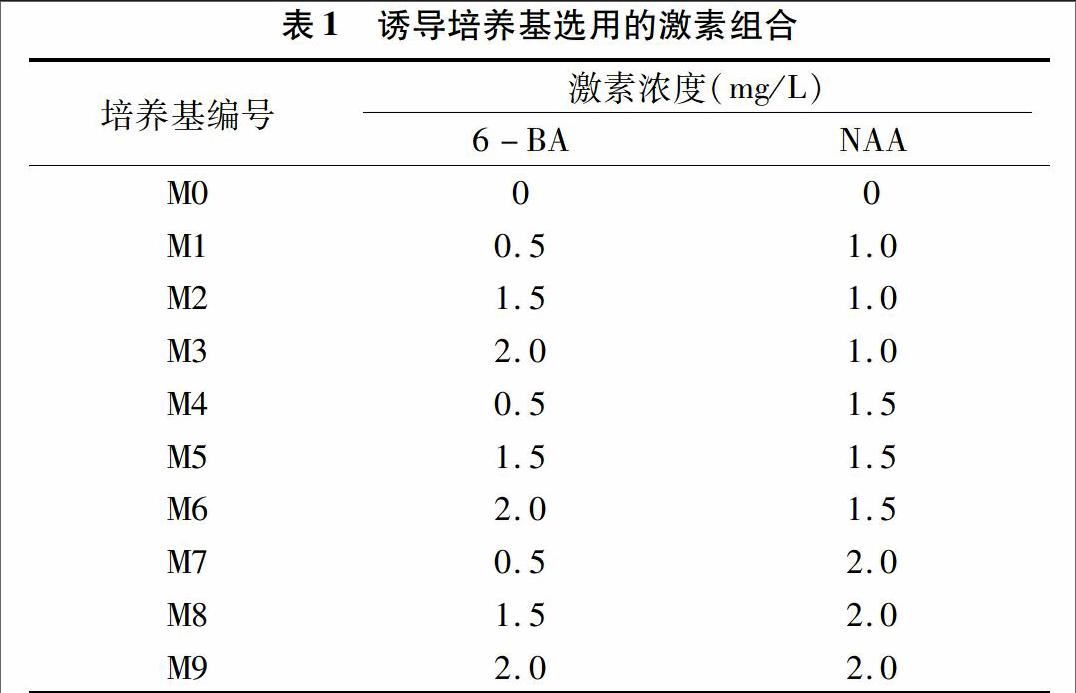
剥取G1和G2无菌花蕾的花药接种于诱导培养基上。诱导培养基以MS为基本培养基(蔗糖40 g/L+琼脂7.5 g/L),分别添加不同质量浓度的6-BA和NAA,共计9 个激素组合处理,以不添加任何激素的培养基为对照(表1)。利用愈伤组织诱导率最高的培养基进行后续试验。
1.2.3 低温处理
取供试材料G2花蕾120个,随机分为4组,再用湿纱布包裹好,分别于4 ℃下预处理0、24、48、72 h,花蕾预处理完毕后,分别剥出花药接种于“1.2.2”节筛选出的诱导培养基上进行培养,每瓶5枚花药,每个处理接种6瓶。
1.2.4 热激处理
采集G2大小一致的花蕾,剥取花药接种于筛选出的诱导培养基后,先在33 ℃条件下12 h的热激处理后再转为25 ℃培养,以始终25 ℃培养为对照,各处理接种50枚花药,共计10瓶。25 d后统计愈伤组织诱导率。
以上处理后均置于25 ℃黑暗条件下培养25 d后,统计愈伤组织诱导率。
愈伤组织诱导率=产生愈伤组织的花药数量/接种的花药数量×100%。
2 结果与分析
2.1 花蕾大小对愈伤组织诱导的影响
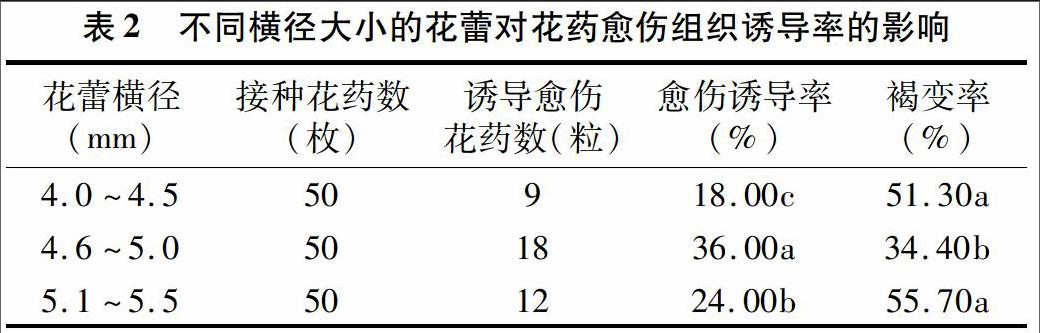
将大小不同花蕾的花药于MS培养基后,置于25 ℃环境下暗培养25 d后,愈伤组织诱导率见表2。不同大小的花蕾其花药愈伤组织的诱导率有显著差异,横径在4.6~5.0 mm的花蕾诱导率最高,达36.00%,显著高于其他组;其次是横径在5.1~5.5 mm的,为24.00%,最低的是横径在4.0~4.5 mm 的,仅为18.00%。横径为4.6~5.0 mm时,外植体的褐变率显著低于其他2组。本试验中西瓜花蕾直径处于4.6~5.0 mm时,花药愈伤组织的诱导效果最好。
2.2 不同激素配比对花药愈伤组织诱导的影响
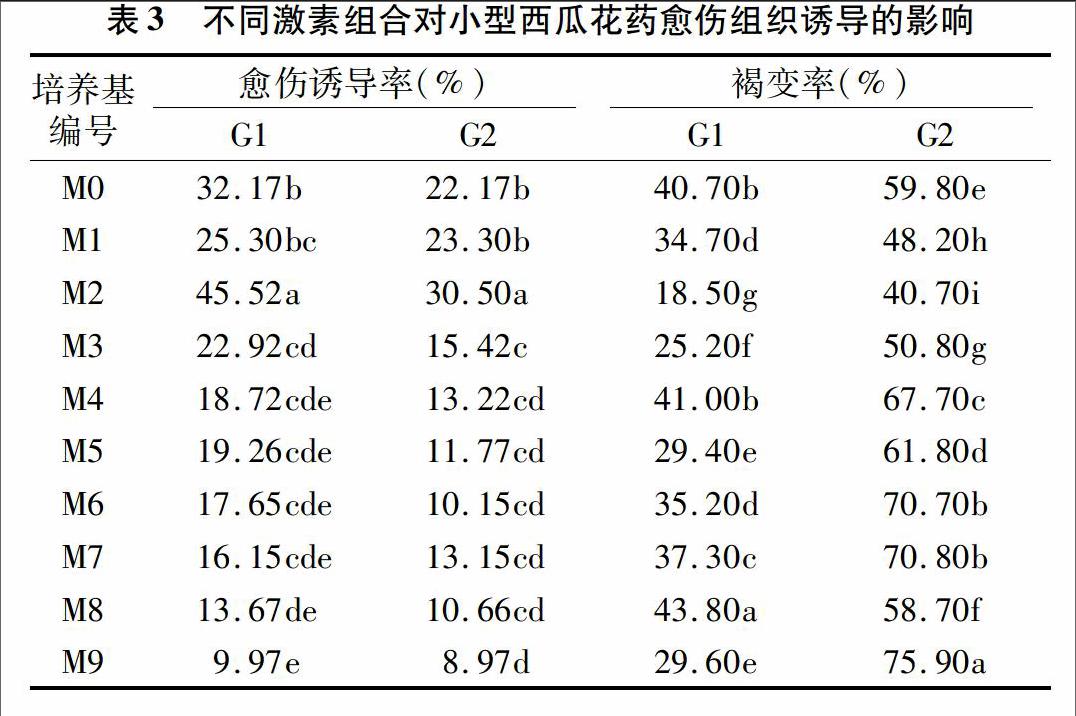
2种基因型材料在9种激素组合的培养基中都能诱导出愈伤组织(表3),且愈伤组织诱导率存在一定的差异,2种基因型材料都在M2 (MS+6-BA 1.5 mg/L+NAA 1.0 mg/L)培养基中愈伤组织诱导率较高,分别达到了4552%和3050%;并且M2号培养基诱导的愈伤质量最好,外植体褐化率也较低。在试验中还观察到,不同花药形成愈伤组织形态特征不同,一种愈伤组织质地疏松,呈绿色或者白色;另一种愈伤组织质地紧密、色嫩绿,有光泽,愈伤组织多由花药顶端及中部由里及外生长。当NAA激素超过1.0 mg/L时,生成的愈伤组织比较疏松白化,培养时外植体容易褐化死亡,当NAA浓度为1.0 mg/L、6-BA浓度为1.5 mg/L时形成的愈伤组织质地致密,色泽亮绿,质量较好。
2.3 低温处理时间对花药愈伤组织诱导的影响
利用M2培养基对G2花药进行培养,研究不同低温处理时间对花药诱导率的影响(图1)。当低温处理时间为48 h时,花药愈伤组织的诱导率最高,达40.67%,处理时间为 24 h 时,诱导率达35.00%,当预处理时间延长至72 h时,诱导率仅有32.33%,但均高于对照21.00%的诱导率。
2.4 热激处理对西瓜花药愈伤组织诱导的影响
将G2花药接种在M2培养基上,将部分培养基于33 ℃下进行12 h的热激处理,之后置于25 ℃的环境下培养,花药愈伤组织诱导率结果见表4。进行热激处理的花药愈伤组织诱导率显著低于未经处理的对照,花药褐化率也明显高于未进行热激处理的。
3 讨论
花粉发育阶段对诱导雄性单性生殖至关重要,是能否诱导成功及诱导频率高低的内在因素之一,关系到是否能产生胚性愈伤组织,进而也关系到培养效果。在大多数作物花药培养中,花粉发育时期选用的都是单核靠边期[8]。但在试验中对每个花蕾进行镜检过于麻烦,如果找到适宜诱导愈伤组织形成的花蕾大小,可让培养过程更加简单。本试验中将花蕾按照横径不同分为4.0~4.5 mm、4.6~5.0 mm、5.1~5.5 mm 3组,分别进行诱导,诱导结果横径在4.6~5.0 mm的花蕾诱导率最高,达36.00%,显著高于其他组,在后期试验中可以根据花蕾横径进行挑选试材。
不同培养基对植物花药的培养效果不同。王玉英等在甜椒花药培养中对N6、MS、NTH 3种培养基的培养效果进行了对比,结果发现MS和NTH培养基既能很好地产生愈伤组织,也能形成胚状体[9]。陈肖师将MS、H、B5、Nitsch和NTH 5种培养基的诱导率进行了比较,发现MS培养基的效果最好[10]。本试验中以MS为基本培养基,在试验中发现2个基因型材料在9种激素组合的培养基上都能诱导出愈伤组织,但是不同激素组合诱导频率存在一定的差异。G1基因型花药愈伤组织诱导率总体要高于G2基因型,但是M2培养基(MS+6-BA 1.5 mg/L+NAA 1.0 mg/L)上2个基因型的愈伤组织诱导频率均最高而且质量最好,外植体褐化率也较低。后期试验中就可以在MS基本培养基中添加上述激素浓度进行诱导。
诱导花药形成愈伤组织的质量受低温预处理的时间长短影响[11-12]。Sunderland认为,低温作用机理不在于改变纺锤体的轴向,而在于使花粉保持生活力,使其不在数天内死亡[13]。徐武等推测低温处理作用是改变了花药中内源激素的含量,阻断了花粉正常发育途径,使其由配子体发育途径向孢子体发育途径转变[14]。黄斌也认为,低温致使花药内源激素发生变化,进而愈伤组织形成;低温处理使花药的壁细胞及绒毡层逐渐解体,导致小孢子孤立化,使绝大部分小孢子保持其生活力[15]。基于以上研究,本试验对花药进行了不同时间的低温预处理,结果表明,低温处理 48 h时,花药愈伤组织的诱导率最高,达40.67%,其次是处理时间为24 h时,诱导率达3000%,最低的是处理72 h,仅有32.33%,但均高于对照处理21.00%的诱导率。表明适宜的低温预处理可以提高花药愈伤组织的诱导率。
组织褐变的主要原因是由多酚氧化酶催化多酚类物质氧化生成褐色物质所致,褐变与多酚氧化酶的活性及酚类物质的含量密切相关[16]。夏铭等采用45 ℃处理红豆杉外植体,发现热激处理对克服褐变是有效的[17]。Martin等研究认为热激处理抑制了多酚氧化酶的合成[18]。本试验结果与以上研究结果相反,前期热激处理的花药愈伤组织诱导率明显偏低,而且褐化率高于未进行热激处理的花药。本结果与 Fukumoto 等在冰山莴苣组织培养中的研究结果[19]一致。
参考文献:
[1]徐满君,蒋有条. 小西瓜的生育特性及其栽培技术[J]. 浙江农业科学,2000(6):294-296.
[2]李步勋,陶抵辉,阮万辉. 西瓜离体组织细胞染色体加倍技术的研究和应用[J]. 陕西农业科学,1999(3):22-24.
[3]薛光荣,余文炎,费开伟,等. 西瓜花药离体培养获得花粉植株[J]. 植物生理学通讯,1983(4):40-42.
[4]薛光荣,余文炎,杨振英,等. 西瓜花粉植株的诱导及其后代初步观察[J]. 遗传,1988,10(2):5-8,49.
[5]袁万良,付润民,雷保林,等. 西瓜花培试验初报[J]. 陕西农业科学,1995(1):29-30.
[6]魏 瑛. 低温预处理对西瓜花药诱导愈伤组织的影响[J]. 甘肃农业科技,1999(9):3.
[7]缑艳霞,张明方. 西瓜花药离体培养影响因子研究[J]. 北方园艺,2013(10):117-120.
[8]李 娟,张 丽,李焕秀,等. 西瓜花药培养技术研究[J]. 中国瓜菜,2008,21(4):8-10.
[9]王玉英,郭仲琛,李春玲,等. 甜椒花药培养的初步研究[J]. 园艺学报,1980(1):33-38,65.
[10]陈肖师. 甜椒花药培养及‘塞花一号的育成[J]. 中国蔬菜,1988(3):5-7.
[11]段 青,吴丽芳,李金泽,等. 洋桔梗花药培养的影响因素[J]. 江苏农业科学,2013,41(9):28-31.
[12]陈永胜,邵志敏,李国瑞,等. 蓖麻花药愈伤组织诱导及防褐化研究[J],江苏农业科学,2014,42(3):39-40.
[13]Sunderland N. Anther culture as a means of haploid production[M]//Kasha K J. Haploids in higher plant:advances and potential. Guelph,Canada:University of Guelph,1974:91-122.
[14]徐 武,李 鸣,张 敬,等. 低温预处理过程中大麦花药内源激素的变化[J]. 遗传学报,1997,24(2):67-71.
[15]黄 斌. 大麦花药培养中低温预处理对花粉愈伤组织形成的影响[J]. 植物学报,1985,27(4):439-443.
[16]崔堂兵,郭 勇,张长远. 植物组织培养中褐变现象的产生机理及克服方法[J]. 广东农业科学,2001(3):16-18.
[17]夏 铭,吴绛云,张丽梅. 红豆杉组织培养中褐变问题的研究[J]. 生物技术,1996,6(3):18-20.
[18]Martin-Diana A B,Rico D,Barry-Ryan C,et al. Effect of heat shock on browning-related enzymes in minimally processed Iceberg lettuce and crude extracts[J]. Bioscience Biotechnology and Biochemistry,2005,69(9):1677-1685.
[19]Fukumoto L R. Toivonen P M A,Delaquis P J. Effect of wash water temperature and chlorination on phenolic metabolism and browning of stored iceberg lettuce photosynthetic and vascular tissues[J]. Journal of Agricultural and Food Chemistry,2002,50(16):4503-4511.
