芦苇幼苗对NaCl胁迫和镉胁迫的生理响应
2015-07-31王静张侠陈世华等
王静 张侠 陈世华等

摘要:为探讨芦苇(Phragmites communis)对逆境环境的适应机制。采用盆栽试验法,对芦苇幼苗进行NaCl和Cd2+胁迫处理,测定其丙二醛(MDA)含量、抗氧化酶活性以及可溶性糖含量等生理指标。结果表明:300 mmol/L NaCl处理时,芦苇幼苗的MDA含量随处理时间的延长虽有所下降,但与对照相比,都呈现增加趋势,抗坏血酸过氧化物酶(APX)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的酶活性都随处理时间的延长逐渐升高,过氧化物酶(POD)先升高后下降,但仍高于对照组。可溶性糖含量上升;而500 μmol/L Cd2+处理下,MDA含量与对照相比同样呈现增加趋势,但APX、POD、CAT活性呈先升高后降低趋势,SOD活性逐渐下降,可溶性糖含量缓慢增加。2种逆境胁迫下芦苇生理特性的差异,预示着在芦苇体内可能存在不同的抗逆机制。
关键词:芦苇;幼苗;胁迫;抗氧化酶活性;抗逆机制
中图分类号: Q945.78 文献标志码: A
文章编号:1002-1302(2015)03-0327-03
自然界中有很多的环境因子会影响到植物正常的生长发育,如干旱、盐渍、高低温、重金属等,其中盐渍和重金属是最为普遍的2种胁迫因子。盐渍是限制植物生长的主要环境因素之一[1],盐胁迫不可避免地诱导了活性氧(ROS)的产生,例如超氧阴离子( O-2[KG-*2]· )、过氧化氢(H2O2)和羟自由基(OH),而产生的活性氧又可以通过细胞内的酶促和非酶促系统被清除[2]。酶促抗氧化系统为植物体提供了高效而专一的活性氧清除体系,抗氧化酶主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、谷胱甘肽过氧化物酶(GR)、抗坏血酸过氧化物酶(APX)等。在盐胁迫下,植物体内SOD等酶的活性与植物的抗氧化胁迫能力呈正相关,而且与非盐生植物相比,盐生植物SOD、CAT、POD活性更高,能更有效地清除活性氧,阻抑膜脂过氧化[3]。例如,盐处理使耐盐大米栽培种幼苗根中CAT活性增强,而盐敏感大米栽培种幼苗根中CAT活性下降[4]。同样,NaCl处理使耐盐谷子幼苗中总SOD活性随盐浓度升高而逐渐升高,而盐敏感幼苗中总SOD活性逐渐下降[5]。
镉(Cd)是环境中一种非常常见的有毒重金属元素,它虽然不是植物生长发育的必需营养元素,但却极易被植物吸收、积累,从而影响植物的生长发育。研究发现,Cd2+影响烟草叶绿素含量及抗氧化酶系统,造成CAT活性逐渐减小,SOD活性先升后降,POD活性则逐渐增加[6]。随着Cd2+浓度升高和毒害时间延长,玉米幼苗SOD、CAT活性降低,POD活性增强,蛋白质含量下降,膜脂过氧化作用加剧,质膜透性增大,幼苗的生长受到抑制[7]。
芦苇(Phragmites communis)是禾本科芦苇属多年生高大直立草本植物,是世界广布的重要湿地物种,多生长在灌溉沟渠旁、河堤沼泽地等低湿地或浅水中,具有广泛的适应性及形态变异,并有极高的生态学和社会经济学价值。芦苇适应能力较强、繁殖迅速,抗逆性强,而且芦苇对重金属有着出色的抗性和富集能力[8],是研究植物抗逆机理的理想材料[2]。但目前盐渍和重金属镉2种不同胁迫下芦苇生理生化指标变化情况未见详细报道。因此本试验以芦苇为试验材料,对盐处理和重金属镉处理下芦苇幼苗抗氧化系统的变化进行研究,探讨2种胁迫对丙二醛含量、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)以及可溶性糖含量的影响,以期为芦苇的逆境胁迫生理机制研究提供理论依据,同时也为后期研究其抗逆的分子机制提供参考。
1 材料与方法
1.1 植物材料
芦苇种子于2012年10月采于山东烟台海滨,次年6月播种,将芦苇种子均匀地撒在装有培养基的大盆中,培养基成分为营养土 ∶蛭石 ∶珍珠岩=1 ∶1 ∶1,于温室中培养,温度为25 ℃,光照时间10~12 h/d。待到幼苗长至4~5张真叶时,选择生活力强且大小均一的植株移栽到装有培养基的小盆中,每盆5株,继续培养,待株高约20 cm左右,进行胁迫处理。
1.2 试验设计
NaCl胁迫处理采用300 mmol/L NaCl溶液浇灌,镉胁迫处理采用500 μmol/L CdCl2溶液浇灌;处理时间分别为0、12、24、48、72、96 h,每个处理重复3次。
1.3 测定方法
丙二醛含量用硫代巴比妥酸法[9]测定,APX活性采用过氧化氢紫外分光光度法[10]测定,CAT活性用高锰酸钾滴定法[11]测定,POD活性参照李合生的愈创木酚法[12]测定,SOD活性用氮蓝四唑光还原法[11]测定,可溶性糖含量用蒽酮比色法测定[11] 。
1.4 数据分析
数据采用Excel 2003进行处理,利用t-test进行统计分析,P<0.05时差异显著。
2 结果与分析
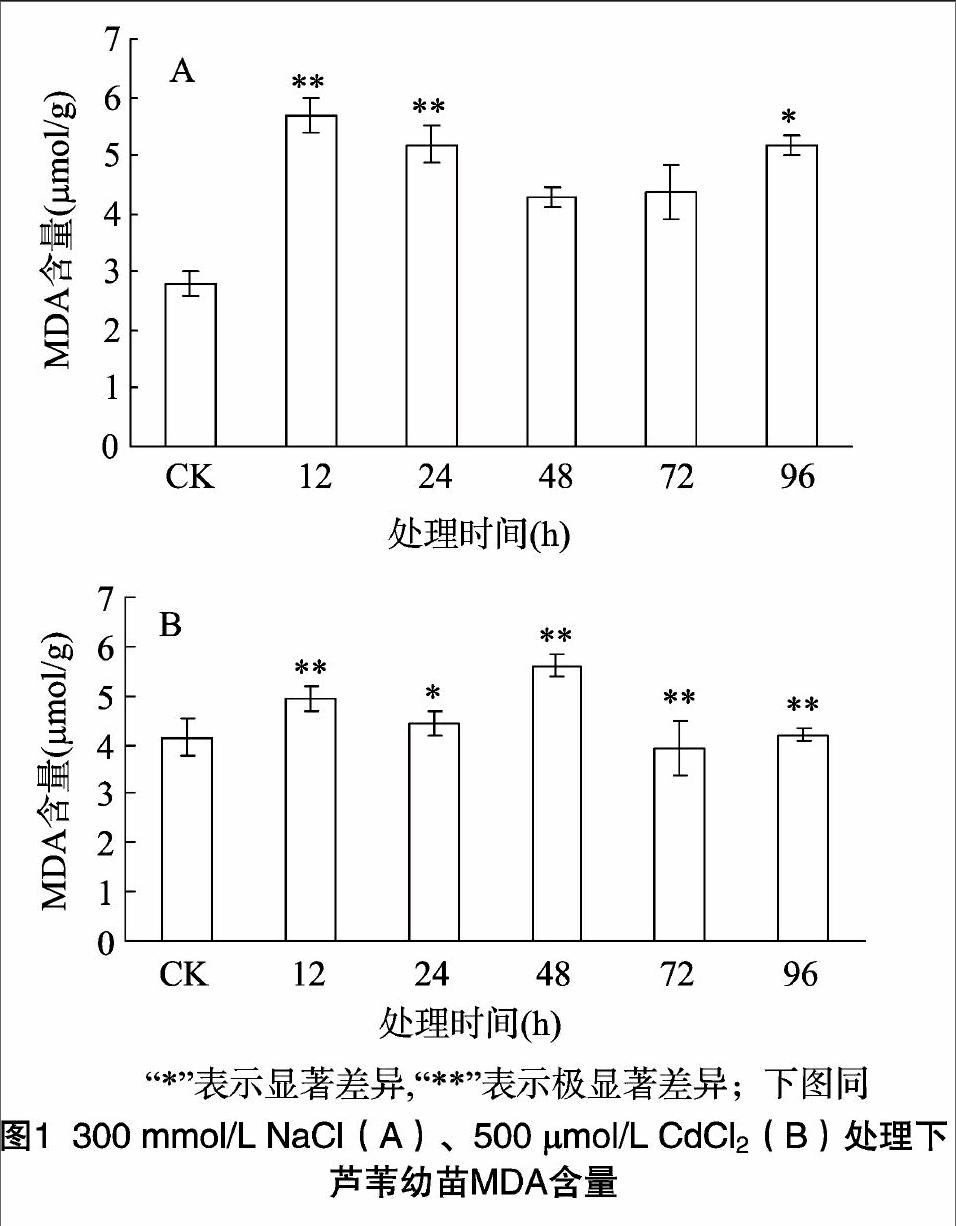
2.1 NaCl和镉胁迫对芦苇幼苗丙二醛(MDA)含量的影响
在逆境胁迫下,植物体内不可避免会产生过量的活性氧,活性氧的积累会诱导膜质过氧化,丙二醛是膜质过氧化最重要的产物之一,因此可以通过测定丙二醛含量的多少来了解膜质过氧化的程度,从而可以间接测定膜系统受损伤的程度以及植物的抗逆性[13]。由图1可知,在300 mmol/L NaCl胁迫处理下,芦苇幼苗MDA含量先升高,达到最大值后又开始缓慢下降,但仍比对照有所增加,在12 h时达到最大值,与对照组相比增加了102%,差异极显著。在500 μmol/L CdCl2处理下,MDA含量变化基本呈现上升趋势,在48 h时达到最大值,与对照组相比增加了48%。与NaCl处理相比,Cd2+胁迫下叶片MDA含量增加的幅度要小得多。endprint
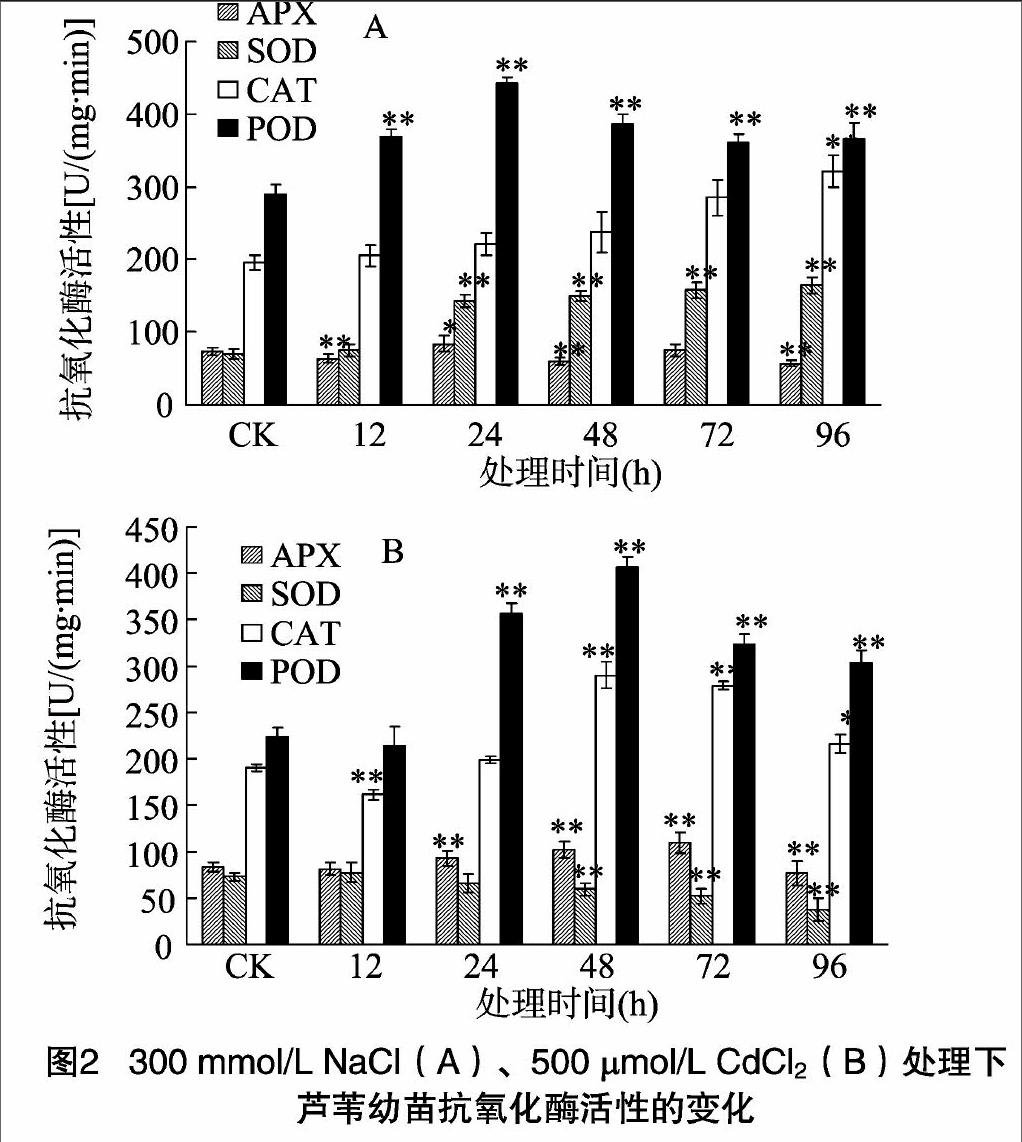
2.2 NaCl和镉胁迫对芦苇幼苗抗氧化酶活性的影响
植物体内酶促保护系统中的SOD、POD、CAT、APX对清除植物体内产生的活性氧具有至关重要的作用。SOD可以将超氧化物歧化为基态氧和H2O2,而H2O2的清除又可以在POD、CAT、APX等的协同作用下共同完成。这些复杂的过氧化和抗氧化系统共同控制着细胞内的氧化还原平衡,从而保护细胞,维持植物正常的生长代谢。由图2可以看出,在 300 mmol/L NaCl胁迫处理下,芦苇幼苗的APX、SOD、CAT酶活性总体上随处理时间延长逐渐升高,POD则是先升高后又有所下降,但仍高于对照组。在处理96 h后,SOD活性比对照组增加了134%,POD活性比对照组增加了266%。在500 μmol/L CdCl2处理下,APX、CAT、POD活性随处理时间延长基本呈现出先升高再下降的趋势。APX活性在72 h达到最大值,与对照相比增加了31%;CAT、POD活性都在48 h达到最大值,与对照相比分别增加了53%、82%。SOD的活性却逐渐下降。
2.3 NaCl和镉胁迫对芦苇幼苗可溶性糖含量的影响
在逆境胁迫下,植物细胞会主动积累一些渗透调节物质,从而提高细胞内溶质的浓度,降低水势。可溶性糖作为多种植物的主要渗透调节剂,也是合成其他有机溶质的碳架和能量来源,对细胞膜和原生质胶体起稳定作用[14]。由图3可以看出,在300 mmol/L NaCl胁迫处理下,芦苇幼苗可溶性糖含量随处理时间延长而增加,在处理96 h后,可溶性糖含量比对照组增加了191%。而在500 μmol/L Cd2+胁迫处理下,可溶性糖含量的变化也呈现上升趋势,24 h达到最大值,与对照组相比增加了169%,差异极显著;之后可溶性糖含量略有下降,但仍比对照组有所增加。推测可溶性糖是芦苇在逆境胁迫下重要的渗透调节物质之一,胁迫处理下其含量增高,有助于植物细胞维持其渗透势。
3 结论与讨论
在逆境环境下,植物体内各项生理生化指标及其营养状况都会受到不同程度的损伤,这不可避免地会影响到植物正常的生长发育。近年来,不同植物在盐渍和重金属处理下生理特性变化也引起了人们越来越多的关注。研究发现,Cd2+胁迫使小麦体内活性氧自由基清除系统的功能降低,造成细胞内H2O2积累,APX、GR活性下降;MDA含量升高,—SH含量下降,电解质泄漏加剧,显示发生膜脂过氧化,同时组织自动氧化速率显著提高,表明机体总的防御活性氧自由基的能力降低,推测小麦在Cd2+伤害过程中,活性氧自由基代谢失衡造成了膜脂过氧化[15]。
但对于芦苇这样的盐生植物而言,却有其独特的抗逆机制,这种抗逆能力是通过其自身的渗透调节系统和自由基清除系统等实现的。当植物体内活性氧浓度超过一定的值时,会引起膜质分离,从而导致膜的完整性遭到破坏。MDA是膜质过氧化最重要的产物,其含量是反映膜质过氧化作用强弱的一个重要指标。在本试验中,芦苇幼苗在NaCl胁迫和Cd2+胁迫下,其体内MDA的含量与对照相比都呈增加的趋势,说明了芦苇的膜系统在盐胁迫和镉胁迫下都受到了一定程度地损伤。
研究表明,酶促途径是逆境胁迫下植物体内清除活性氧的一个重要途径,酶促保护系统中的活性氧清除酶类在其中发挥着非常重要的作用。酵母线粒体MnSOD在水稻叶绿体中的过量表达提高了转基因植株对盐胁迫的耐受性,而且盐胁迫下转基因植株中SOD和APX的活性都较对照植株提高了1.5~2.0倍,CAT活性降低的程度也小于对照株[16]。在向日葵(Helianthus annuus)叶片中,Cd2+可以促进脂质过氧化,降低SOD、CAT、APX、GR等酶的活性。从拟南芥中获得的耐盐突变株幼苗SOD、APX的活性分别比野生型提高13、3倍[17]。同样,盐胁迫使盐敏感西红柿栽培种CAT活性降低,而耐盐西红柿栽培种CAT活性升高[4]。本试验结果表明,在NaCl胁迫和Cd2+胁迫下,芦苇幼苗抗氧化酶类活性的变化趋势不同。在盐胁迫下,随着处理时间延长,抗氧化酶类活性逐渐升高,说明在该逆境下,芦苇体内的SOD、POD、APX、CAT共同作用来清除体内产生的活性氧,从而可以保护细胞,维持植物正常的生长和代谢。在重金属镉胁迫下,随着处理时间的延长,APX、POD、CAT活性基本呈现出先升高再下降的趋势,比较符合植物对逆境胁迫反应的典型规律:植物体刚遭受逆境胁迫时会采取相应措施,提高自身抗性以适应不良的环境;随着胁迫时间的增长,超过了植物的耐受程度后防御措施就会慢慢减弱[18]。另外,SOD活性在逐渐下降,说明Cd2+胁迫对芦苇幼苗SOD活性的毒害作用较大,SOD活性受到了抑制。
此外,作为植物主要的渗透调节剂,可溶性糖在维持植物蛋白质稳定及参与胞内信号调节方面起着重要的作用[19],因此其含量是指示植物遭受环境胁迫程度的重要指标之一。本试验中,在NaCl胁迫和Cd2+胁迫下,芦苇体内可溶性糖的含量都呈增加的趋势,有助于植物维持其渗透势,保护自身少受逆境伤害。
综上所述,芦苇在遭受NaCl胁迫和Cd2+胁迫时,体内MDA的含量与对照相比都有所增加,说明这2种胁迫都对芦苇造成了伤害。胁迫处理使芦苇体内活性氧增加,抗氧化酶类在NaCl和Cd2+胁迫下的生理变化有所差异。此外,2种胁迫下芦苇体内可溶性糖含量也呈上升趋势,通过渗透调节来稳定由逆境胁迫造成的膜损伤所带来的内环境紊乱,保护胞内重要的酶类。因此,研究芦苇体内与抗逆相关的基因,可以有助于进一步了解盐生植物的抗逆机理。
参考文献:
[1]Allakhverdiev S I,Sakamoto A,Nishiyama Y,et al. Ionic and osmotic effects of NaCl-induced inactivation of photosystemsⅠandⅡin Synechococcus sp.[J]. Plant Physiol,2000,123(3)47-1056.endprint
[2]侯 晨,王晓敏,马元媛,等. 盐胁迫对芦苇愈伤组织抗氧化酶活性及脯氨酸含量的影响[J]. 安徽农业科学,2008,36(22):9374-9376,9379.
[3]杨少辉,季 静,王 罡. 盐胁迫对植物的影响及植物的抗盐机理[J]. 世界科技研究与发展,2006,28(4):70-76.
[4] Scandalios J G. Oxygen stress and superoxide dismutase [J]. Plant Physiol,1993,101:7-12.
[5] Sreenivasulu,Grimm B,Wobus U.Differential response of antioxidant compounds to salinity stress in salt-tolerant and salt-sensitive seedings of faxtail millet[J]. Phsio1 Planta,2000,109:435-442.
[6]严重玲,付舜珍,方重华,等. Hg、Cd及其共同作用对烟草叶绿素含量及抗氧化酶系统的影响[J]. 植物生态学报,1997,21(5):77-82.
[7]宇克莉,邹 婧,邹金华. 镉胁迫对玉米幼苗抗氧化酶系统及矿质元素吸收的影响[J]. 农业环境科学学报,2010,29(6):1050-1056.
[8]黄永杰,刘登义,王友保,等. 八种水生植物对重金属富集能力的比较研究[J]. 生态学杂志,2006,25(5):541-545.
[9]刘凤荣,陈火英,刘 杨,等. 盐胁迫下不同基因型番茄可溶性物质含量的变化[J]. 植物生理与分子生物学学报,2004,30(1):99-104.
[10]薛应龙,上海植物生理学会. 植物生理学实验手册[M]. 上海:上海科学技术出版社,1985:314.
[11]邹 琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2000.
[12]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:164-169.
[13]刘育梅,胡宏友,李学梅,等. 蛋黄果在NaCl胁迫下的生理生态响应[J]. 厦门大学学报:自然科学版,2011,50(5):951-954.
[14]徐柱文. NaCl胁迫下五种一年生苜蓿的耐盐性比较研究[D]. 兰州:甘肃农业大学,2006.
[15]郑爱珍. 镉胁迫对芥蓝根系质膜过氧化及ATPase活性的影响[J]. 生态学报,2012,32(2):483-488.
[16]Tanaka Y,Hibino T,Hayashi Y,et al. Salt tolerance of transgenic rice overexpressing yeast mitochondrial Mn-SOD in chloroplasts[J]. Plant Science,1999,148(2):131-138.
[17]Tsugane K,Kobayashi K,Niwa Y,et al. A recessive Arabidopsis mutant that grows photoautotrophically under salt stress shows enhanced active Oxygen detoxification[J]. Plant Cell,1999,11(7):1195-1206.
[18]刘晓庆,张大勇,徐照龙,等. Cd胁迫对大豆幼苗异黄酮合成关键酶基因表达的影响[J]. 江苏农业科学,2013,29(5):974-978.
[19]侯福林. 植物生理学实验教程[M]. 北京:科学出版社,2004:91-92.endprint
