水产动物对氨氮胁迫响应的转录组分析研究进展
2015-07-31章琼蒋高中李冰
章琼 蒋高中 李冰
摘要:氨氮胁迫是影响水产养殖和生态环境的重要非生物胁迫之一;而转录组学是一个新兴的研究细胞表型和功能的重要手段,在研究基因结构、表达和功能上开拓了一个新型的研究方向。简述了水产养殖中氨氮的危害以及氨氮胁迫而引起的生理和生化反应,同时介绍了常见的转录组学平台技术及其在一些胁迫反应代谢调控机制及分子机制研究中的应用,认为水产动物氨氮胁迫的转录组分析将为水产动物的毒理学效应提供重要的理论依据和线索,也将在水产动物分子育种中发挥重要作用。
关键词:水产动物;氨氮胁迫;代谢调控机制;转录组;转录组测序
中图分类号: S917.4 文献标志码: A
文章编号:1002-1302(2015)03-0227-04
氨氮是水产养殖中常见的胁迫因子,以2种形式存在于水体中,即非离子氨(NH3)和离子铵(NH+4),离子铵的存在对水产动物是无毒的,对水产动物产生危害的是非离子氨,主要影响它们的游泳行为、生长性能、呼吸及代谢的变化、渗透调节、免疫力等。
随着转录组学、蛋白质组学和代谢组学等的出现,标志着生命科学的研究已经跨入后基因组时代。转录组(transcriptome)概念最先是由Velcalescu和Kinzler等在1997年提出的,是指某一特定生物体在特定状态下所有基因转录产物的总和,主要包括mRNA和非编码RNA,其中 mRNA 较为引人关注,被研究得较多,因此狭义上的转录组一般指的是所有mRNA的总和。
目前,人们已经对机体受氨氮胁迫时的生理和生化反应做了大量深入的研究,然而对引起这些反应的代谢调控机制、分子机制的相关研究报道甚少。本文主要通过综述氨氮胁迫的危害及生理生化反应,以及转录组平台技术的应用,以期为氨氮胁迫的代谢调控机制提供线索,并对其分子机制的研究提出展望。
1 水产养殖中氨氮的来源及其危害
1.1 氮素的循环及水体中氨氮的来源
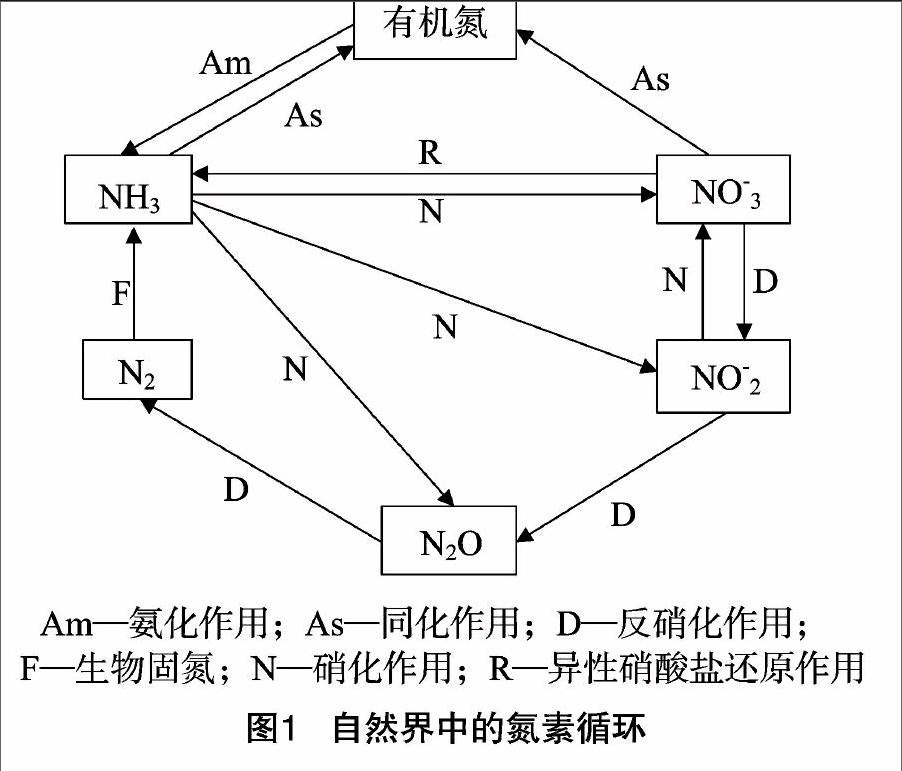
自然界中的各种元素都是守恒的,都可以循环利用,在水体中也是如此,而影响水产养殖业发展最大的因素是氮元素的循环。天然水体中溶解的有机氮主要来自动物分泌物、动植物尸体以及人类的排放等,这些有机氮首先在微生物的作用下分解为氨(NH3),如果水体中溶氧充足,总氨会迅速在亚硝化细菌和硝化细菌的联合作用下氧化为NO-3;而在溶氧偏低的水体中,由于反硝化细菌的大量繁殖,不仅使总氨无法进一步氧化,而且使原有的亚硝态氮和硝态氮被还原为总氨,总氨也被进一步还原为氮,从而溢出水面。氮元素在自然界的循环过程如图1[1]所示。
在养殖水体中,氨氮的来源主要有以下几个方面:(1)动物粪便残饵等有机物经过异养细菌的氨化作用产生;(2)养殖生物自身的转氨和脱氨作用产生;(3)人类活动如农药、肥料的过度利用,工业废水等含氮化学试剂的排放;其中前2个方面是氨氮的主要来源。
1.2 水产养殖中的氨氮危害
氨氮是养殖水体中最重要的污染物之一,非离子氨进入水产动物体内后,可以直接影响鱼类的鳃组织,对机体酶水解反应以及细胞膜稳定性产生明显的影响,表现出不摄食、呼吸困难、抵抗力减弱、惊厥、昏迷等现象,严重时可导致水产动物大批死亡,造成严重的经济损失[2-3]。
2 水产动物对氨氮胁迫的生理和生化响应研究进展
2.1 水产动物受氨氮胁迫的症状
Wicks等研究表明,外界环境中高浓度氨氮引起的血氨积累会影响鱼的游泳功能,使其表现出急躁不安、游动迟缓等症状,并在对褐鳟(Salmo trutta)、虹鳟(Salmo gairdneri)、大马哈鱼(Oncorhynchus keta)的研究中发现,血氨浓度与最大游泳速度呈负线性关系[4]。在氨氮(0.05~2.50 mg/L)胁迫24 h内,凡纳滨对虾血细胞数量明显减少,抗菌溶菌活力显著变弱,血清酚氧化酶活力明显升高[5]。在高浓度氨氮作用下,鱼鳃的结构会发生改变,表现为鳃小片加厚、上皮细胞和黏液细胞增生,动脉血管内2层上皮细胞间的淋巴腺增多;此外鳃结构的改变还会引起生理功能的改变,影响鱼类气体的交换效率[6]。养殖水体中氨氮含量过高除了会影响鳃组织外,还会导致肝组织变松软、易碎、充血阻塞等,有的甚至出现空泡状或者坏死腔[7-8]。王金叶等研究发现,在氨氮或亚硝酸盐胁迫作用下,会导致鲤鱼红细胞膜上的过氧化脂质含量增加,从而使得红细胞膜通透性、渗透脆性增高、流动性降低、变形性变差[9];此外氨氮还会对红细胞的胞核造成伤害,如泥鳅在氨氮含量超标水质中的红细胞微核率较高[10]。即便是低浓度的氨氮,长期接触也会损伤鳃组织,会出现鳃小片弯曲、粘连或融合的现象[11]。
2.2 水产动物氨氮胁迫中毒机理
水体中的氨氮达到一定浓度后,非离子氨很容易通过细胞膜进入水产动物体内,使得血液中的氨氮浓度升高,血液pH值随之上调,从而导致水产动物体内多种酶的活性受到抑制,降低了血液的携氧能力,超出水产动物的自我调节能力即可导致缺氧,表现中毒症状。氨氮主要是侵袭黏膜,特别是鳃表皮黏膜和肠黏膜,其次是神经系统,同时可使水产动物的肝肾系统遭到破坏,引起体表及内脏充血,严重时可导致昏迷甚至死亡。比较认可的关于氨氮对水产动物危害机理的解释是认为高浓度的氨氮会取代生物体内的钾离子,引起N-甲基-D-天冬氨酸(NMDA)受体结合活性的降低,导致中枢神经系统中流入过量的钙离子并引起细胞死亡[12],具体的毒理机制还有待研究。
2.3 水产动物氨氮胁迫下对自身免疫功能的影响
在氨氮胁迫的情况下,鱼类机体的代谢被打乱,体内的抗氧化防御性功能酶被激活,从而使机体的免疫功能受到影响。迄今为止,已有较多关于氨氮对水产动物毒理与免疫功能影响的研究,研究得较为透彻的主要是虾蟹类的氨氮胁迫。研究表明,虾蟹类在氨氮胁迫作用下,其体内与免疫相关酶如酚氧化酶(PO)、血清酸性磷酸酶(ACP)、溶菌酶(LSZ)、血清超氧化物歧化酶(SOD)等活性明显变化,同时对病原体的易感性提高[13-17];并且随着胁迫时间的延长,鱼类体质明显下降,死亡率明显增加[18],虾蟹体内抗氧化酶系统和细胞膜的稳定性也会受到严重影响,进而破坏其渗透平衡[19]。在斑马鱼的氨氮试验中[20],ATP酶变化的总趋势是受氨氮抑制的,并且随氨氮浓度的增加,ATP酶受抑制的程度也增加,可能是由于随着氨氮质量浓度增加,使鳃部损伤,打破体内离子平衡而加大补偿性渗透调节影响所致。endprint
3 转录组分析研究进展
相对于基因组而言,转录组更具有时间性和空间性,转录组反映的是特定条件下活跃表达的基因。转录组分析的主要目标是:对所有的转录产物进行分类,检测新的转录本,包括未知转录本和稀有转录本;确定基因的转录结构,如起始位点、转录后修饰,以及非编码区功能研究等;量化各转录本在发育过程中以及在不同生理或病理条件下表达水平的变化;转录本结构变异的研究以及开发新的单核苷酸多态性(single nucleotide polymorphisms,SNPs)和简单重复序列(simple sequence repeat,SSR)等[21-22]。
3.1 转录组研究的基本方法
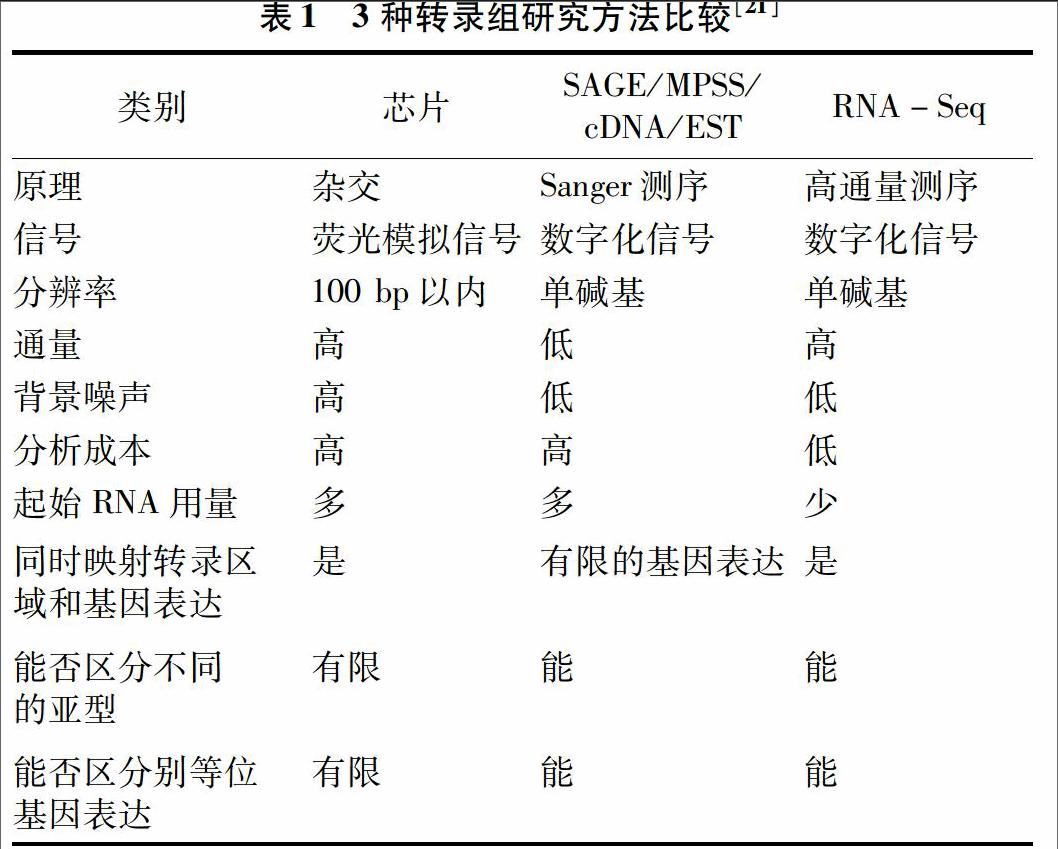
研究转录组的方法主要有2大类:(1)基于杂交技术的cDNA芯片和寡聚核苷酸芯片;(2)基于测序技术的SAGE(serial analysis of gene expression)、MPSS(massively parallel signature sequencing)、全长cDNA文库和EST文库的测序分析。对3种主要的转录组研究方法的比较见表1。
现在通常将基于第2代测序技术的转录组测序分析称为RNA-Seq。由表1可以明显看出,RNA-Seq具有以下几点优势:(1)通量高,能达到覆盖整个基因组、转录组的要求;(2)灵敏度、分辨率很高,可以精确到少至几个拷贝的稀有转录本,同时不存在传统荧光模拟信号带来的交叉反应和背景噪音的影响;(3)测序时间和成本显著下降;(4)不受限制性,可以对任意物种进行全转录组分析,同时能检测未知基因,发现新的转录本。
3.2 RNA-Seq常用的测序平台及原理
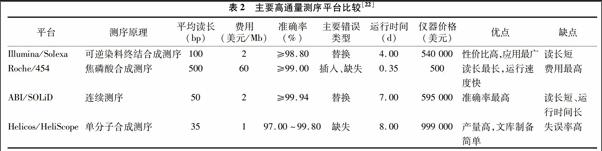
RNA测序技术沿用了SAGE技术和MPSS技术的基本原理,该技术首先将细胞中的所有转录产物反转录为cDNA 文库,然后将 cDNA文库中的DNA 随机剪切为小片段,利用新一代高通量测序仪测序直到获得足够的序列,然后计算这些短序列的个数并分析其在整个基因组中的分布,可以计算出细胞的转录组表达水平[22]。高通量测序避免了在亚克隆过程中引入的偏差,且获得的短序列长度增加了,从而提高了识别其对应基因的准确性。目前常用的高通量测序技术,主要是Roche公司的454技术、Illumina公司的Solexa技术、ABI公司的SOLiD技术以及Helicos Biosciences公司的单分子测序(single molecule sequencing,SMS)技术4种。各平台测序原理、长度的不同决定了其不同的应用侧重,我们要在熟悉各种高通量测序技术特点的基础上进行正确的选择,常见的4种RNA-Seq测序平台的比较见表2[23]。
3.3 RNA-Seq测序后结合生物信息学的相关应用
大量研究表明,RNA-Seq测序后,可选择已经公布的相同或者相近物种的基因组和基因信息为参考,进行基因的结构优化分析,预测新的基因,差异表达基因分析,基因功能注释,可变剪切分析以及SNPs、SSR分析等等[24]。当没有参考基因组时,则以GenBank中已公布的有关数据为参考,将测序数据经过软件拼接从头组装,获得contigs(重叠群)和unigenes(拼接的非冗余基因),然后再进行之后的分析。拼接组装之后就可以进行unigene功能注释,与数据库中已注释功能的基因对比进行GO(gene ontology,基因的分子功能、生物学过程和细胞组件)和KEGG(kyotoencyclopedia of genes and genomes,基因和基因产物、基因编码产物、新陈代谢途径等)分析;开发品种的SNP和SSR,从而为品种发育及疾病的判断提供支持;比较不同样品间表达差异基因,进行基因差异表达分析,得出每个样品中的上调或者下调基因等[24]。
4 转录组分析在动植物研究中的应用
4.1 转录组分析在植物抗逆性研究中的应用
严东辉通过半干旱地区的胡杨对干旱适应性响应的转录组分析,获得了277个在干旱处理中表现出一致变化的基因,有1 938个表达转录子表现出干旱强度的专化性,并说明了不同干旱程度激活相应的响应调解途径[25];霍达等整合分析了7种不同盐生植物盐胁迫应答转录组学的研究结果,从整体上分析了植物在盐胁迫应答过程中所有mRNA的变化情况,建立了盐碱胁迫相关的cDNA文库和EST数据库[26],并利用反向Northern杂交分析技术[27-28]、5′cDNA末端快速扩增(RACE)技术[28]、反转录PCR[29-30]、实时定量反转录PCR等辅助技术对胁迫相关基因进行了功能分析[31],为全面理解盐生植物应答盐碱胁迫的代谢调控机制提供了线索;许长征通过低磷处理玉米根系的转录组分析,揭示了低磷胁迫对玉米转录的影响[32],对挖掘作物磷高效分子育种有重要意义。
4.2 转录组分析在水产动物分子生物学研究中的应用
曾地刚等通过高通量测序,获得了丰富的凡纳滨对虾转录组信息,为其新基因的克隆和基因组学研究提供了有价值的数据[33];在感病草鱼脾脏的比较转录组分析试验中,通过转录组技术筛选出了与抗病草鱼出血病病毒相关的信号因子及信号通路[34];董迎辉通过高通量454测序技术对泥蚶不同组织器官和不同发育阶段样品进行转录组测序,并进行拼接组装和基因注释,发掘与生长、代谢、繁殖抗病等主要经济性状相关的基因,为后续开展功能基因研究和分子育种等提供了有价值的信息[35]。
5 结论
迄今为止,已有100多篇关于植物在盐胁迫或者干旱胁迫下的转录组学的研究报道[36],关于水产动物疾病等的转录组分析也有少量报道,但是关于水产动物氨氮胁迫转录组分析的研究报道甚少,可以以已发表的动植物相关胁迫转录组分析为借鉴和线索来开展转录组分析在水产动物氨氮胁迫中的应用研究。“中国科学技术协会第264次青年科学家论坛水产动物育种与生物技术的会议”中曾提到,高通量测序等遗传工具的开发、尼罗罗非鱼性腺发育转录组分析、高通量测序的SNP筛选及基因克隆等在水产动物育种中转录组应用的研究有越来越多的趋势。endprint
氨氮胁迫的分子机制的研究依赖于技术的进步,新兴的RNA测序技术能产生海量的数据,RNA-Seq是基于直接测序的方法[22],以定量的方式对全转录组进行深度测序,将给水产动物氨氮胁迫的研究带来新的契机。此外,逆境胁迫下的水产动物转录组学与蛋白组学以及代谢组学的研究结果相结合将推动抗逆分子机制的研究。
参考文献:
[1]Herbert R A. Nitrogen cycling in coastal Marine ecosystems[J]. FEMS Microbiology Reviews,1999,23(5):563-590.
[2]Koo J G,Kim S G,Jee J H,et al. Effects of ammonia and nitrite on survival,growth and moulting in juvenile tiger crab,Orithyia sinica (Linnaeus)[J]. Aquaculture Research,2005,36(1):79-85.
[3]De Freitas R M,Rodriguez E M,Santos E A,et al. Histopathological changes in gills of the estuarine crab Chasmagnathus granulate (Crustacea-Decapoda) following acute exposure to ammonia[J]. Comparative Biochemistry and Physiology Part C Toxicology & Pharmacology,2000,125(2):157-164.
[4]Wicks B J,Joensen R,Tang Q,et al. Swimming and ammonia toxicity in salmonids:the effect of sub lethal ammonia exposure on the swimming performance of coho salmon and the acute toxicity of ammonia in swimming and resting rainbow trout[J]. Aquatic Toxicology,2002,59(1/2):55-69.
[5]姜令绪,潘鲁青,肖国强. 氨氮对凡纳对虾免疫指标的影响[J]. 中国水产科学,2005,11(6):537-541.
[6]Tietge J E,Johnson R D,Bergman H L. Morphometric changes in gill secondary lamellae of brook trou (Salvelinus fontinalis) after long-term exposure to acid and aluminum[J]. Canadian Journal of Fisheries and Aquatic Sciences,1988,45(9):1643-1648.
[7]卢健民,卢 玲,蔺玉华,等. 低pH水平对鲤鱼生长及血糖浓度影响的研究[J]. 水产学杂志,2001,14(1):51-53.
[8]Peyghan R,Takamy G A. Histopathological,serum enzyme,cholesterol and urea changes in experimental acute toxicity of ammonia in common carp Cyprinus carpio and use of natural zeolite for prevention[J]. Aquaculture International,2002,10(4):317-325.
[9]王金叶,李 华,巩 华,等. 氨氮、亚硝态氮亚急性毒性对鲤红细胞膜流动性和过氧化脂质的影响[J]. 水产学报,2004,28(增刊1):135-140.
[10]吴若菁,陈宜秋,林 霞,等. 利用泥鳅红细胞核的遗传损伤监测福州市内河水质[J]. 应用与环境生物学报,2005,11(1):59-63.
[11]乔顺风.水体氨氮转化形式与调控利用的研究[J]. 饲料工业,2005,26(12):44-46.
[12]Randall D J,Tsui T K N. Ammonia toxicity in fish[J]. Marine Pollution Bulletin,2002,45(1/2):17-23.
[13]黄鹤忠,李 义,宋学宏,等. 氨氮胁迫对中华绒螯蟹(Eriocheir sinensis) 免疫功能的影响[J]. 海洋与湖沼,2006,37(3):198-205.
[14]金 珊,程岩雄,杨玉姣,等. 铵氮胁迫对拟穴青蟹Scylla paramamosain免疫力的影响[J]. 浙江农业学报,2008,20(6):402-407.
[15]张亚娟,刘存歧,王军霞,等. 氨态氮和亚硝态氮对日本沼虾血细胞数量及血蓝蛋白含量的影响[J]. 四川动物,2008,27(5):853-854.
[16]Chantal M,Etienne Z,Cyrille G,et al. Combined effect of exposure to ammonia and hypoxia on the blue shrimp Litopenaeus stylirostris survival and physiological response in relation to molt stage[J]. Aquaculture,2008,274(2/4):398-407.endprint
[17]邱德全,周鲜娇,邱明生. 氨氮胁迫下凡纳滨对虾抗病力和副溶血弧菌噬菌体防病效果研究[J]. 水生生物学报,2008,32(4):455-461.
[18]彭自然,臧维玲,高 杨,等. 氨和亚硝酸盐对凡纳滨对虾幼虾的毒性影响[J]. 上海水产大学学报,2004,13(3):274-278.
[19]Racotta I S,Hernández-Herrera R. Metabolic responses of the white shrimp,Penaeus vannamei,to ambient ammonia[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2000,125(4):437-443.[HJ1.7mm]
[20]韩力强,康现江,李双石,等. 氨氮对斑马鱼2种代谢酶类的影响[J]. 河北大学学报:自然科学版,2005,25(2):179-184.
[21]Costa V,Angelini C,De Feis I,et al. Uncovering the complexity of transcriptomes with RNA-Seq[J]. Journal of Biomedicine and Biotechnology,2010:853916.
[22]Wang Z,Gerstein M,Snyder M. RNA-Seq:a revolutionary tool for transcriptomics[J]. Nature Reviews Genetics,2009,10(1):57-63.
[23]祁云霞,刘永斌,荣威恒. 转录组研究新技术:RNA-Seq及其应用[J]. 遗传,2011,33(11):1191-1202.
[24]张春兰,秦孜娟,王桂芝,等. 转录组与RNA-Seq技术[J]. 生物技术通报,2012(12):51-56.
[25]严东辉. 胡杨干旱响应转录组及NF-YB基因表达谱[D]. 北京:北京林业大学,2013.
[26]霍 达,张 恒,戴绍军. 盐生植物盐碱胁迫应答转录组学分析[J]. 现代农业科技,2011(5):11-12.
[27]Wang Y C,Yang C P,Liu G F,et al. Development of a cDNA microarray to identify gene expression of Puccinellia tenuiflora under saline-alkali stress[J]. Plant Physiology and Biochemistry,2007,45(8):567-576.
[28]Jha B,Agarwal P K,Reddy P S,et al. Identification of salt-induced genes from Salicornia brachiata,an extreme halophyte through expressed sequence tags analysis[J]. Genes & Genetic Systems,2009,84(2):111-120.
[29]Wong C E,Li Y,Labbe A,et al. Transcriptional profiling implicates novel interactions between abiotic stress and hormonal responses in Thellungiella,a close relative of Arabidopsis[J]. Plant Physiology,2006,140(4):1437-1450.
[30]Diédhiou C J,Popova O V,Golldack D. Transcript profiling of the salt-tolerant Festuca rubra ssp. litoralis reveals a regulatory network controlling salt acclimatization[J]. Journal of Plant Physiology,2009,166(7):697-711.
[31]Gao C Q,Wang Y C,Liu G F,et al. Expression profiling of salinity-alkali stress responses by large-scale expressed sequence tag analysis in Tamarix hispid[J]. Plant Molecular Biology,2008,66(3):245-258.
[32]许长征. 玉米根系对低磷胁迫响应的转录组分析[D]. 济南:山东大学,2009.
[33]曾地刚,陈秀荔,谢达祥,等. 基于高通量测序的凡纳滨对虾的转录组分析[J]. 基因组学与应用生物学,2013,32(3):308-313.
[34]许宝红. 感病草鱼脾脏的比较转录组分析[D]. 长沙:湖南农业大学,2012.
[35]董迎辉. 泥蚶高通量转录组分析及生长相关基因的克隆与表达研究[D]. 青岛:中国海洋大学,2012.
[36]Deyholos M K. Making the most of drought and salinity transcriptomics[J]. Plant Cell and Environment,2010,33(4):648-654.endprint
