磁敏感加权成像在帕金森病及血管性帕金森综合征诊断、鉴别诊断中的临床研究
2015-07-31安徽省马鞍山市十七冶医院神经内科2安徽省马鞍山市十七冶医院磁共振室安徽马鞍山243000
1.安徽省马鞍山市十七冶医院神经内科2.安徽省马鞍山市十七冶医院磁共振室(安徽 马鞍山 243000)
储佺兵1 胡中华2 解 渊1苑瑞敏1 陈广生1 倪昌健1张 晗1 孔晓健2
磁敏感加权成像在帕金森病及血管性帕金森综合征诊断、鉴别诊断中的临床研究
1.安徽省马鞍山市十七冶医院神经内科2.安徽省马鞍山市十七冶医院磁共振室(安徽 马鞍山 243000)
储佺兵1胡中华2解 渊1苑瑞敏1陈广生1倪昌健1张 晗1孔晓健2
目的探讨磁敏感加权成像(SWI)在帕金森病(PD)及血管性帕金森综合征(VP)诊断、鉴别诊断中的临床应用价值。方法收集我院2013年6月-2015年3月间收治的30例帕金森病患者(PD组)及25例血管性帕金森病患者(VP组),同时将同期收集25例健康老年人(NC组)纳入对照组。三组患者均行磁敏感加权成像检查,比较三组患者黑质致密带(SNc)、黑质网状带(SNr)、红核(RN)、苍白球(GP)、壳核(PUT)和尾状核(CN)中的相位值。结果PD组中黑质致密带(SNc)、苍白球(GP)、壳核(PUT)的相位值明显低于VP组(P<0.05),两组黑质网状带(SNr)、红核(RN)和尾状核(CN)的相位值比较无明显差别(P>0.05),VP组中各核团相位值与NC组相比无明显差别(P>0.05)。结论运用磁敏感加权成像测定PD及VP患者黑质致密带、苍白球、壳核中的相位值对二者诊断、鉴别诊断起到一些参考价值。
磁敏感加权成像;帕金森病;血管性帕金森综合征;鉴别诊断;相位值
帕金森病和血管性帕金森综合征同为神经内科常见疾病,两者在临床上的征状相似,患者都表现运动迟缓、肌强直、姿势调节障碍。但二者的发病原因有明显区别,前者主要是因为黑质纹状体病变所致运动障碍,而后者多由脑血管病变所致,如多发性腔隙性脑梗死、基底核腔隙状态、淀粉样血管病,以及皮质下白质脑病。磁敏感加权成像目前在临床上得到了越来越多的应用,它是一种梯度回波序列,对铁、静脉结构和血液代谢物极其敏感,因此常用于代谢性脑病、动静脉畸形等疾病的诊断中[1]。本次研究中,将通过分析磁敏感加权成像的相位值,对磁敏感加权成像在帕金森病及血管性帕金森综合征诊断、鉴别诊断中的临床应用价值进行探讨。
1 资料与方法
1.1 一般资料病例来源于收集我院2013年6月~2015年3月收治的帕金森病患者30例及血管性帕金森病患者25例,分别纳入帕金森病组和血管性帕金森综合征组;同时同期收集健康老人25例纳入对照组。帕金森病纳入标准:参照2005年原发性帕金森病诊断标准[2],并重新评价患者病历及头颅CT或MRI检查结果以协助确定PD诊断。血管性帕金森综合征病纳入标准:参考户村则照提出的[3]:1)表现为碎步前冲步态,动作少,肌强直,震颤特别是静止性震颤少见;2)伴有不同程度的智能障碍及锥体束征;3)有高血压动脉硬化史或既往脑卒中史;4)发病年龄较晚,多巴胺替代治疗差;5)排除药物,外伤及其他原因所致帕金森综合征。帕金森病组30例中男性15例,女性15例,年龄53~84岁,平均(67.3±4.2)岁,病程2~14年,平均(3.1±1.3)年。血管性帕金森综合征组25例中男性15例,女性10例,年龄57~81岁,平均(62.3±5.9)岁,病程2~10年,平均(2.1±1.8)年。对照组25例中男性11例,女性14例,年龄51~78岁,平均(61.3±5.3)岁。经统计学分析,两组患者年龄、性别、年龄、病程等一般资料均无统计学意义(P>0.05),具有可比性。
1.2 方法三组入组人员均给予头部磁共振平扫及磁敏感加权成像。使用美国GE公司1.5T HDxt MR进行检查。使用正交头线圈,相关参数设置如下:自旋回波序列(SE),轴位T1WI(TR 635ms、TE 23.4ms),轴位T2WI(TR 4600ms、TE 110ms)及FLAIR序列(TR 9602ms、TE 117ms),层厚 5.0mm, 层间距 1.5mm,各横轴位 MR 扫描定位层面相同,加做 SWI(ESWAN)序列,成像参数:SWI序列:TR 34.0ms,TE 20.0ms,带宽41.67Hz,矩阵448×448,层厚2.0mm,间距0,视野(FOV)24mm,激发角度15°。将通过此参数设置取得的图像及数据输入工作站中,测定锥体外系中各个核团,包括黑质致密带(SNc)、黑质网状带(SNr)、红核(RN)、苍白球(GP)、壳核(PUT)和尾状核(CN)中的相位值。
1.3 统计学方法采用SPSS21.0统计软件对所得数据进行统计分析,定性资料采用独立样本R×C列联表资料的χ2检验;定量资料,以均数±标准差(X-±S)表示,采用配对设计资料的t检验或两独立样本资料的t检验。按α=0.05的检验水准,以P<0.05为差异有统计学意义。
2 结 果
2.1 三组核团相位值比较对所有入组患者进行磁敏感检查后测定锥体外系核团的相位值,并进行比较,发现部分核团的相位值在帕金森病组、血管性帕金森综合征组和对照组间明显不同,这些核团分别为黑质致密带(SNc)、苍白球(GP)、壳核(PUT)。见表1。
表1 帕金森病组、帕金森综合征组、对照组锥体外系核团相位值()
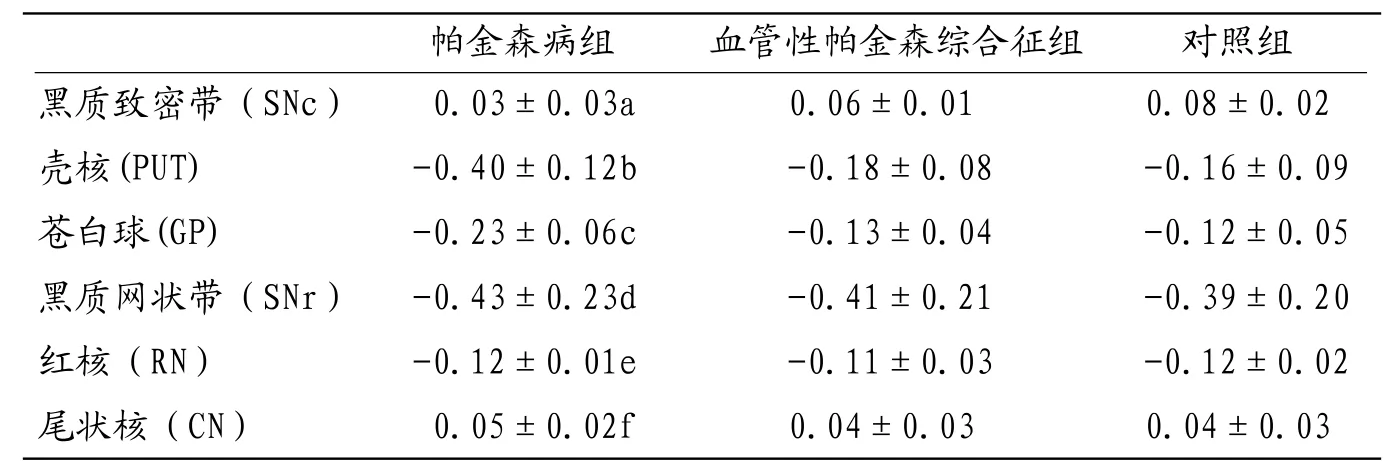
表1 帕金森病组、帕金森综合征组、对照组锥体外系核团相位值()
注:帕金森病组与血管性帕金森综合征组比较,a t=4.74,P<0.05, bt=7.63,P<0.05,ct=6.93,P<0.05,差异均具有统计学意义;dt=0.32,P=0.74, et=1.58,P=0.12, ft=1.38,P=0.17,差异均无统计学意义。同理计算,血管性帕金森综合征组患者与对照组患者各核团相位值无显著差异(P>0.05),这样就可知SNr、RN和CN在三组中均无差异(P>0.05)。
帕金森病组 血管性帕金森综合征组 对照组黑质致密带(S N c) 0 . 0 3 ± 0 . 0 3 a 0 . 0 6 ± 0 . 0 1 0 . 0 8 ± 0 . 0 2壳核( P U T ) -0 . 4 0 ± 0 . 1 2 b -0 . 1 8 ± 0 . 0 8 -0 . 1 6 ± 0 . 0 9苍白球( G P ) -0 . 2 3 ± 0 . 0 6 c -0 . 1 3 ± 0 . 0 4 -0 . 1 2 ± 0 . 0 5黑质网状带(S N r) -0 . 4 3 ± 0 . 2 3 d -0 . 4 1 ± 0 . 2 1 -0 . 3 9 ± 0 . 2 0红核(R N) -0 . 1 2 ± 0 . 0 1 e -0 . 1 1 ± 0 . 0 3 -0 . 1 2 ± 0 . 0 2尾状核(C N) 0 . 0 5 ± 0 . 0 2 f 0 . 0 4 ± 0 . 0 3 0 . 0 4 ± 0 . 0 3
3 讨 论
血管性帕金森综合征是由于脑血管病变如多发性腔隙性脑梗死、基底核腔隙状态、淀粉样血管病,以及皮质下白质脑病等导致的,临床表现为动作缓慢、表情呆板,呈“面具脸”等类似于帕金森病的一类综合征。血管性帕金森综合征患者既往多有高血压病、脑卒中等疾病史,多首先表现为脑血管征状,后发展成为帕金森综合征,呈现肌强直、步态改变等表现,患者的静止性震颤较为少见;而帕金森病则为一种神经变性疾病,震颤较为多见[4]。以上几点可以作为血管性帕金森综合征和帕金森病之间鉴别诊断的依据之一,常运用于临床诊断治疗过程中二者的鉴别。临床上部分帕金森病患者同时合并脑血管疾病,当两种疾病患者在早期临床征状相似时,这给PD和VP的鉴别带来一些困难。
磁共振是在临床中运用广泛的一种影像学检查手段,能够准确定位病变,因此在神经病学诊断中常常起着重要作用[5,6]。血管性帕金森综合征和帕金森病患者的头部MRI检查结果也有一些可供鉴别之处:血管性帕金森综合征患者常在双侧基底节及侧脑室周围出现多发腔隙性脑梗死,而帕金森病患者则可无明显特异性改变[7]。由于帕金森病患者中部分可出现脑血管病,因此MRI作为鉴别诊断的客观依据就稍有不足。SWI是磁敏感检查,主要用于中枢神经系统疾病,能够较为清晰的显示体内顺磁性物质的分布及含量,同时也能够较为至关的展示体内异常脑血管结构[8]。SWI检查在成像后,对原始相位图进行高频滤波,去除空气-组织界面背景磁场的不均匀对相位造成的干扰,得到校正相位图。
校正相位图上的信号强度直接反映各点的相位值。由于帕金森病属于与铁、钙沉积相关的神经变性疾病[9],因此通过SWI进行血管性帕金森综合征和帕金森病的鉴别诊断具有一定的可行性。
帕金森病是发生在中年以上常见的神经系统变性疾病。该病的发病机制十分复杂,非单一因素致病,可能多种因素参与。遗传因素使患病易感性增加,在环境因素及年龄老化共同作用下,通过氧化应激和自由基生成、线粒体功能衰竭、钙超载、兴奋性氨基酸毒性及细胞凋亡等机制引起黑质DA能神经元变性,导致发病。其中氧化应激和自由基生成、钙超载导致铁、钙沉积黑质纹状体通路。脑中存在着铁代谢异常,致使脑中铁含量增加,引起多巴胺神经元变性损伤[10]。而血管性帕金森综合征患者则主要是由于多发的腔隙性梗死导致,病变并非主要累及锥体外系,铁含量较少[11]。本次研究结果表明,采用SWI序列对血管性帕金森综合征和帕金森病患者锥体外系的核团的相位值进行比较后发现,帕金森病患者中黑质致密带、苍白球、壳核的相位值明显低于血管性帕金森综合征患者。通过PD组和VP组SWI相关核团的相位值结果综合分析,更加提高了帕金森病及血管性帕金森综合征之间鉴别诊断的准确性。
综上所述,运用磁敏感加权成像测定帕金森病及血管性帕金森综合征患者黑质致密带、苍白球、壳核中的相位值对二者的诊断、鉴别诊断临床上起到一定的参考价值。
1. Frosini D, Pesaresi I, Cosottini M, et al. Parkinson’s disease and pathological gambling: results from a functional MRI study [J]. Mov-Disord, 2010, 25 (14): 2449-2453.
2. 蒋雨平,王坚,丁正同.原发性帕金森病的诊断标准[J].中国临床神经科学,2006,14(1): 40.
3. 焦玲,楚兰.血管性帕金森综合征的临床与头部MRI研究[J].中风与神经疾病杂志,2010,27(4): 355-356.
4. 张静,张云亭,何宁,陈静,何亚娜.磁敏感加权成像对帕金森病患者丘脑底核的显示价值初探[J].磁共振成像,2011,05:353-357.
5. 董玉茹,王宏,马毅等,,水成像在视神经磁共振扫描中的应用[J].中国CT和MRI杂志,2015,13(2):15-17.
6. 刘一萍,徐凯,路莉等,颅内毛细胞星形细胞瘤的MRI表现[J].中国CT和MRI杂志,2015,13(1):18-20.
7. 许秀安,申宝忠,王丹,孙夕林,王凯,刘芳.磁敏感加权成像在帕金森病中的应用研究[J].现代生物医学进展,2011,21:4090-4094.
8. 王铁铮,林祥涛,赵斌.磁敏感加权成像对帕金森病脑核团的显示及其铁沉积差异测定[J].医学影像学杂志,2013,9:1345-1349.
9. 刘放,申宝忠,王丹,许秀安,孙夕林.应用磁敏感加权成像检测帕金森病患者脑铁含量变化的初步研究[J].现代生物医学进展,2012,30:5845-5847+5910.
10.Bohlhalter S, Abela E, Hallett M. Functional MRI of impaired finger dexterity in Parkinson’s disease [J]. Exp-Neurol, 2011, 227 (1): 24-25.
11.Ma Y, Huang C, Dyke JP, et al. Parkinson’s disease spatial co- variance pattern: noninvasive quantification with perfusion MRI[J]. J Cereb Blood Flow Metab, 2010, 30 (3): 505-509.
(本文编辑: 黎永滨)
Susceptibility Weighted Imaging in Parkinson's Disease and Vascular Parkinsonism Diagnosis, Differential Diagnosis of Clinical Research
CHU Quan-bing, HU Zhong-hua, JIE Yuan,et al., 1.Department of Neurology, Seventeen Ye Hospital, Maanshan 243000,Anhui Province,China; 2 Department of MRI, Seventeen Ye Hospital, Maanshan 243000,Anhui Province, China
ObjectiveTo investigate the susceptibility weighted imaging (SWI) in Parkinson's disease (PD) and vascular vascular parkinsonism (VP) diagnosis, differential diagnosis of clinical value.MethodsCollected in our hospital in June 2013-March 2015 30 cases were treated with Parkinson's disease (PD group) and 25 cases of patients with vascular parkinsonism (VP group), while 25 cases of healthy elderly will collect the same period (NC group) included in the control group. Three patients underwent magnetic resonance susceptibility weighted imaging compared three groups of patients in the substantia nigra pars compacta (SNc), substantia nigra pars reticulata band (SNr), red nucleus (RN), globus pallidus (GP), putamen (phase value PUT) and the caudate nucleus (CN) in.ResultsPD group in the substantia nigra pars compacta (SNc), globus pallidus (GP), putamen (PUT) phase was significantly lower than VP group (P<0.05),, red nucleus with two substantia nigra pars reticulata (SNr) (RN) and the caudate nucleus (CN) phase value was no significant difference (P>0.05), VP group phase value of each nuclei compared with the NC group had no significant difference (P>0.05).ConclusionMeasured using susceptibility weighted imaging in patients with PD and VP with substantia nigra, globus pallidus, putamen phase values for both diagnosis and differential diagnosis play some reference value.
Magnetic Resonance Imaging; Parkinsonian Disorder; Vascular Parkinsonism; Differential Diagnosis; Phase Value
R447
A
10.3969/j.issn.1672-5131.2015.08.003
2015-07-08
储佺兵
