9例肿瘤源性骨软化症诊治分析
2015-07-28陈佳田萌萌李伟邓微
陈佳 田萌萌 李伟 邓微#
北京积水潭医院1内分泌科,2病理科,北京100035
9例肿瘤源性骨软化症诊治分析
陈佳1田萌萌2李伟1邓微1#
北京积水潭医院1内分泌科,2病理科,北京100035
目的分析肿瘤源性骨软化症(tumor-induced osteomalacia,TIO)的临床特点、诊断和治疗方法,以提高对本病的认识。方法收集并整理9例TIO患者的临床表现、实验室检查、影像学特点及治疗方法等资料,分析和比较患者手术前后的血生化指标的改变。结果患者均有骨痛、无力及活动受限的表现,实验室检查提示低磷血症,骨扫描提示骨质疏松、骨软化症。9例患者均进行奥曲肽显像(99mTc-OCT),其中8例诊断部位准确,另1例显像定位不准确,后经68Ga-TATE及其他影像学检查确诊病灶部位。8例患者病理诊断为磷酸盐尿性间叶组织肿瘤,1例为胸膜外脂肪瘤样型孤立性纤维性肿瘤。7例患者在明确肿瘤定位后立即接受手术切除治疗,术后血磷恢复正常,并在术后6~12个月保持在正常水平。结论TIO多见于成人起病、无家族史的低磷骨软化症患者。99mTc-OCT对诊断本病有重要意义,B超、CT、MRI及骨扫描等对辅助定位和诊断病灶有帮助,必要时可进行68Ga-TATE检查。确定肿瘤病灶之后及时进行手术切除,是目前最有效的治疗方法。
肿瘤源性骨软化症;磷酸盐尿性间叶肿瘤;低磷血症;骨软化症
Oncol prog,2015,13(4)
TIO是一种由肿瘤引起的获得性低血磷性骨软化症,临床表现为不明原因的骨痛、肌肉无力、骨骼畸形甚至骨折。实验室检查可有低血磷、高尿磷及血清碱性磷酸酶(alkaline phosphatase,AKP)水平升高;骨代谢方面具有骨骼矿化障碍等特点[1]。TIO肿瘤常来源于间叶组织的良性肿瘤,多为磷酸盐尿性间叶肿瘤的混合结缔组织亚型(PTM-MCT)[2]。由于该肿瘤细胞过度分泌血成纤维细胞生长因子23(FGF-23),从而抑制近端肾小管钠-磷转运蛋白功能,使肾重吸收磷减少,尿磷增多[2]。一旦确诊为TIO,手术治疗可取得良好效果。但由于该肿瘤位置隐匿,生长缓慢,不易被发现,再加上本病为少见病,故临床医生多对TIO的认识不足,易导致长期漏诊和误诊。因此,本文分析9例TIO患者的相关资料并进行研究,以期提高对本病的认识。
1 资料和方法
1.1 临床资料
收集2013年1月至2015年1月在北京积水潭医院收治的TIO患者9例,其中男性5例,女性4例,均无阳性家族史;年龄在38~55岁,平均为45.6岁;病程为半年至4年,平均为1.8年。详细临床资料见表1。
1.2 方法
统计并分析9例TIO患者的临床资料,包括临床表现、实验室检查、影像学特征、诊断和治疗经过、病理学资料、手术前后临床及血生化指标变化情况等。
2 结果
2.1 症状与体征
9例患者均有骨痛、双下肢乏力及活动受限的表现,其中5例主诉腰背部/髋部疼痛伴近期加重,4例为四肢或双下肢疼痛伴无力或活动困难。没有患者出现明显的身高缩短。
2.2 实验室检查
9例TIO患者的血磷水平均明显低于正常值,其范围为0.24~0.73mmol/L(正常参考值:0.81~1.65mmol/L)。尿磷排出相对增多,即24小时尿磷水平明显升高:16.97~36.26mmol/L(正常参考值:9.7~42 mmol/l;如血磷<0.6 mmol/l,尿磷几乎为0 mmol/L)。血钙正常或轻度下降:2.01~2.39mmol/L(正常参考值:2.20~2.55mmol/L)。9例患者中有3例患者AKP高于正常水平:176~237 U/L(正常参考值:40~150 U/L)。6例患者全段甲状腺旁腺激素(intact parathyroid hormone,iPTH)轻度升高,3例正常。β-Ⅰ型胶原交联羧基末端肽(β-CTX)在7例患者中有轻度升高:0.68~0.89 ng/m(l正常参考值:<0.584 ng/m l)。总Ⅰ型前胶原氨基端延长肽(tPINP)在7例患者中都有不同程度的升高:64.2~116.8 ng/m(l正常参考值:13.1~58.5 ng/m l)。大部分患者(9例中的8例)维生素D水平都低于正常范围:4.22~16.72 ng/m l(正常参考值:20~40 ng/m l)。9例TIO患者的术前各项实验室检查结果见表2。
2.3 影像学检查
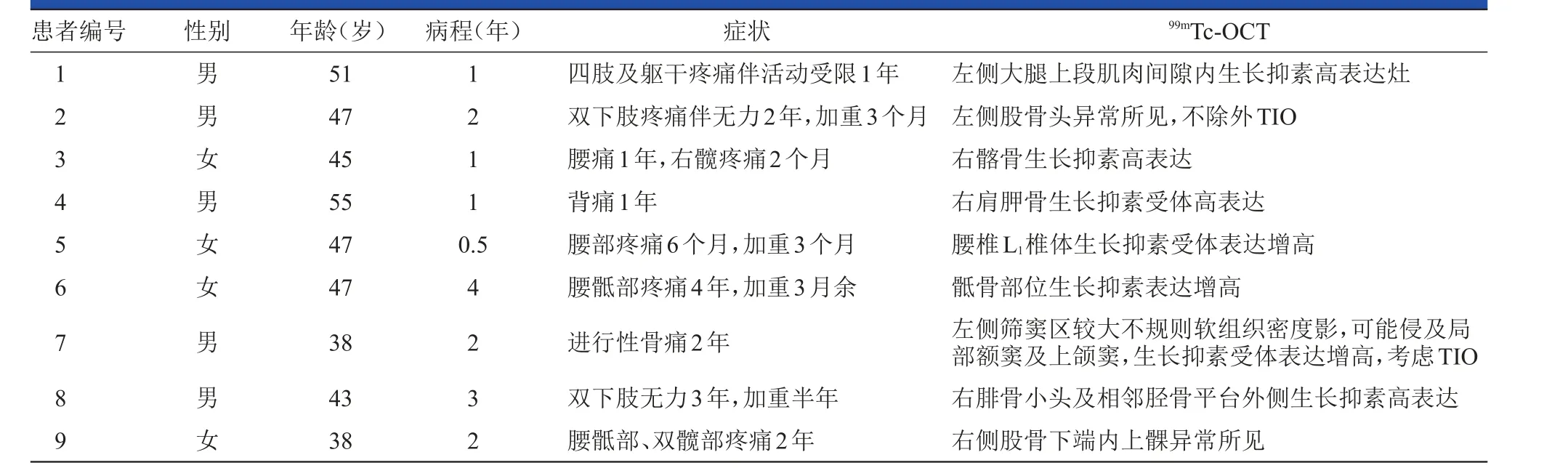
表1 9例TIO患者的临床资料和99m Tc-OCT显像结果
9例TIO患者中有5例患者进行X线检查,结果显示这些患者均存在骨质异常、骨质破坏或骨质密度欠规则等表现,其中2例显示腰椎破坏或退行性改变。全身骨扫描呈严重骨质疏松及代谢性骨病的表现(图1)。应用99mTc-OCT进行定性检查,结果显示9例患者均出现身体某一部位生长抑素受体表达增高。随后进行局部CT、MRI、超声、PET-CT等检查,以进一步了解肿瘤的定位情况,结果显示8例肿瘤定位与99mTc-OCT定位一致,1例肿瘤定位与99mTc-OCT定位不一致(病例2),99mTc-OCT结果显示左侧股骨头附近有生长抑素受体高表达区,但患者进一步做68Ga-TATE[3]显像检查、CT和MRI检查最终确定肿瘤部位在右侧股骨近端。由此可见,虽然99mTc-OCT对本病的诊断和定位有着重要作用,但也存在假阳性结果的可能,综合使用上述各项检查方可明确TIO的肿瘤定位(图2)。

表2 9例TIO患者的术前实验室检查结果
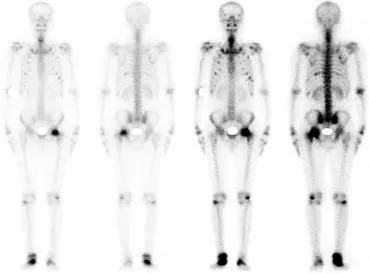
图1 病例2的骨扫描图
2.4 治疗
患者入院后予以口服中性磷溶液20 m l,tid;碳酸钙600mg,qd;骨化三醇250mg,bid;静脉注射甘油磷酸钠10m l,qd。9例患者中有7例患者在明确肿瘤定位后进行病灶全切手术治疗,术后3天血磷水平即恢复正常(图3 A;P=8.6E-05,t检验),随访3~12个月不等,血磷仍然正常。2例患者暂不愿进行手术根治,仅进行病理活检,予以中性磷溶液和口服维生素D治疗,活检后及随访期间检查血磷未恢复正常(图3 B;P=0.33,t检验)。
2.5 病理诊断
7例患者接受病灶全切手术后送检病理,2例患者仅进行活检。9例患者中有8例病理诊断为磷酸盐尿性间叶组织肿瘤。磷酸盐尿性间叶瘤光镜下可见肿瘤组织主要由卵圆形及短梭形细胞构成,间质富含血管并见血管周细胞瘤样结构(图4),肿瘤界限不清,少数呈明显侵袭性表现,多数病例伴有不同程度的钙化,可见多核巨细胞。另外1例患者诊断为胸膜外脂肪瘤样型孤立性纤维性肿瘤,光镜下表现为含有脂肪成分的生长活跃的梭形细胞肿瘤呈血管周细胞瘤样结构,免疫组化CD34阳性支持该诊断。
3 讨论
TIO也称低磷性骨软化症,是一类好发于成人的由肿瘤细胞引起肾排磷增加而造成的获得性低血磷骨软化症。患者多表现为不明原因的全身性骨痛及关节疼痛、肌肉无力,严重者出现骨骼畸形、骨折及活动障碍。自1947年M ccance[4]首次报道TIO以来,目前国内外对该病的报道仅有300余例[5],仍属罕见病,且TIO病的发病机制至今尚未十分清楚。TIO肿瘤常来源于间叶组织的良性肿瘤,常位于软组织或骨内,位置隐匿,生长缓慢,不易被发现,容易造成诊断困难[6]。TIO还应与常染色体显性遗传低磷性佝偻病(autosomal dom inant hypophosphatem ic rickets,ADHR)、X连锁低磷性佝偻病(X-linked hypophosphatemic osteomalacia/rickets,XLH)、常染色体隐性遗传低磷性佝偻病(autosomal recessive hypophosphatemic rickets,ARHR)相鉴别。与上述疾病相比,TIO为成年起病,以骨骼疼痛伴肌肉无力为主要症状,口服中性磷溶液及维生素D症状难以缓解。在病理学研究中,Weidner等[7]在1987年正式将骨软化相关的间叶肿瘤命名为磷酸盐尿性间叶肿瘤,并分为4种亚型:混合结缔组织亚型(PMTMCT)、骨母细胞瘤样、非骨化纤维瘤样及骨化纤维瘤样亚型,其中以第一种亚型PMTMCT最为多见。这种肿瘤主要由梭形细胞和破骨细胞样多核巨细胞构成[2],其中的梭形细胞过度分泌FGF-23,FGF-23绝对值的增加会抑制近端肾小管钠-磷转运蛋白功能,造成肾重吸收磷减少而致尿磷增多。一旦确诊并将肿瘤组织切除,病情即可获得明显改善。因此,提高对本病的认识,熟悉该病的临床特点对TIO的早期诊断和治疗尤为重要。

图2 病例2的生长抑素受体99mTc-OCT显像及其他影像学检查图片
明确地对肿瘤进行定性及定位诊断是TIO治疗的前提和关键。1996年Reubi等[8]发现引起TIO的间叶组织来源肿瘤细胞表面表达生长抑素受体,因此,可以利用生长抑素类似物奥曲肽与该受体结合显像来进行TIO肿瘤定位[1]。本研究利用99mTc-OCT对9例患者进行检查,9例患者均在全身某些部位出现生长抑素受体高表达病灶。随后利用CT、MRI、PET-CT进一步对肿瘤病灶进行定位,8例的定位与99mTc-OCT检查到的肿瘤异常部位相符,仅有1例患者在随后进行的68Ga-TATE、 CT、MRI检查及手术切除时,发现肿瘤定位与99mTc-OCT定位不符。这表明虽然99mTc-OCT是TIO肿瘤定位的主要手段,但这种检查方法也具有一定的局限性,某些炎症反应或骨折可能会造成假阳性结果[5]。即使99mTc-OCT检查结果为阴性,也不能完全排除有TIO肿瘤的可能,可进一步做68Ga-TATE检查。68Ga-TATE是利用68Ga标记的DOTA-TATE生长抑素类似物进行PETCT显像,国外已广泛用于生长抑素受体阳性的肿瘤显像[3],国内目前还处于研究阶段,该检查可以同时对TIO肿瘤进行定性和定位诊断,具有良好的应用前景。
本研究中的9例患者中有7例患者在定位后接受病灶全切除手术,肿瘤切除后3天血磷恢复到正常水平,随访3~12个月不等,7例患者的血磷均保持在正常水平。而其他2例患者暂不愿接受手术,仅给予中性磷溶液、口服维生素D进行治疗,活检术后及随访期间血磷水平始终未恢复。这些结果充分表明手术切除肿瘤病灶对TIO患者的疗效显著。
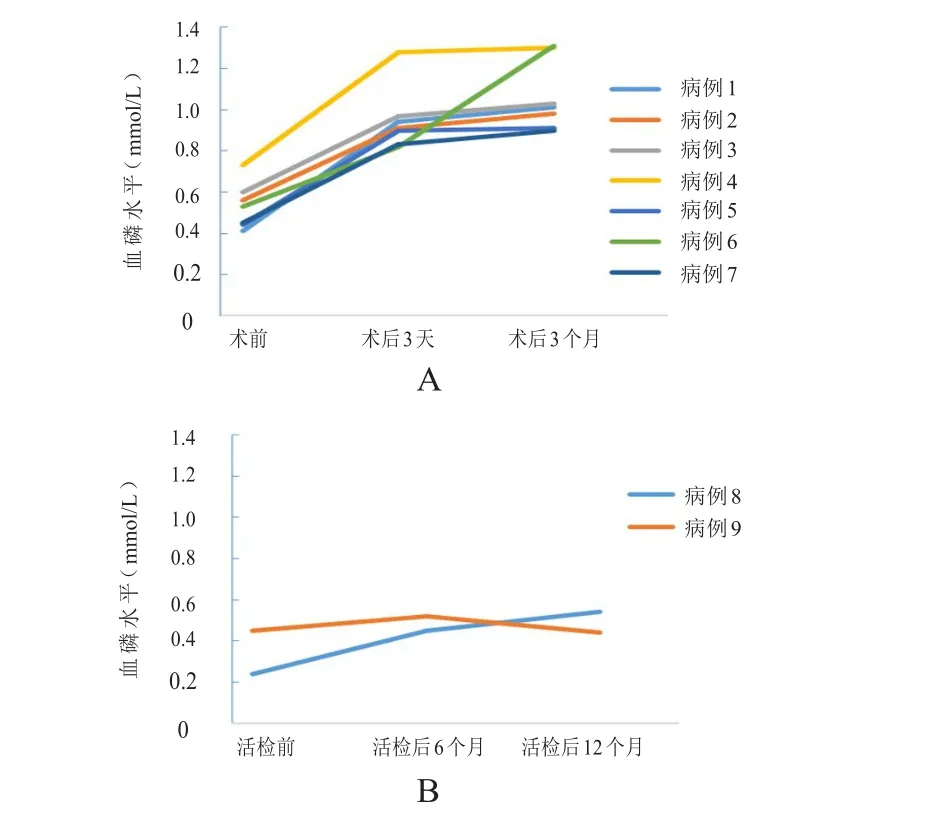
图3 治疗前后TIO患者的血磷水平变化
总体来说,由于TIO起病隐匿、病情发展缓慢,单纯补磷难以使血磷恢复正常,另外,因TIO较少见且学者们对本病认识不足,易造成诊断困难。如在临床上遇到成人起病、无家族史的低磷血症性骨软化症患者,应考虑通过多种检查手段排查TIO肿瘤的可能性。99mTc-OCT检查对发现病灶有重要意义,B超、CT、MRI及骨扫描等对辅助诊断和定位病灶都有帮助,必要时可做68Ga-TATE检查。确定肿瘤病灶后应及时进行手术切除,手术是目前最有效的治疗方法,手术时应力求将病灶切除完全和彻底。术后应进行定期随访,监测患者的血磷水平,以防复发。由于本研究随访时间较短,难以反映患者的复发情况,且未检测FGF-23水平,故仍需扩大样本量和加强随访来进行进一步研究。
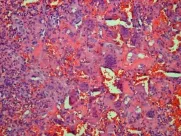
图4 病例2的肿瘤组织镜检结果(HE染色,×200)
[1]杨云建,陈继营,杨帆,等.11例瘤源性骨软化症的临床诊治分析[J].解放军医学院学报,2014,35(7): 707-709.
[2]李道胜.磷酸盐尿性间叶肿瘤的临床病理学分析[J].中华临床医师杂志(电子版),2014,8(20):3611-3614.
[3]Breer S,Brunkhorst T,Beil FT,et al.68Ga DOTATATE PET/CT allows tumor localization in patients w ith tumor-induced osteomalacia but negative 111 In-octreotide SPECT/CT[J].Bone,2014,64:222-722.
[4]M c CR.Osteomalacia w ith Looser′s nodes(M ilkman′s syndrome)due to a raised resistance to vitam in D acquired about the age of 15 years[J].Q JMed,1947,16 (1):33-46.
[5]Jiang Y,Xia WB,Xing XP,et al.Tumor-induced osteomalacia:an important cause of adult-onset hypophosphatem ic osteomalacia in China:report of 39 cases and review of the literature[J].JBone M iner Res,2012,27(9): 1967-1975.
[6]姜艳,夏维波,邢小平,等.肿瘤性骨软化症的诊断及治疗[J].中国医学科学院学报,2010,32(4):477-478.
[7]Weidner N,Santa Cruz D.Phosphaturic mesenchymal tumors.A polymorphous group causing osteomalacia or rickets[J].Cancer,1987,59(8):1442-1454.
[8]Reubi JC,Waser B,Laissue JA,et al.Somatostatin and vasoactive intestinal peptide receptors in human mesenchymal tumors:in vitro identification[J].Cancer research,1996,56(8):1922-1931.
Clinical research of 9 casesw ith tumor-induced osteomalacia
CHEN Jia1TIANMeng-meng2LIWei1DENGWei1#1Departmentof Endocrinology,2Departmentof Pathology,Beijing Jishuitan Hospital,100035
ObjectiveTo improve the clinical diagnosis and treatment of tumor-induced osteomalacia(TIO).MethodWe summarized and analyzed the comprehensive clinical data(including clinical manifestation,management,radiographic imaging,biochemical testing,peri-and post-operative clinical status)of 9 cases w ith TIO.ResultA ll the 9 patients presented w ith bone pain and muscle weakness,hypophosphatem ia and phosphaturia.Results of radiographic imaging showed that all patients had osteoporosis and the features of metabolic bone diseases.99m Tc-OCT was performed in all 9 patients and 8 of 9 cases showed correct tumor focus,one patient obtained adjusted determ ination for tumor focus w ith the help of 68Ga-TATE,CT and MRI.The diagnosis of 8 patients was confirmed by histopathology as phosphaturic mesenchymal tumor and 1 as extrapleural lipomatous solitary fibrous tumor after operation or biopsy.Serum Pi level returned and retained to normal after resection for 7 patients.ConclusionTIO is mostly seen in adult osteomalacia cases w ith hypophosphatem ia and w ithout fam ily medical history.99m Tc-OCT and other imaging exam inations are very helpful in diagnosing and locating the tumors.In addition,68Ga-TATE is applied as appropriate.A complete resection targeting definite lesions is themost effective treatment for TIO.
tumor induced osteomalacia;phosphaturicmesenchymal tumor;osteomalacia;hypophosphatemia
R738.1
A
10.11877/j.issn.1672-1535.2015.13.04.20
#通信作者(corresponding author),e-mail:dengwei95@163.com
2015-05-22)
