可根治切除残胃癌的临床病理特征及预后
2015-07-28崔亮田艳涛赵铁铮邵欣欣解亦斌赵平
崔亮 田艳涛 赵铁铮 邵欣欣 解亦斌 赵平#
1北京协和医学院中国医学科学院肿瘤医院腹部外科,北京100021
2河北省黄骅市人民医院外一科,河北黄骅061100
可根治切除残胃癌的临床病理特征及预后
崔亮1田艳涛1赵铁铮2邵欣欣1解亦斌1赵平1#
1北京协和医学院中国医学科学院肿瘤医院腹部外科,北京100021
2河北省黄骅市人民医院外一科,河北黄骅061100
目的分析可根治切除残胃癌临床病理特征及预后情况。方法回顾性分析1999年11月至2013年12月进行残胃癌根治切除术的63例患者的临床病理资料,按照初次手术方式和初次手术时疾病良恶性分组,分析比较残胃癌的临床病理特征及患者的长期生存率。结果按照初次手术疾病良恶性分组,残胃癌发病的间隔时间分别为24.8年和8.9年;肿瘤直径分别为6.9 cm和4.3 cm,残胃癌位于吻合口的比例分别为50%和26.3%。按照初次手术方式(BillrothⅡ、BillrothⅠ)分组,残胃癌发病的间隔时间分别为22.8年和12.3年。肿瘤直径分别为6.73 cm和3.75 cm,残胃癌位于吻合口的比例分别为52.4%和21%。以上各组进行比较,差异均具有统计学意义(均P<0.05)。TNMⅠ~Ⅱ期与Ⅲ期患者80个月生存率分别为64.7%和18.5%,差异有统计学意义(P<0.05)。初次手术良性组与初次手术恶性组,100个月累积生存率分别为37.1%和40%,差异无统计学意义(P>0.05)。BillrothⅡ组与BillrothⅠ组,患者80个月累积生存率分别为43.1%和27.3%,差异无统计学意义(P>0.05)。结论初次胃切除术时疾病良恶性、重建方式与残胃癌发病间隔时间、肿瘤大小、肿瘤好发部位等临床特点有关。可根治切除的残胃癌患者,其长期生存率与初次胃切除术时疾病良恶性、重建方式无关,与TNM分期有关。
残胃癌;临床病理特征;预后
Oncol Prog,2015,13(3)
残胃癌发生在因良性或恶性胃疾病而进行胃切除术的残胃,被认为是一种独立的疾病[1]。残胃癌发病率在逐年提高[2]。残胃癌被发现时多数已属于晚期,其早期诊断率、切除率、患者的预后均比原发性胃癌差[3-4]。残胃癌的切除率约为40%,根治性手术(残胃全切除术+区域淋巴结清扫)仍是其主要的治疗方式[2],术后生存率低于原发性近端胃癌患者。本研究回顾性分析已进行根治性手术的63例残胃癌患者的临床病理特征及预后情况。
1 资料和方法
1.1 临床资料
回顾性分析1999年11月至2013年12月在中国医学科学院肿瘤医院进行根治手术的63例残胃癌患者的临床病理资料。其中男性56例,女性7例,男女比例为8∶1。平均年龄为62岁(40~78岁),中位年龄为62岁。所有病例初次接受胃切除术均为远端胃切除术,其中44例患者初次手术时病变为良性(上消化道溃疡),另外19例患者初次手术时为胃癌。初次胃切除术至发生残胃癌的间隔时间为5~48年,平均为20年。初次胃切除术的重建方式为:BillrothⅠ式19例(30.2%),BillrothⅡ式42例(66.7%),Roux-en-Y式2例。根据残胃癌的发生部位,发生于吻合口者有27例(42.9%),残胃胃壁22例(34.9%),胃底贲门14例(22.2%)。肿瘤的平均直径为6.1 cm。根据组织学类型,其中未分化型患者有46例(73.0%):包括低分化腺癌32例、印戒细胞癌13例、小细胞未分化癌1例。包括高、中分化腺癌的分化型患者共17例(27.0%)。按肿瘤浸润深度,T1期患者有4例,T2期有9例,T3期有9例,T4期有41例。按淋巴结转移情况,N0期患者有26例,N1期有14例,N2期有10例,N3期有13例。
所有病例均接受了残胃癌R0切除+区域淋巴结清扫,其中接受残胃全切除术的患者有48例(76.2%,其中有9例为联合脏器切除),接受残胃大部切除术的患者有15例(23.8%)。所有患者均经术后病理学证实为残胃癌,术后病理资料完整。本研究剔除了姑息性切除术、探查术及不能手术切除的残胃癌病例,因其缺少完整的术后病理学资料。对初次手术为胃癌的病例,为了减少胃癌复发的干扰,只入组发病间隔5年以上的残胃癌病例。本研究采用2010年美国癌症联合委员会(AJCC)及国际抗癌联盟(UICC)颁布的第7版胃癌TNM分期,所有入组病例TNM分期均经过术后病理学证实。
1.2 方法
按照患者初次手术时胃部疾病的良恶性分为初次手术良性组(44例)、初次手术恶性组(19例)。按初次胃切除术时BillrothⅠ式和BillrothⅡ式两种重建方式分为BillrothⅠ组(19例)与BillrothⅡ组(42例)。分别比较两种分组方式下两组患者的性别、残胃癌发病年龄、肿瘤大小、病理类型、肿瘤浸润深度、淋巴结转移、TNM分期、残胃癌手术方式等临床病理特征的差异。随访患者术后生存时间,进行生存分析并比较生存率差异。
1.3 随访
采用电话和门诊随访,随访时间大于2年,随访截至2014年,共35例患者获得随访资料(55.6%)。
1.4 统计学分析
采用SPSS 22.0统计学软件分析处理患者的数据。计量资料采用t检验,计数资料采用Pearsonχ2检验或Fisher确切概率法。生存分析采用Kaplan-Meier法,并应用Log-Rank进行检验。以P<0.05为差异有统计学意义。
2 结果
2.1 初次手术良性组、初次手术恶性组临床病理特征比较
初次手术良性组和初次手术恶性组两组资料比较的结果见表1。初次手术良性组初次胃切除术至残胃癌发病的平均间隔时间长于初次手术恶性组(24.8年vs 8.9年);且初次手术良性组肿瘤的平均直径大于初次手术恶性组(6.9 cm vs 4.3 cm);初次手术良性组中残胃癌位于吻合口的患者比例占50%,高于初次手术恶性组的26.3%;初次手术良性组中未分化型占63.6%,低于初次手术恶性组的94.7%;以上组间差异均有统计学意义(P<0.05)。两组中初次胃切除术后的重建方式差别有统计学意义(P<0.05)。两组患者的性别、残胃癌发病年龄、肿瘤浸润深度、淋巴结转移、TNM分期等临床病理特征的差异均无统计学意义(P>0.05)。
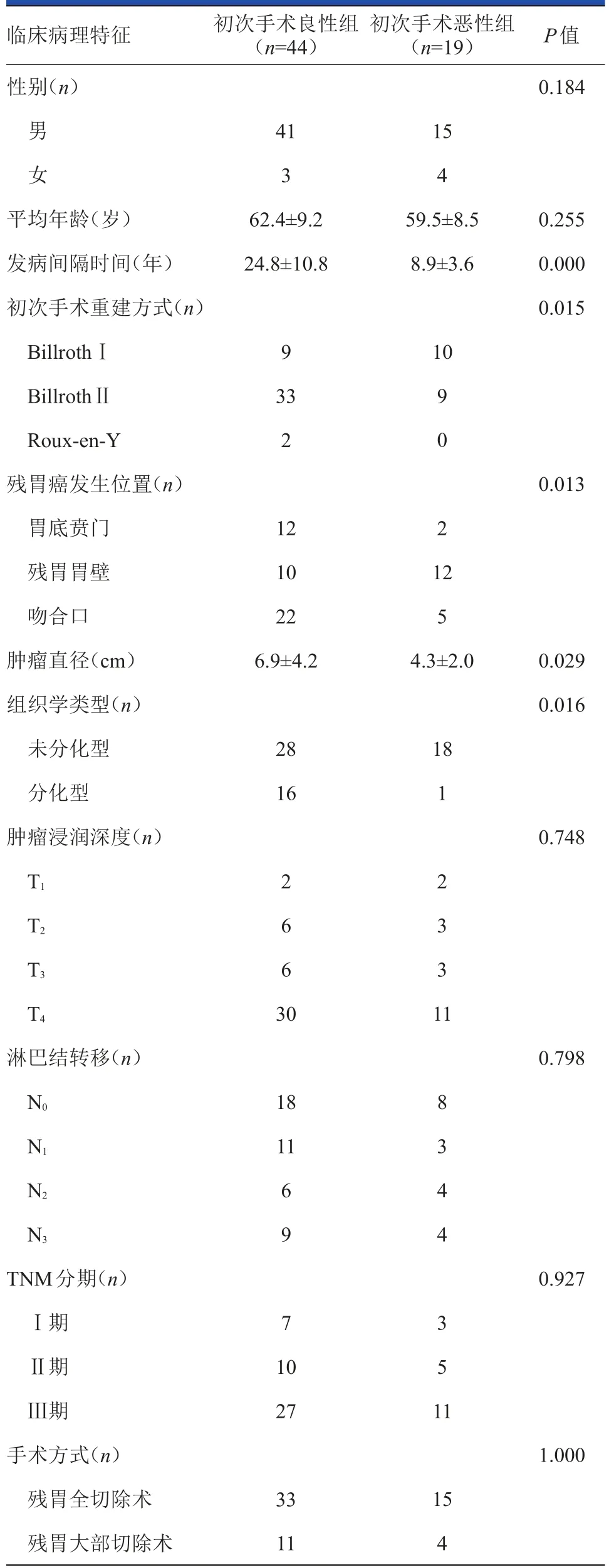
表1 初次手术良、恶性组残胃癌临床病理特征
2.2 Billroth Ⅰ组与BillrothⅡ组临床病理特征比较

表2 BillrothⅠ组与BillrothⅡ组残胃癌临床病理特征比较
BillrothⅠ组与BillrothⅡ组两组比较的结果见表2。BillrothⅡ组的发病间隔时间(平均为22.8年)、残胃癌发生在吻合口的比例(52.4%)、肿瘤直径(平均为6.73 cm),高于BillrothⅠ组的发病间隔时间(平均为12.3年)、残胃癌位于吻合口的比例(21.1%)、肿瘤大小(平均为3.75 cm);以上各组组间差异均具有统计学意义(均P<0.05)。而残胃癌发病年龄、组织学类型、肿瘤浸润深度、淋巴结转移、TNM分期、残胃癌手术方式等组间差异均无统计学意义(P>0.05)。
2.3 生存分析
初次手术良性组与初次手术恶性组患者的生存率比较见图1,100个月累计生存率分别为37.1%和40%,差异无统计学意义(P>0.05)。不同TNM分期患者的生存率比较见图2,Ⅰ期、Ⅱ期合并为Ⅰ~Ⅱ期,80个月累积生存率Ⅰ~Ⅱ期的患者为64.7%,Ⅲ期为18.5%,差异有统计学意义(P<0.05)。按照初次手术时重建方式分为BillrothⅠ组与BillrothⅡ组(图3),患者80个月的生存率分别为BillrothⅠ组27.3%,BillrothⅡ组43.1%,差异无统计学意义(P>0.05)。
3 讨论
残胃癌是临床较为少见的疾病[5]。因胃十二指肠溃疡而接受远端胃切除术的患者,术后发生残胃癌的风险增高[4]。随着对胃癌诊断和治疗水平的提高,胃癌患者术后获得长期生存的比例增加,残胃癌的发生率也因此增加[4],越来越多的学者开始关注胃癌术后残胃癌[2,4,6]。2010年日本第14版《胃癌处理规约》中规定:无论初次诊治为何种病变,残胃发生的癌即为残胃癌,包括复发癌[7]。胃癌术后5年以下发生的残胃癌难以区分是否为复发癌,因此,本研究入组的病例是胃癌胃切除术后5年以上形成的残胃癌。
本组研究显示,残胃癌发病的平均年龄为61.2岁,不同分组之间残胃癌发病的平均年龄无明显差异。男性患者残胃癌的发病率明显高于女性,在初次手术良性组中尤其明显,男女比例为13.7∶1,与文献报道一致[1,4,8],可能与溃疡病好发于男性有关。
本组研究无论按照初次手术疾病良恶性分组,还是按照最初手术重建方式分组,残胃癌的肿瘤浸润深度、淋巴结转移情况、TNM分期均无明显差异,与文献报道相同。Komatsu等[9]分析34例残胃癌患者,按照不同的方式分组,结果表明肿瘤浸润深度、淋巴结转移情况、TNM分期的差异均无统计学意义。
初次手术良性组肿瘤直径(平均为6.9 cm)大于初次手术恶性组(平均为4.3 cm),BillrothⅡ组肿瘤直径(平均为6.73 cm)大于BillrothⅠ组(平均为3.75 cm),分析可能的原因为:①BillrothⅠ组在肿瘤较小时就容易出现梗阻等并发症,因而有助于发现肿瘤;②初次手术为胃癌的患者BillrothⅠ式重建的比例高,患者术后积极参与随访。
初次手术良性组从初次胃切除术至发现残胃癌的间隔时间(平均为24.8年)明显长于初次手术恶性组(平均为8.9年)。BillrothⅡ组的间隔时间平均为22.8年,长于BillrothⅠ组(平均为12.3年)。这一结果与Komatsu等[9]的报道相近,其研究结果表明,初次手术良性组的间隔时间为32年,初次手术恶性组的间隔时间为12年,BillrothⅡ组的间隔时间为32年,BillrothⅠ组的间隔时间为12年。
初次手术良性组残胃癌50%位于吻合口,明显高于初次手术恶性组的26.3%;按照初次手术重建方式分组,BillrothⅡ组残胃癌52.4%位于吻合口,高于BillrothⅠ组的21%;差异均具有统计学意义。而初次手术良性组重建方式BillrothⅡ式占75%,提示吻合口是BillrothⅡ式重建后残胃癌发生的最常见部位,与文献报道一致[9]。除此之外,BillrothⅡ式重建后残胃癌的发病率高于BillrothⅠ式重建[10],与BillrothⅡ式重建术后肠胃反流有关[11]。
治疗残胃癌的常用手术方式为残胃全切除术或残胃大部切除术。本研究所有病例均进行了残胃全切除术或残胃大部切除术。无论初次手术疾病是良性还是恶性,残胃癌切除术后,生存率都相似(37.1%vs 40%),提示初次手术时疾病的良恶性不影响术后生存率,这与国内外文献报道一致[12-14]。按照初次手术重建方式分组,BillrothⅡ组的患者残胃癌R0切除术后生存率有略高于BillrothⅡ组的患者的倾向,但差异无统计学意义,提示初次手术的吻合方式不影响残胃癌术后生存率。按TNM分期分组,Ⅲ期患者残胃癌术后生存率显著低于Ⅰ~Ⅱ期患者,与文献报道相同[4],提示肿瘤的不同分期对术后生存率有影响,分期越晚,术后生存率越低。
残胃癌诊断时多数患者TNM分期已较晚,与原发性胃癌相比,其切除率低、预后差[3,15,16],文献报道残胃癌的切除率为40%,明显低于原发性胃癌的切除率。残胃癌恶性程度高也与预后不良有关[6]。已有日本文献报道[4,17],随着早期残胃癌检出率的提高,残胃癌患者的5年生存率明显改善,Nonaka等[18]报道,内镜下黏膜剥离术治疗早期残胃癌的5年整体生存率为87.3%。因此,术后随访、早期发现病变对提高残胃癌患者的生存率至关重要。
[1]Tanigawa N,Nomura E,Lee SW,et al.Current state of gastric stump carcinoma in Japan:based on the results of a nationw ide survey[J].World J Surg,2010,34(7): 1540-1547.
[2]Sinning C,Schaefer N,Standop J,et al.Gastric stump carcinoma-epidemiology and current concepts in pathogenesis and treatment[J].Eur JSurg Oncol,2007,33(2): 133-139.
[3]Thorban S,Bottcher K,Etter M,et al.Prognostic factors in gastric stump carcinoma[J].Ann Surg,2000,231(2): 188-194.
[4]Tokunaga M,Sano T,Ohyama S,et al.Clinicopathological characteristics and survival difference between gastric stump carcinoma and primary upper third gastric cancer[J].JGastrointest Surg,2013,17(2):313-318.
[5]Morgagni P,Gardini A,Marrelli D,et al.Gastric stump carcinoma after distal subtotal gastrectomy for early gastric cancer:experience of 541 patients w ith long-term follow-up[J].Am J Surg,2014.http://www.ncbi.nlm.nih. gov/pubmed/?term=PM ID%3A+25218580.
[6]Ohashi M,Katai H,Fukagawa T,et al.Cancer of the gastric stump follow ing distal gastrectomy for cancer[J]. Br JSurg,2007,94(1):92-95.
[7]胡祥.第14版日本《胃癌处理规约》的重要变更[J].中国实用外科杂志.2010,30(4):241-246.
[8]An JY,Choi MG,Noh JH,et al.The outcome of patients w ith remnant primary gastric cancer compared w ith those having upper one-third gastric cancer[J].Am JSurg,2007,194(2):143-147.
[9]Komatsu S,Ichikawa D,Okamoto K,et al.Progression of remnant gastric cancer is associated w ith duration of follow-up follow ing distal gastrectomy[J].World JGastroenterol,2012,18(22):2832-2836.
[10]Moller H,Toftgaard C.Cancer occurrence in a cohort of patients surgically treated for peptic ulcer[J].Gut, 1991,32(7):740-744.
[11]Fischer AB,Graem N,Christiansen LA.Causes and clinical significance of gastritis follow ing BillrothII resection for duodenal ulcer[J].Br J Surg,1983,70(6): 322-325.
[12]Schaefer N,Sinning C,Standop J,et al.Treatment and prognosis of gastric stump carcinoma in comparison w ith primary proximal gastric cancer[J].Am J Surg, 2007,194(1):63-67.
[13]Hu X,Tian DY,Cao L,et al.Progression and prognosis of gastric stump cancer[J].JSurg Oncol,2009,100 (6):472-476.
[14]肖仕明,陈凛,彭正,等.残胃癌的治疗与预后分析[J].中国普外基础与临床杂志,2012,(12):1307-1318.
[15]Kujath P,Eckmann C,Broll R,et al.Carcinoma of the gastric stump.Diagnosis,surgical procedure and prognosis[J].Langenbecks Arch Chir,1995,380(2):108-114.
[16]周立新,张则伟,徐志远,等.残胃癌的外科治疗与预后分析[J].癌症,2009,28(5):511-514.
[17]Nishide N,Ono H,Kakushima N,et al.Clinical outcomes of endoscopic submucosal dissection for early gastric cancer in remnant stomach or gastric tube[J]. Endoscopy,2012,44(6):577-583.
[18]Nonaka S,Oda I,Makazu M,etal.Endoscopic submucosal dissection for early gastric cancer in the remnant stomach after gastrectomy[J].Gastrointest Endosc,2013, 78(1):63-72.
The clinicopathological featuresand prognosisof gastric stump carcinoma follow ing curative surgery
CUILiang1TIAN Yan-tao1ZHAO Tie-zheng2SHAO Xin-xin1XIEYi-bin1ZHAO Ping1#
1Departmentof Abdom inalSurgicalOncology,Cancer Hospital,Chinese Academy ofMedical Sciences&Peking Union MedicalCollege, Beijing 100021,China
2Huanghua City People'sHospital,Departmentof Surgery,Huanghua061100,Hebei,China
ObjectiveTo evaluate the clinicopathological features and prognosis of gastric stump carcinoma (GSC)follow ing curative surgery.MethodThe clinicopathological features and long-term survival rate of 63 patients who had underwent curative gastrectomy for GSC from November 1999 to December 2014 were analyzed retrospectively.ResultCompared w ith malignant GSC,the benign ones follow ing gastrectomy had a longer interval (24.8 years vs 8.9 years,P<0.05),bigger tumor size(6.9 cm vs 4.3 cm,P<0.05),and a higher proportion of GSC located in anastomosis(50%vs 26.3%,P<0.05).As for BillrothⅡ vs BillrothⅠ,the BillrothⅡ reconstruction group had a longer interval(22.8 years vs 12.3 years,P<0.05),bigger tumor size(6.73 cm vs 3.75 cm,P<0.05), and a higher proportion of GSC located in anastomosis(52.4%vs 21%,P<0.05).The 80-month survival rate of the stageⅢ group was significantly higher than that of the stageⅠ-Ⅱ group(64.7%vs 18.5%,P<0.05).The 100-month survival rates of benign and malignant lesions follow ing curative surgeries were sim ilar(37.1%vs 40%,P> 0.05),and the 80-month survival rates of BillrothⅡ and BillrothⅠgroups were also close(43.1%vs 27.3%,P> 0.05).ConclusionThe patients w ith GSC have different clinicopathological features as the initial diseases and the reconstruction methods vary.For patients w ith resectable GSC,long-term survival is associated w ith TNM staging, rather than the initial diseases and the reconstruction methods.
gastric stump carcinoma;clinicopathological features;prognosis
R735.2
A
10.11877/j.issn.1672-1535.2015.13.03.18
#通信作者(corresponding author),e-mail:lionheart2010@163.com
2015-03-06)
