M3受体激动剂诱导大鼠腮腺细胞内AQP5和脂质筏的核转位
2015-07-24周党侠张海峰
王 頔,秦 臻,周党侠,张海峰
(1.西安交通大学 医学部 病理学系,陕西 西安710061;2.陕西省妇幼保健院 生殖中心,陕西 西安710003)
M3受体激动剂诱导大鼠腮腺细胞内AQP5和脂质筏的核转位
王 頔1*,秦 臻1,2,周党侠1,张海峰1
(1.西安交通大学 医学部 病理学系,陕西 西安710061;2.陕西省妇幼保健院 生殖中心,陕西 西安710003)
水通道蛋白5(aquaporin, AQP5)存在于唾液腺腺泡细胞内,对调节水分转运速率和维持唾液分泌具有重要作用,AQP5功能失调会导致如增龄性口干、头面部放疗口干症、SS综合征和糖尿病口腔干燥等相关疾病的发生[1]。研究表明,M3毒蕈碱乙酰胆碱受体(M3 muscarinic acetylcholine receptor, M3-mAChR)激动剂西维美林(cevimeline)可以诱导AQP5与脂质筏(lipid raft)从胞内囊泡转移至细胞顶膜(管腔侧细胞膜),通过增加膜上蛋白的数量而快速调节对水的通透性[2]。本研究是明确M3-mAChR活化后,AQP5是否与脂质筏首先转位至细胞系。
1 材料与方法
1.1 材料:SPF级8周龄雄性Wistar大鼠,体质量180~210 g,西安交通大学医学院实验动物中心提供(合格证号:医动字第08005号)。兔抗AQP5和羊抗flotillin- 2抗体(Santa Cruz公司),兔抗GM1抗体(Calbiochem- Novabiochem公司),羊抗兔Alexa- 488、鸡抗羊Alexa- 594荧光二抗和封闭用的正常血清(北京中杉金桥生物公司)。
1.2 免疫荧光双标:大鼠随机分为6组(n=5):对照组及西维美林注射后1.5、3、6、10和60 min不同时间点处死组。经大鼠尾静脉按5.0 mg/kg注射西维美林,腮腺组织冷冻包埋。7 μm冰冻切片冷乙醇固定30 min后。分别滴加兔抗AQP5(1∶1 000稀释)和羊抗flotillin- 2(1∶500稀释)一抗,4 ℃过夜。PBS振洗后,再加入1∶500稀释的羊抗兔Alexa- 488和鸡抗羊Alexa- 594荧光二抗避光1h。50 g/L的PI孵育1 h染细胞系。无荧光缓冲甘油封片后,激光共聚焦显微镜照相分析。以PBS替代一抗作为阴性对照。
1.3 腮腺细胞细胞系的分离:大鼠尾静脉注射0.9%氯化钠注射液或者西维美林3 min后,取腮腺组织至0.32 mol/L的蔗糖缓冲液中,600 ×g离心10 min。沉淀清洗两次后悬浮,调节悬液浓度至1.89 mol/L,置于离心管2.2 mol/L蔗糖缓冲液上,75 000 ×g离心90 min,得到细胞系沉淀。
1.4 去垢剂可溶和不溶片段的制备:细胞系溶解在包括1% TX- 100的TNE缓冲液中(25 mmol/L Tris-HCl[pH 7.4],150 mmol/L NaCl, 5 mmol/L EDTA),冰上放置30 min。4 ℃ 200 000 ×g离心30 min,分离去垢剂可溶和不可溶片断。
1.5 Western印迹:细胞系和去垢剂可溶及不溶成分在12.5% SDS-PAGE凝胶中电泳,待样品分离后电转移至硝酸纤维素膜上,13 V转膜25 min。5%牛血清白蛋白封闭1 h,分别与抗AQP5和GM1抗体(1∶1 500)孵育1 h,TBST洗膜3次。二抗(1∶4 000)孵育1h后,洗膜,ECL显色。β-actin为内参照计算相对表达量。

2 结果
2.1 西维美林诱导AQP5向细胞系和细胞顶膜的运输:静息状态下,AQP5弥漫分布在胞质和细胞顶膜;西维美林注射1.5~3 min后,AQP5定位在细胞系;6~10 min后,AQP5主要定位在细胞顶膜,60 min后,AQP5在细胞顶膜的水平下降,弥散入胞质(图1)。
2.2 AQP5和脂筏运输到细胞系和细胞顶膜:静息条件下,AQP5和脂质筏的标志物脂筏结构蛋白2(flotillin2)共定位在胞质和细胞顶膜,西维美林注射3 min后,AQP5和脂筏结构蛋白2出现在细胞系内和细胞顶膜,60 min后AQP5和脂质筏从胞核消失,重新回到胞质(图2)。西维美林注射3 min后,AQP5和脂质筏的另一标志物GM1在细胞系内的水平明显上升(P<0.05)(图3A)。AQP5在无刺激条件下,主要呈现在细胞系去垢剂不溶片段内,西维美林作用后,细胞系内的AQP5在去垢剂可溶和不溶成分内均增加(P<0.05),而GM1的水平仅在去垢剂不溶的片段内增加(P<0.05)(图3B)。
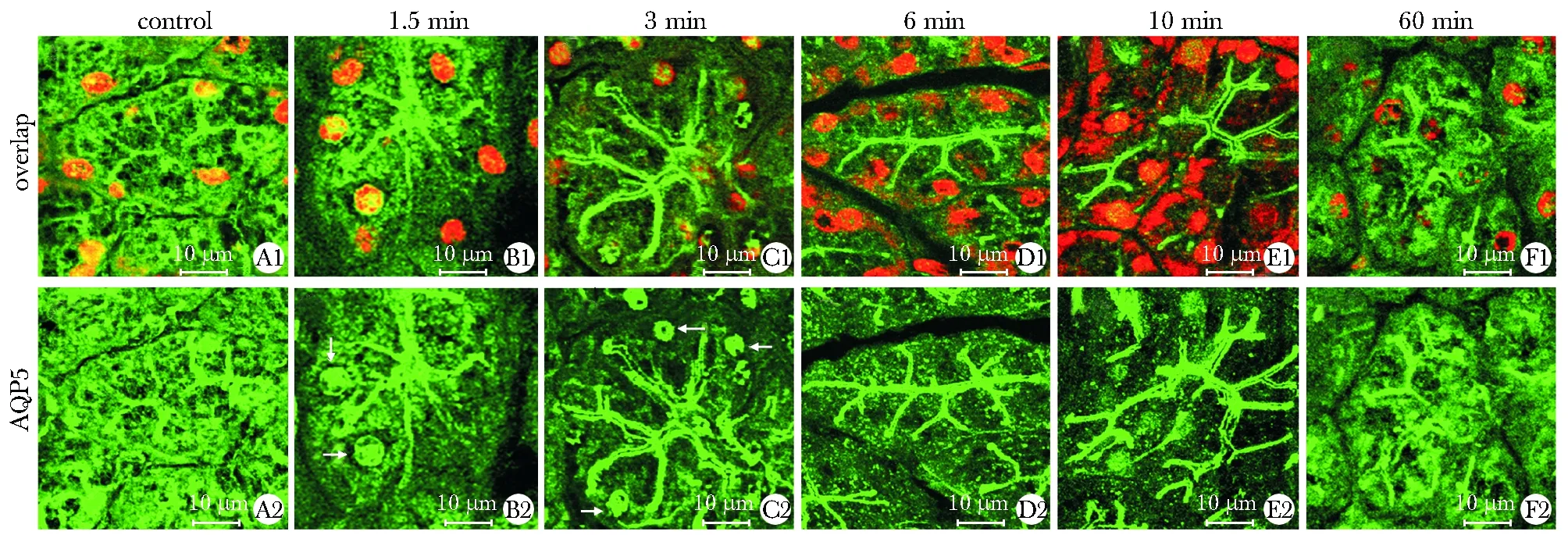
A.control group; B~F.1.5,3,6,10 and 60 min after cevimeline-injection; arrow shows AQP5 in the nuclei 图1 免疫荧光检测西维美林注射后腮腺组织内AQP5的变化
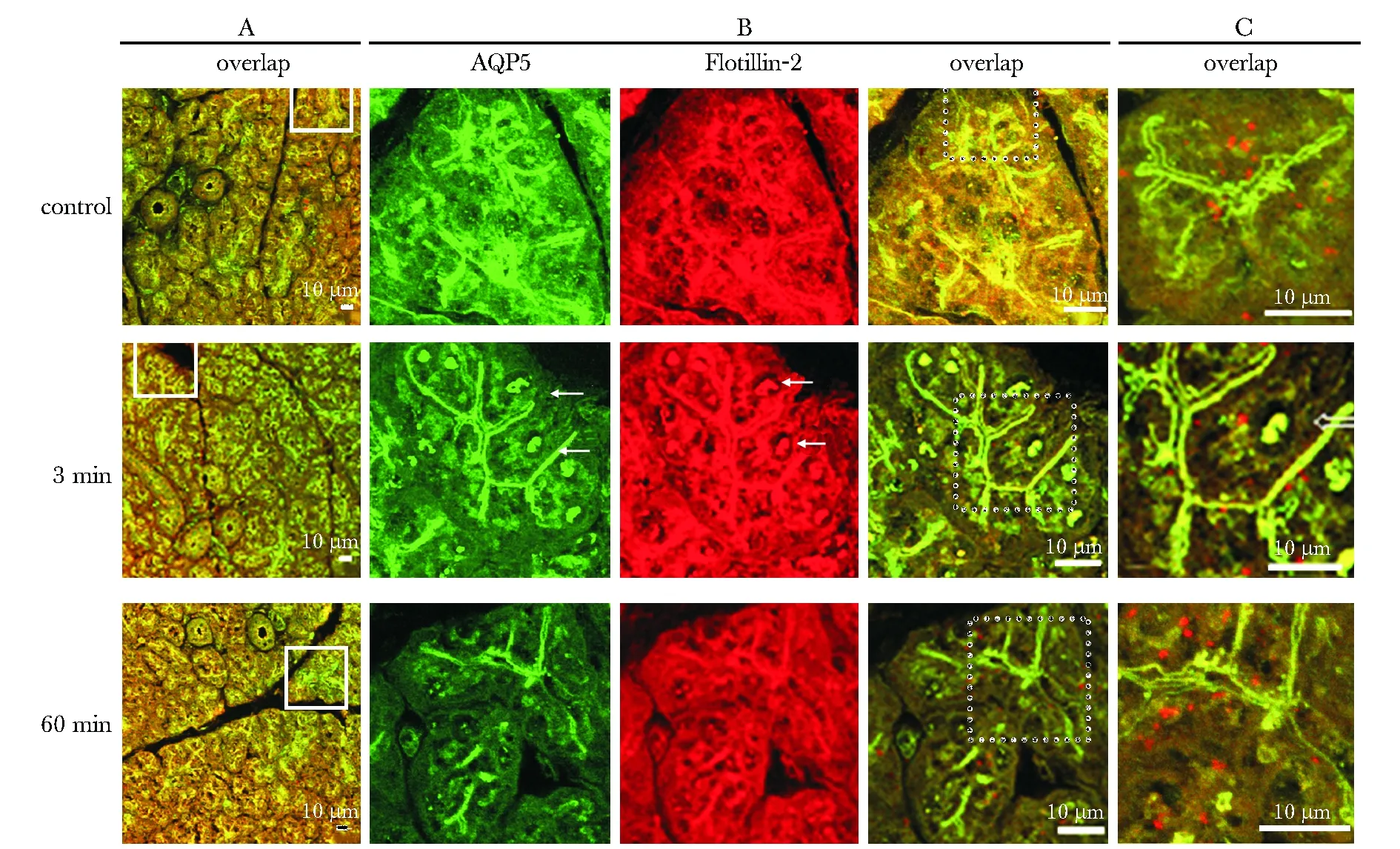
A.overlap of AQP5(Alexa- 488, green) and flotillin- 2(Alexa- 594, red); B.magnification of A; C.higher magnification of B; arrows shows AQP5 in the nuclei
3 讨论
AQP5是一种细胞膜转运蛋白,对调节水分转运速率和维持唾液分泌具有重要作用,定向的胞内转运是确保其发挥生理功能的重要调节方式。脂质筏是膜脂双层内含有特殊脂质和蛋白质的微区域,4℃时不溶于非离子去垢剂Triton X- 100,涉及信号传导,蛋白分选和运输等细胞活动。已有研究表明,西维美林可以诱导AQP5和脂质筏从胞内囊泡转移至细胞顶膜,快速调节对水的通透性[2]。
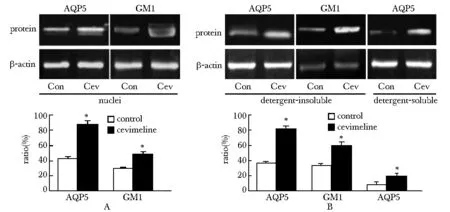
*P<0.05 compared with control group图3 AQP5和GM1在细胞系内的分布Fig 3 Distribution of AQP5 and GM1 in isolated nuclei
本研究结果显示,西维美林刺激后1.5~3 min内,AQP5出现在细胞系内,并且和脂质筏共定位,6~10 min后,转位到细胞顶膜,之后逐渐内化入胞质。说明AQP5和脂质筏在刺激状态下首先转位至细胞系,接着移动到细胞顶膜。西维美林刺激后,分离的腮腺细胞系内AQP5和脂质筏特异标志物GM1水平明显上升,且都主要出现在去垢剂不溶的片段内,去垢剂可溶片段内AQP5含量虽然在刺激后有所升高,但是明显低于不溶片段。提示AQP5主要定位于去垢剂不溶的脂质筏内,并受其调节共同从核外转移至核内。已知氯离子通道蛋白27(NCC27)出现在细胞系内,调节氯离子在核膜上的进出[3]。有关AQP5迅速转位至细胞系的作用及是否涉及细胞系内水的转运和DNA合成等过程,还有待深入研究。
[1] Delporte C. Aquaporins in salivary glands and pancreas[J]. Biochim Biophys Acta, 2014, 1840: 1524- 1532.
[2] Wang D, Yuan Z, Inoue N,etal. Abnormal subcellular localization of AQP5 and downregulated AQP5 protein in parotid glands of streptozotocin-induced diabetic rats[J]. Biochim Biophys Acta, 2011, 1810: 543- 554.
[3] Valenzuela SM, Mazzanti M, Tonini R,etal. The nuclear chloride ion channel NCC27 is involved in regulation of the cell cycle[J]. J Physiol, 2000, 529:541- 552.
2014- 05- 12
:2014- 06- 22
西安交通大学新教师科研启动经费(DWYXc111000127)
*通信作者(correspondingauthor):wangdi2011@mail.xjtu.edu.cn
1001-6325(2015)02-0237-03
R 333.1
:A
