控制混合处理水质监测废液的效能及机理
2015-07-24杨欣
杨欣
(江西金达莱环保股份有限公司,江西 南昌 330100)
水质监测实验室产生量最大的废液,是监测COD(按《水和废水监测分析方法》配制试剂)[1]、及NH3-N[2]产生的废液,此两项为常规水质指标,测试次数多,废液量大,监测一个样品分别产生约150mL、52.5mL 废液,所含的第一类污染物有汞、铬、银。汞可由呼吸、消化道及皮肤直接吸收,造成积累性中毒,损害消化、泌尿和神经系统,破坏脑组织;铬可致腹泻及过敏性皮炎或湿疹,还可刺激腐蚀呼吸道,导致咽炎、支气管炎等[3];银被摄入后在皮肤、眼睛、黏膜沉着,产生永久性蓝灰色变,大量咽下可溶性银盐甚至有呕吐、强烈胃痛、出血性胃炎等症状[1]。
一些重金属如汞在水体中经微生物作用,转化为毒性更强的有机物,在生物体内成千上万倍累积富集,再通过饮水和食物链作用于人类[4]。
水质监测实验室废液浓度高、剧毒,如处理不善将对生态环境造成严重污染,有用的贵金属也随着废液排放流失。但目前对实验室废液的处理往往是常规工艺,将废液分类,采用酸碱中和、吸附、絮凝、化学沉淀等[5-12],未针对废液自身性质深入研究。上述工艺虽削减重金属离子,但普遍存在处理加药量大、污泥量大且成分复杂等缺点。
李宝磊等[13]在pH 值为2.0 时在实验室废水中加入FeSO4和Na2S,对六价铬和汞的去除率较好,但该法在酸性条件投加硫化钠,产生硫化氢,难以实践推广。
本试验针对监测COD、NH3-N 废液自身特性,采用以废治废的思路,找出一种减少药剂投加、节约成本且又能减少污泥量、提高污泥纯度的工艺。
1 材料与方法
1.1 主要试验材料
试验原液来自某高校水质监测实验室分类收集的监测COD 废液、监测NH3-N 废液。
pH 值采用pHS-25 酸度计测定。总银、总铬皆采用TAS960 原子吸收分光光度计(量程190~900nm,准确度±0.25nm)测定,总汞用双硫腙光度法测定[1]。
1.2 物料分析与水质监测
对原液进行分析、鉴定,运用了物料分析和监测两种方法。物料分析如下:
(1)测COD 废液(以下简称废液A):银(以溶解于浓硫酸的AgSO4形式存在);铬;汞(以HgSO4、[HgCl4]2-形式存在);测定一个水样COD所产生的150mL 废液中含30mL 浓硫酸。滴定过程中,六价铬基本上被硫酸亚铁铵还原为三价铬。废液A 为绿色溶液,呈极强酸性。
(2)测NH3-N 废液(以下简称废液B,采用纳氏试剂分光光度法配制[2]):汞(以HgCl2、碘化钾汞胶体形式存在,汞皆以+2 价形态存在)。每测定一个水样的 NH3-N 所产生 52.5mL 废液含0.106mmol 汞。
废液成分的实验监测、物料分析见表1。

表1 监测COD、NH3-N 废液污染物含量
由于监测、清洗过程中稀释,废液A 的银、铬、汞监测结果和物料分析相比皆偏低,废液B 汞含量偏高,这是高含汞的纳氏试剂残液倒入废液桶的 缘故。
1.3 工艺路线及原理
按常规工艺处理,常规工艺流程见图1。本研究采用控制混合工艺(以下简称本工艺),工艺流程见图2。
废液B 中[HgI4]2-的累积生成常数lgK4高达29.83[15],仅有极微的电离作用,汞和氢氧根生成常数lgK2=21.7,加碱无法破坏碘和汞的络合,无法与之作用而产生氧化汞沉淀。废液A 则含未络合的Hg2+,废液A、B 混合使平衡向左移动,形成难溶的红色碘化汞沉淀,见式(1)。
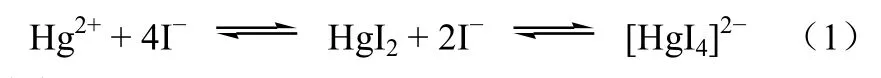
同时,废液B 中含有大量的氯、碘离子,可沉淀废液A 中的银离子,见式(2)、式(3)。

图1 常规工艺流程
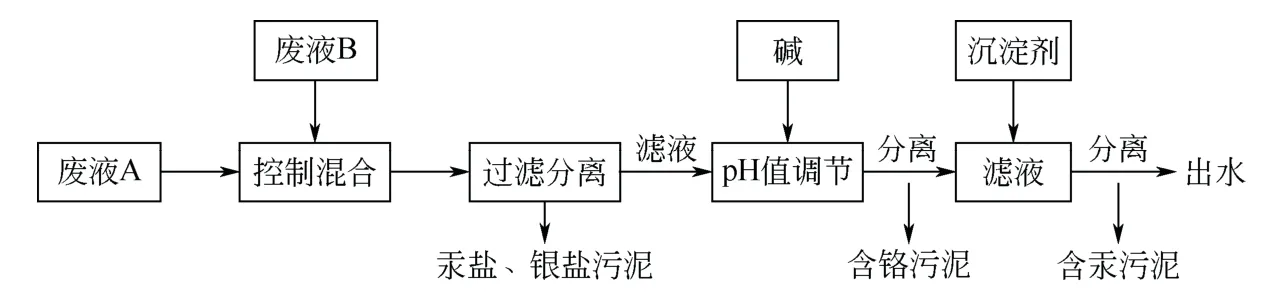
图2 控制混合工艺流程

另外,废液B 呈碱性,虽然同样体积的废液B不足以中和废液A的酸性,但可以减少碱的消耗量。总之,废液A 与废液B 在几方面性质互补。
2 结果与讨论
2.1 控制混合汞、银去除率
用废液B 处理废液A,控制体积比例,混合搅拌后,沉降20h。
废液A、B 体积比为0.05 时,上层胶体未能有效沉降,呈胶态;其他试样上层液清澈,呈浅绿色。使用0.45μm 滤膜固液分离,测定滤液汞、银含量,并用物料平衡计算去除率,见图3、图4。
当废液A 体积为废液B 的1.16 倍或1.2 倍,滤液汞含量达极小值,从 411.6mg/L 降至10.07mg/L、10.12mg/L,离这一比例越远,滤液的汞含量越高。

图3 滤液总银含量及银去除率
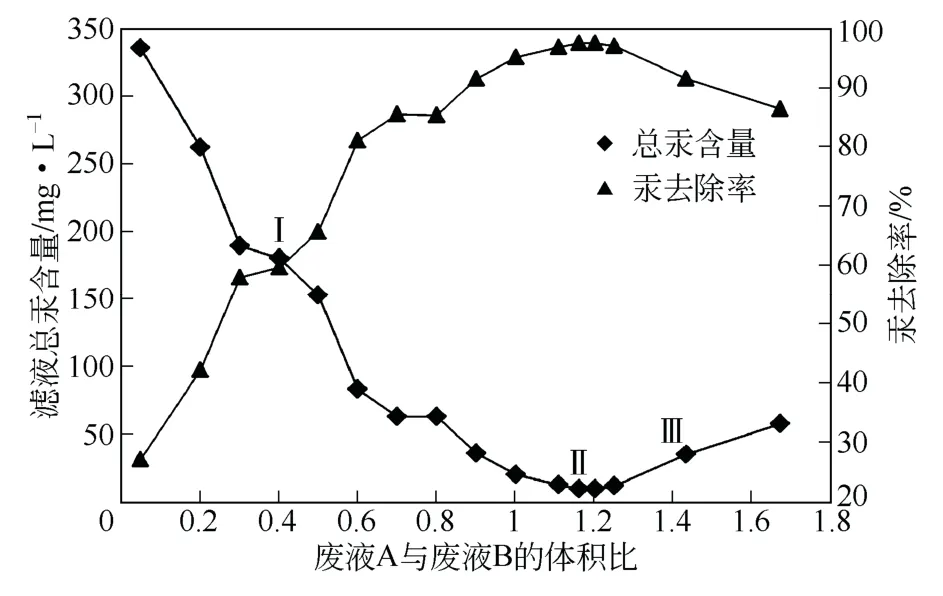
图4 滤液总汞含量及汞去除率
2.2 控制混合现象及机理分析
(1)在Ⅰ点之前,卤离子大大过量,产生较少量沉淀物。部分已络合碘游离出来,由于碘化汞(lgK2=23.82)、氯化汞(lgK2=13.22)的累积生成常数远大于碘化银(lgK1=6.58)、氯化银(lgK1= 3.04)[15], I-和新加入的Hg2+形成部分碘化汞(红色)沉淀;又和新加入的Ag+形成碘化银(黄色凝乳状)沉淀,混合沉淀呈橙红色。由于氯化汞可溶于水(溶解度6.6g/100mL,20℃),[HgCl4]2-、[HgI4]2-的累积生成常数lgK4高达15.07、29.83,滤液中汞含量远大于银。
废液A、B 体积为0.05 时,由于卤离子过量,氯化银溶解于浓盐酸或碱金属氯化物(AgCl +,滤液银含量2.79mg/L,尚未达标;滤液汞含量336.07mg/L。
(2)Ⅰ~Ⅱ点之间,随着废液A、B 体积比增大,沉淀逐渐由橙红变为橙黄色,即原液Ag+的比例逐渐加大,形成更多碘化银沉淀;由于未络合重金属的比例增加,促使[HgI4]2络合逐渐破坏,平衡左移,更多的汞、银离子与卤离子形成沉淀。
(3)直至到了Ⅱ点,碘和氯摩尔数之和,基本与汞和银摩尔数之和持平。此时,碘离子和汞结合成HgI2沉淀,其余大部分和银结合成AgI 沉淀,氯主要在AgCl 沉淀(白色凝乳状)中。HgCl2、AgCl、AgI 具有极低的溶度积pKsp=28.54、9.75、16.07[15],不仅削减了重金属,同时削减了碘、氯离子,降低盐度。
在Ⅱ点,AgCl2-、AgI2-、AgCl32-的量很低,所以上清液的银主要以Ag+形式存在。上清液的汞则主要以HgCl2形态存在,因此降低上清液汞含量,关键是降低HgCl2形态的浓度。
(4)A、B 体积比分别为1.11、1.16、1.2、1.25时,采用控制混合,分别将滤液汞含量降低到13.62mg/L、10.07mg/L、10.12 mg/L、12.65mg/L,汞去除率分别为96.9%、97.7%、97.7%、97.1%,比例范围较大,较易控制。滤液银含量分别为0.43mg/L、0.07mg/L、0.07mg/L、0.44mg/L,皆达到或优于排放标准。
(5)Ⅲ点之后,随着A、B 体积比的增大,原液重金属过量,不再有足够的沉淀剂,因此滤液汞、银的含量逐渐升高。
A、B 体积比为1.67 时,滤液汞含量58.15mg/L,汞去除率为86.5%,滤液银含量0.51mg/L,银去除率为99. 8%。
(6)废液B 中含少量氨氮,虽然AgCl 可溶于氨水,但在强酸性条件下,银氨络离子被破坏,游离Ag+重新和Cl-、I-形成沉淀。
2.3 后续处理
将上一步骤的滤液调节不同pH 值,沉降1h,上层液总铬含量最低为pH 值7.2 时;继续升高pH值,上层液总铬含量反而增加。这是由于氢氧化铬为两性氢氧化物,溶解度有一个最低值。
固液分离除去含铬污泥后,滤液中加入410mg/L 的FeSO4·7H2O,维持pH 值为中性,加入390mg/L 的Na2S·9H2O 后调节pH 值至8~8.5,沉降3h,上层液清澈。过滤后滤液汞含量为0.03mg/L,总铬含量由原水的207.5mg/L 降为1.46mg/L,去除率99.3%。
2.4 本工艺与常规工艺对比
处理监测COD 废液,使用控制混合工艺与常规工艺平行试验,加药量及成本见表2。

表2 处理1m³监测COD 废液加药量及加药成本
本方法处理1m³废液A 的同时还处理了0.86m³废液B,表2 中未计入常规工艺处理废液B 的成本,如计入则成本相差更为悬殊。
采用常规工艺,由于HgS 的溶度积(红色4× 10-53,黑色1.6×10-52)、Ag2S 的溶度积(6.3×10-50)[15]远低于AgI、AgCl、HgI2,平衡向形成硫化物沉淀的方向移动,代替卤化物沉淀,重新将卤离子释放至溶液中,并消耗大量硫化碱。
3 结 论
(1)水质监测实验室常采用重铬酸钾法、纳氏试剂法监测COD 和NH3-N,不同实验室的废液成分相近。
控制混合工艺采用以废治废的工艺思路,其设计方法是:根据原液水质成分,选取所需的控制点,使大部分汞、银离子随废液本身所含的沉淀剂去除,过滤分离后,含汞、银污泥可回收。滤液调节pH值至中性附近,固液分离,去除铬;滤液加入共沉淀剂和硫化碱,在pH 值8.0~8.5 时除去残余少量重金属离子。
由于同一实验室监测COD、NH3-N 的配方基本固定,废液集中收贮,按设计的控制点进行反应,未处理的废液留待下一批同样处理。
(2)汞的去除是本工艺关键。氯化汞可溶;[HgI4]2-仅有极微的电离作用,致OH-对废液中汞皆无沉淀作用。废液自身存在的、对于二价汞的最强沉淀剂即是I-。
在废液A(总银478mg/L;总铬207.5mg/L;总汞411.6mg/L)中加入86%、83%体积的废液B(总汞464.7mg/L),采用控制混合,分别将滤液汞含量降低至10.07mg/L、10.12 mg/L,汞去除率皆为97.7%;滤液银含量分别为0.07mg/L、0.07mg/L,银去除率皆为99.97%,沉淀充分。
(3)本工艺在较宽范围内(废液A、B 体积比0.3~1.25 倍)可使处理后TAg<0.5mg/L。其原因是氯化银、碘化银的溶解度小于氯化汞、碘化汞。
去除汞的较佳范围为:废液A、B 体积比为1.11~1.25 倍。
由于汞、银沉淀范围不同,废液A、B 体积比为0.05~0.2 时可获得含银量较高的污泥。
(4)常规工艺处理1L 废液A 加硫酸亚铁3.0g/L、硫化钠2.4 g/L, 按硫酸亚铁1.2 元/kg、硫化钠3.0 元/kg 计算,硫酸亚铁和硫化钠的费用10.8元/m³废液(用过期废碱调pH 值),干污泥量为3.28g;处理1L 测NH3-N 废液,干污泥量为1.59g。
使用本工艺同时处理1L 废液A、0.86L 废液B,加硫酸亚铁410mg/L,硫化钠390mg/L, 硫酸亚铁和硫化钠的费用1.66 元/m³废液,干污泥量为3.38g。
本工艺具有下列优势:控制混合阶段直接回收汞盐、银盐等贵金属盐,这一步骤未加入处理药剂,沉淀纯度较高。同时削减汞、银离子,其中银离子直接达到排放标准,汞离子去除率达97%以上,大大减轻后续处理负担。但沉淀颗粒较小,不易完全沉降,采用过滤分离。
控制混合工艺大幅减少加药量,污泥量少于常规工艺,充分利用了废水自身特性。另外,废液A呈强酸性,废液B 呈碱性,两者反应又可减少中和药量。本工艺处理1L 监测COD 废液的同时,还可减少约0.86L 的监测NH3-N 废液,并使废液本身含有的I-、Cl-等成为重金属沉淀剂。
[1] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 第4 版. 北京:中国环境科学出版社,2002.
[2] 环境保护部科技标准司. HJ 535—2009. 水质-氨氮的测定. 纳氏试剂分光光度法[S]. 北京:中国环境科学出版社,2009.
[3] 梅光泉. 重金属废水的危害及治理[J]. 微量元素与健康研究,2004,21(4):54-56.
[4] 许振良,张永锋. 络合-超滤-电解集成技术处理重金属废水的研究进展[J]. 膜科学与技术,2003(4):141-144.
[5] 张凯,唐红军,余全智,等. 环境监测实验室废液管理和防治措施初探[J]. 环境科学导刊,2014(6):100-103.
[6] 戴东情,李健,陈新. 实验室废液中重金属离子去除方法研究[J]. 理化检验(化学分册),2014(5):630 -633.
[7] 王宗舞,李孝坤. 浅析环境检测类实验室废液的处理技术[J]. 资源节约与环保,2013(9):108,120.
[8] 徐锦昌,蔡裕丰. 环境监测站实验室的废液管理[J]. 污染防治技术,2009(1):101-102.
[9] 张显球,杜明霞,吴薇. 实验室废液污染控制[J]. 实验技术与管理,2007(2):154-156.
[10] 张欣,梁贤军,张丽. 基于淤泥综合作用处理实验室Cr(Ⅵ)废水[J]. 化工进展,2010,29(5):944-947,962.
[11] 宋盼盼,邵玲,周金平. 环境监测实验室废水的处理及污染防治[J]. 化学分析计量,2014(3):93-95.
[12] 李增新,薛淑云,王国明,等. 开设实验室废液处理综合设计实验[J]. 实验室研究与探索,2008,27(7):105-106,156.
[13] 李宝磊,朱天菊,刘光全,等. 实验室重金属废水处理研究[J]. 环境科学与管理,2014(1):75-77.
[14] 国家环境保护局. GB8978—1996. 污水综合排放标准[S]. 北京:中国环境科学出版社,1997.
[15] Speight James G. Lange’s Handbook of Chemistry[M]. 16th ed. New York:McGRAW-Hill,2005.
