Cu2+、Cd2+、Zn2+在高炉水淬渣上的竞争吸附特性
2015-07-24王哲黄国和安春江陈莉荣刘金亮
王哲,黄国和,安春江,陈莉荣,刘金亮
(1 华北电力大学能源与环境研究院,区域能源系统优化教育部重点实验室,北京 102206;2 里贾纳大学能源、环境和可持续发展研究所,加拿大萨斯喀彻温省 里贾纳 S4S0A2;3 内蒙古科技大学能源与环境学院,内蒙古 包头 014010)
在过去的几十年中,由于重金属使用量的增加不可避免地造成其在水体环境中含量的增加,来自采矿、工业和市政废水、农业径流以及酸雨等都不同程度地引起水体中金属含量的增加[1]。重金属污染物由于有毒、不可降解、容易富集以及其他的负面效应引起了人们广泛的关注[2]。铜、镉、锌是3种常见的重金属污染物,其中铜和锌是人类、植物以及其他动物生长不可缺少的微量元素,但是如果摄入量超过标准,则会有一些负面的影响[3-4]。镉不是动植物生长必需的元素,在浓度极低的情况下也会对人体健康形成威胁[5]。因此,有必要对水体中这些金属离子进行处理。目前,常见的处理重金属离子的方法有吸附、化学沉降、离子交换以及膜过滤等方法。其中吸附法由于去除效率高以及具有较强的可操作性成为研究的热点[6],这也鼓励人们使用各种低成本吸附剂净化重金属污染的水体。
高炉渣是在冶炼生铁的时候从高炉中排出的一种工业固体废弃物,当高炉炉温达到1400~1600℃的时候,炉料开始熔融,矿石中焦炭、脉石的灰分和助熔剂以及其他杂质会形成以硅酸盐和铝酸盐为主的熔渣,当用大量的水把这些熔渣淬冷后,就会形成以玻璃体为主的细粒水渣,这就是高炉水淬渣(WBFS)[7]。高炉水淬渣主要由CaO、SiO2、Al2O3、MgO 以及 Fe2O3组成,表面具有粗糙、疏松和多孔的特性,这主要是由于高炉渣在水淬急冷条件下不易使矿物结晶,因而形成大量具有较高潜在活性的无定形活性玻璃结构或网络结构,不存在规则的晶体结构[8]。以上这些特性说明高炉水淬渣这种工业固体废弃物可以作为一种吸附剂用于重金属废水的处理。
纵观国内外的文献,人们已经开展了利用高炉水淬渣吸附铅、铜和镍的研究[9-10]。但是在实际水体环境中,往往重金属离子不是单独存在,而是很多种重金属离子同时存在形成一个复合的系统[11],因此不同重金属离子在高炉水淬渣表面的竞争吸附机制非常复杂,目前尚未有人报道过。本研究以高炉水淬渣为材料,研究Cu2+、Cd2+、 Zn2+在其上的单组分以及竞争吸附等温线和吸附动力学,探讨Cu2+、Cd2+、 Zn2+共存时的竞争吸附机制,这一研究将为高炉水淬渣用于重金属废水处理提供理论 基础。
1 材料与方法
1.1 实验材料
实验所用高炉水淬渣取自内蒙古包头钢铁集团炼铁厂。实验前首先将渣用去离子水冲洗干净以去除表面的杂质,在100~105℃下干燥24h,然后将其粉碎,过100 目分样筛,装入聚乙烯塑料袋自封袋中备用。高炉水淬渣的化学组成成分中,CaO 质量分数为33.60%,SiO2质量分数为32.99%,Al2O3质量分数为12.46%,MgO 质量分数为10.45%,Fe2O3质量分数为0.86%。比表面积为3.83m2/g,密度2.71g/cm3,松散容重为1200~1400kg/m3。矿物组 成 主 要 有 Ca3(Si3O9) 、 (Ca,Na)2(Al,Mg,Fe2+) [(Al,Si)SiO7]、MgAl2O4以及(Mg,Fe)2[SiO4]。
1.2 化学试剂
将Cu(NO3)2·3H2O、Cd(NO3)2·4H2O 和Zn(NO3)2· 6H2O(均为分析纯)溶解于去离子水中,配成20~300mg/L 的溶液。
1.3 实验仪器
电感耦合等离子体质谱分析仪(ICP-MS,P-5000,日本Hitachi 公司),比表面积测定仪(SA 3000,美国Beckman Coulter 公司),原子吸收分光光度计(AA-6300C,日本 SHIMADZU 公司),数显鼓风干燥箱(GZX-9140MBE,中国),密封式制样粉碎机(GJ-3,中国),回旋振荡器(HY-B2,中国),水浴恒温振荡器(SHA-BA,中国)。
1.4 吸附实验方法
1.4.1 吸附等温实验
准确称取1.5g预处理后的高炉水淬渣放入带有封口膜的250mL 锥形瓶中,在每个锥形瓶中加入Cu2+、Cd2+、Zn2+初始浓度分别为20mg/L、40mg/L、60mg/L、80mg/L、100mg/L、150mg/L、200mg/L、300mg/L,在每一个水淬渣试样中加入单一、相同浓度的2 种重金属离子及相同浓度3 种重金属离子溶液50mL,并在pH 值为7(前期的单因素实验结果表明3 种重金属离子的去除率和吸附量在pH 值为1~7 的范围内迅速增加,当pH 值>7 以后趋于平缓,因此选择pH 值为7)、温度25℃条件下在恒温水浴振荡器上以120r/min 的转速反应100min。
1.4.2 吸附动力学实验
将1.5g 高炉水淬渣加入100mg/L 的Cu2+、Cd2+、Zn2+单一、相同浓度的2 种重金属离子及相同浓度3 种重金属离子溶液50mL 中,在pH 值为7、温度25℃条件下,以120r/min 的转速反应0~200min。
所有样品上清液均通过滤纸过滤,滤液采用火焰原子吸收分光光度法测定水样中的Cu2+、Cd2+、Zn2+的浓度。每个实验做3 个平行样并配备空白实验,下文中所有实验结果都是除去空白实验之后的数值。吸附量(Qt)由式(1)进行计算。
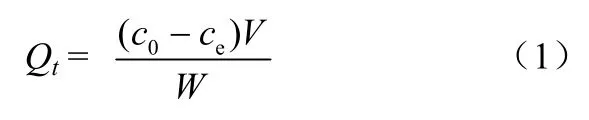
式中,Qt为t 时刻的吸附量,mg/g; c0和ce分别为溶液初始浓度和平衡浓度,mg/L;V 是废水体积,mL;W 为吸附剂质量,g。
1.5 吸附理论
1.5.1 吸附等温模型[式(2)~式(7)]
Langmuir 吸附等温模型
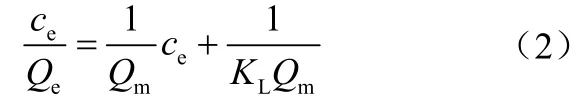
Freundlich 吸附等温模型
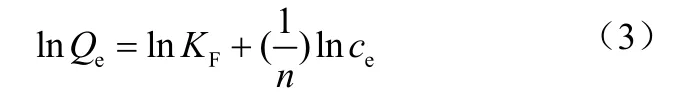
Tempkin 吸附等温模型

Dubinin-Radushkevich(D-R)吸附等温模型
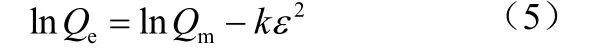
其中
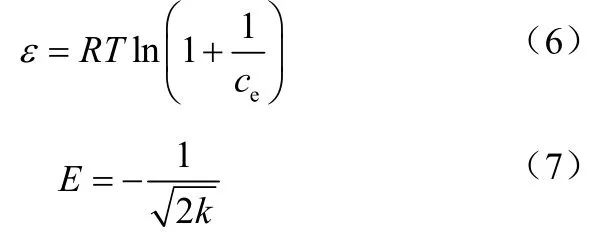
式中,Qe为吸附平衡时的吸附量,mg/g;Qm为最大吸附量,mg/g;ce为吸附平衡时的浓度,mg/L;KL为Langmuir 吸附常数,L/mg;KF(mg/g) 和n 是Freundlich 模型常数;A 和B 均为Tempkin 吸附模型常数;k 是与吸附能量相关的常数;ε 是Polanyi 吸附势;R 是气体常数,8.314 J/(mol·K);T 是绝对温度,K;E 是平均自由吸附能,当<8kJ/mol 时属于物理吸附,当8<<16kJ/mol时属于离子交换,当时属于化学吸附。
1.5.2 吸附动力学模型[式(8)、式(9)]
伪一级动力学(Pseudo-first-order)模型
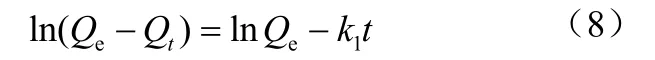
伪二级动力学(Pseudo-second-order)模型

式中,k1为伪一级速率常数,min-1;Qt和Qe分别为金属离子在t 时刻和平衡时的吸附量,mg/g;k2是伪二级速率常数,g/(mg·min);此外,初始吸附速率h[mg/(g·min)] =k2Qe2。
2 结果与分析
2.1 单一组分与多组分竞争吸附等温线
图1 所示为Cu2+、Cd2+、Zn2+在二元、三元系统中的单一与竞争吸附等温线,根据吸附等温曲线对各个重金属离子在有竞争离子存在时的吸附特性进行分析。由图1(a)可以观察作为对照的各离子在单组分体系中的吸附行为。可以看出,在初始阶段吸附量迅速增大,曲线向纵轴方向高度凸起,然后随着溶液平衡浓度的增加,曲线逐渐变得平缓,并随着离子浓度的增加而增加,这是因为金属离子初始浓度越高,浓差推动力越大,高炉水淬渣与金属离子之间的吸附作用增强,因此,吸附量随之增 大[12]。根据Giles 等[13]对吸附等温曲线的分类,可将它归类为典型的“H”形等温线,即吸附质对吸附剂具有极大的亲和力,即使吸附质溶液浓度极低,吸附剂也能将其大量吸附。加入竞争离子后,只有Cu2+的吸附等温线虽然较单组分时下降了,但基本还是维持原来的形状,而Cd2+、Zn2+无论在二元还是三元系统中,吸附等温线的形状与任何传统的吸附等温线都不相同,这种现象主要是由于Cu2+、Cd2+、Zn2+在高炉水淬渣上竞争吸附位点,彼此对抗作用引起的[14]。
在Cu2++Cd2+系统中,单组分吸附能力表现为Cu2+>Cd2+,竞争吸附时,吸附量的次序和单组分具有相同的规律,说明Cu2+与高炉水淬渣的亲和力比Cd2+大。由于Cu2+的吸附能力比Cd2+强,随着Cu2+浓度的增加,能将部分已经吸附在高炉水淬渣上的Cd2+解吸到溶液中,从而降低了Cd2+的吸附。此外,由于这两种离子共存时会共同竞争高炉水淬渣上的吸附位点,从而导致Cu2+和Cd2+二元系统中的吸附量都比单组分的吸附量降低了。在Cu2++Zn2+系统中,吸附能力表现规律与Cu2++Cd2+系统的相似。在Cd2++Zn2+系统中,单独吸附时,高炉水淬渣对Cd2+的吸附量大于Zn2+的吸附量,说明吸附剂对Cd2+的吸附亲和性比Zn2+更强。在二元系统中,Cd2+和Zn2+的吸附量均下降较多,在低浓度区域,Zn2+的吸附量高于Cd2+的吸附量,而在高浓度区域,表现规律则相反。在Cu2++Cd2++Zn2+的系统中,单一组分吸附时,高炉水淬渣对Cu2+的吸附明显高于其他2 种离子,顺序为Cu2+>Cd2+>Zn2+,混合溶液中,各离子吸附量均明显下降,其中Cd2+和Zn2+的下降较为明显。一般情况下,在离子浓度较低的时候,由于吸附位点相对较为富裕,所以各离子吸附量下降不会太多[15],但是在本研究中Cd2+和Zn2+却没有体现这一规律。
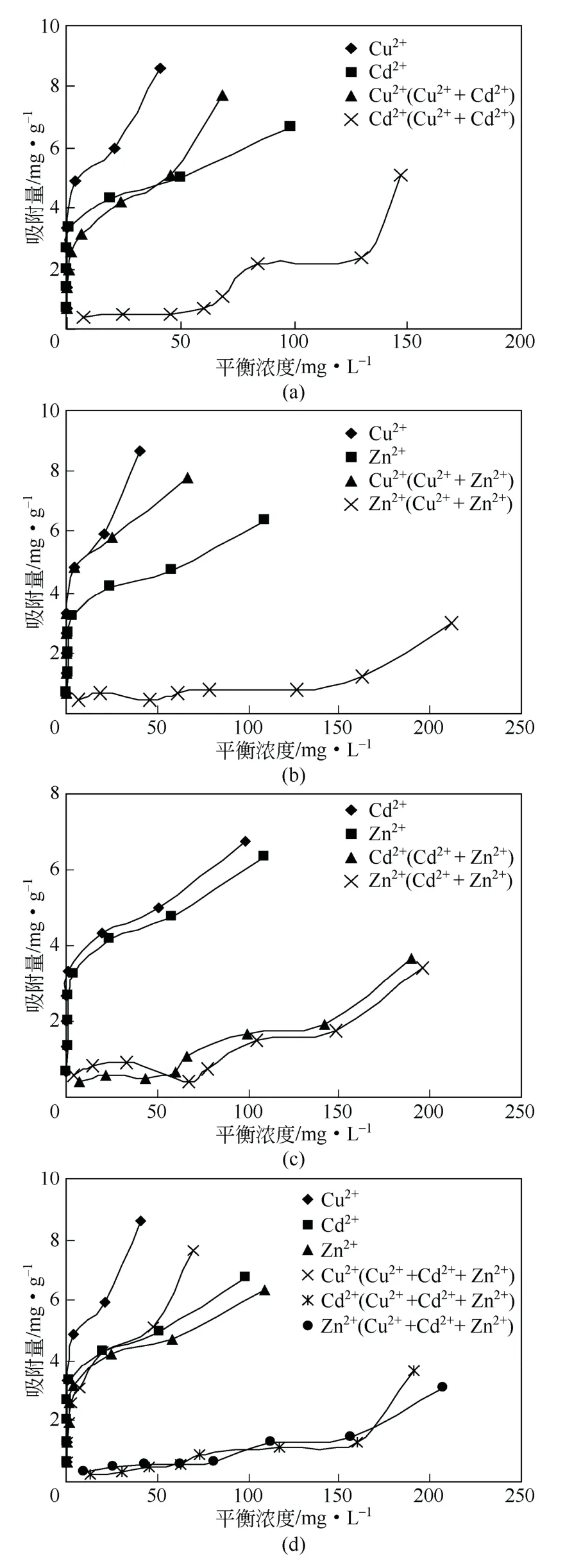
图1 各系统中重金属离子在高炉水淬渣上的吸附等温曲线
2.2 单一组分与多组分竞争吸附等温模型
将实验数据按Langmuir、Freundlich、D-R 以及Tempkin 等温吸附模型进行拟合,得到的模型参数见表1。由表1 可见,单一组分吸附时,从相关系数来看,Langmuir 吸附等温模型(0.9726< R2< 0.9822)能更好地拟合实验数据,表明Cu2+、Cd2+、Zn2+在高炉水淬渣上的吸附主要为单分子层吸附。这一结论与很多人的研究结果一致[16-17]。KL是Langmuir 常数,值越大表明吸附剂与重金属离子的结合能力越大[18],这3 种金属离子KL值大小顺序为Cu2+> Cd2+> Zn2+,表明高炉水淬渣与Cu2+结合能力最强,然后依次是Cd2+和 Zn2+。Cu2+、Cd2+、Zn2+理论最大吸附量分别为8.15mg/g、6.39mg/g 和6.10mg/g。Freundlich 方程中,n 值可以反映吸附强度,如果1<n<10,表示是一个有利吸附[19]。从表1可以看出,单组分时Cu2+、Cd2+、Zn2+在高炉水淬渣上的吸附均为有利吸附。对于D-R 模型,Cu2+、Cd2+、Zn2+理论最大吸附量分别为 16.07mg/g、10.83mg/g 和10.60mg/g,这与实验得到的值存在一定的差异,这是因为D-R 模型假设的是一种吸附剂孔隙中完全被溶质填充的理想状态。吸附能量E 分别为-15.81kJ/mol、-17.15kJ/mol 以及-15.08kJ/mol。Cu2+和Zn2+的均位于8 到16kJ/mol 之间,表明高炉水淬渣对Cu2+和Zn2+的吸附机制以离子交换为主,而Cd2+的>16kJ/mol,属于化学吸附。Tempkin模型适用于吸附热是随表面覆盖度变化而线性下降的化学吸附,从相关系数 (0.9144<R2<0.9378) 来看,3 种离子的吸附比较适合该等温式。
用等温吸附模型对有竞争离子存在时的Cu2+、Cd2+、Zn2+在高炉水淬渣上的吸附实验结果进行拟合,结果发现Cu2+(Cu2++Cd2+)、Cu2+(Cu2++Zn2+)、Cu2+(Cu2++Cd2++Zn2+) 系统中 Cu2+的吸附在与Langmuir 吸附等温模型相符的同时也比较符合Freundlich 模型,说明在竞争条件下,Cu2+的吸附在单分子层的化学吸附上还存在多分子层的物理化学吸附。Cu2+的最大吸附容量Qm从大到小依次为Cu2+(Cu2++Zn2+) 7.73mg/g >Cu2+(Cu2++Cd2++Zn2+) 7.09mg/g>Cu2+(Cu2++Cd2+) 7.01mg/g。其余各组系统中Cd2+和Zn2+的吸附量在20~300mg/L 的范围内没有出现饱和的趋势,也不符合Langmuir 吸附等温模型,但在20~80mg/L 的低浓度范围内,Cd2+和Zn2+的Langmuir 吸附相关系数则相对较高,说明在低浓度区范围内,吸附剂表面比较均质,金属离子之间还没有形成相互竞争作用,而主要表现为重金属与高炉水淬渣之间直接作用。总体来讲,当有竞争离子存在时,高炉水淬渣对Cd2+和Zn2+的吸附相对Cu2+的吸附更为复杂,用现有常见的等温吸附模型无法很好地拟合等温吸附过程。

表1 不同重金属离子的吸附参数
2.3 单一组分与多组分竞争吸附动力学曲线
反应时间对重金属离子的吸附效果有重要影响,因此为研究接触时间对Cu2+、Cd2+、Zn2+在一元、二元、三元系统中的吸附影响进行了吸附动力学实验,结果见图2。由图2(d)可知,对单一体系来说,随着吸附时间的增大,Cu2+、Cd2+、Zn2+的吸附量也随着快速增大,此阶段主要是一种表面作用,约100min 后,表面吸附的离子向水淬渣内部进一步深层扩散,进入慢速阶段,废液中各个重金属离子的吸附量逐渐趋于平稳,最终达到吸附平衡。这是因为初始阶段,高炉水淬渣表面的活性位点较多,浓度梯度较大,传质的推动力也相应较大,随着时间的延长,重金属浓度变小,传质推动力相应变小,因此吸附反应趋于缓慢[20]。在Cu2+-Cd2+系统中,高炉渣对Cu2+的单组分和竞争吸附平衡时间基本一致,而Cd2+在竞争条件下吸附平衡时间比单组分时的吸附平衡时间(100min)延长了,说明Cu2+的存在使高炉水淬渣与Cd2+的反应时间变长,延缓了Cd2+达到平衡的时间。在Cu2+-Zn2+系统中,Cu2+和Zn2+在单组分和竞争条件下的吸附平衡时间没有太大的变化。在Cd2+-Zn2+系统中,Cd2+在竞争条件下和单组分时的吸附平衡时间没有太大差异,而Zn2+在竞争条件下吸附平衡时间反而缩短了。在Cu2+-Cd2+-Zn2+的系统中,Cu2+和Cd2+在单组分和三元竞争条件下吸附平衡时间差别很小,只有Zn2+在竞争条件下比单组分时吸附平衡时间缩短。
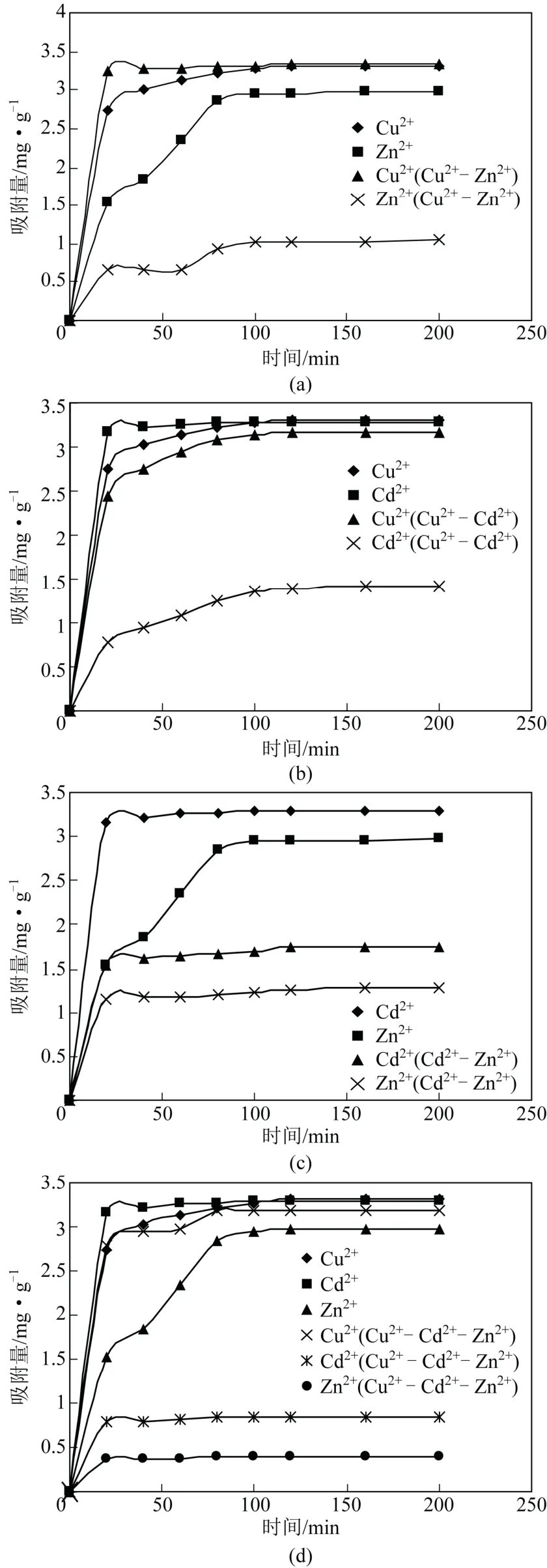
图2 各系统中重金属离子在高炉水淬渣上的吸附动力学 曲线
在Cu2+-Cd2+系统中,单组分时Cu2+在100min以内吸附量低于Cd2+,但100min 以后,Cu2+的吸附量反而略高于Cd2+。竞争条件下,Cu2+和Cd2+的吸附量都比单组分的吸附量降低了,Cd2+的吸附量降低的幅度更大,吸附能力表现为Cu2+>Cd2+。在Cu2+-Zn2+系统中,Zn2+的存在反而促进了Cu2+在高炉水淬渣上的吸附,使Cu2+的吸附量比单组分时增大了,Zn2+的吸附量在竞争条件下比单组分时下降较多。在Cd2+-Zn2+系统中,竞争条件下Cd2+和Zn2+的吸附量均比单组分时有所下降,吸附能力在两种条件下均表现为Cd2+>Zn2+。在Cu2+-Cd2+-Zn2+的系统中,各重金属离子在三元竞争条件下吸附量均呈下降趋势,100min 后,无论是单组分还是竞争条件下,吸附量的顺序均为Cu2+>Cd2+>Zn2+,这与吸附等温线所反映出的规律一致。
很多研究者认为竞争吸附时重金属离子的选择顺序与其自身的性质有关,现将文中涉及的3 种重金属离子的基本理化性质总结于表2[21]。对于一般二价金属,由于半径不同,产生优先选择吸附的顺序是Cu2+(73)>Zn2+(74)>Cd2+(95)[22]。电负性是决定重金属离子吸附顺序的重要参数,电负性越大的金属与吸附剂表面或内部氧原子结合形成共价键越强,也就越容易被吸附[23],因此按照电负性预测选择吸附的顺序为Cu2+>Cd2+>Zn2+。专性吸附与离子的水解能力有关,一般吸附亲和力的大小随水解常数的负对数pK1的增大而减小[24],其顺序为Cu2+(7.34)>Zn2+(8.96)>Cd2+(9.20)。高炉水淬渣的玻璃体由网架形成体和网架改性体组成。网架形成体主要由SiO42-组成,网架改性体主要由Ca2+组成,而水淬渣中的的A13+和Mg2+不仅是网架的形成体,而且又是网架的改性体,这种硅氧四面体网络结构是矿渣具有潜在活性的原因[25]。同时,吸附剂层电荷主要分布在四面体中,对层间阳离子的库伦引力较弱。因此,溶液中的金属离子容易和层间的阳离子进行离子交换反应[26]。对于相同价态的阳离子,吸附能力很大程度上取决于水合离子半径,水合半径越小,越容易和高炉水淬渣中的阳离子发生离子交换反应,由于水合离子半径顺序为 Cu2+(0.419)>Cd2+(0.426)>Zn2+(0.430),因此,对Cu2+的吸附能力最强,而对Cd2+和Zn2+的吸附能力弱些。在仅有静电力引起的吸附过程,荷径比越大键能越强,重金属选择顺序为Cu2+>Cd2+>Zn2+。本研究结果表明,高炉水淬渣对Cu2+、Cd2+、Zn2+的吸附具有一定的选择性,吸附过程符合重金属离子电负性、水合离子半径及荷径比的排列顺序。

表2 重金属的基本物理化学特性参数[21]
2.4 单一组分与多组分竞争吸附动力学模型
目前大量的研究都在广泛使用伪一级动力学模型和伪二级动力学模型来解释实验结果,预测反应达到平衡状态速率的快慢,并进一步揭示反应的机理。对Cu2+、Cd2+、Zn2+在高炉水淬渣上的吸附动力学过程用伪一级和伪二级动力学模型进行拟合,结果见表3。由表3 可知,无论是单组分还是竞争条件下,伪二级动力学方程的相关系数都较伪一级动力学方程的高,而且计算得到Qe,cal也更接近实验中测得的Qe,exp。这是因为伪二级动力学方程与伪一级动力学方程相比在作图拟合过程中不需要先测得平衡吸附量,这样可以减少误差。此外伪二级动力学方程包含了外部液膜扩散、表面吸附以及颗粒内扩散等吸附的全部过程,因此伪二级动力学方程能够更为真实地反映Cu2+、Cd2+、Zn2+在高炉水淬渣上的吸附机理。因为伪二级动力学方程认为影响吸附的主要因素是化学键的形成,所以认为高炉水淬渣对重金属离子的吸附以化学吸附为主。根据D-R等温模型拟合结果可知,Cu2+和Zn2+是以化学吸附中的离子交换为主。化学吸附主要是由于高炉水淬渣存在大量的硅和铝等活性点,能通过化学链与金属离子之间发生结合。此外,虽然高炉水淬渣表面疏松多孔,但由于比表面积相对较小,因此物理吸附不占据主导,化学吸附体现出来的优势更大。
单组分和竞争条件下,Qe,exp和Qe,cal吸附量大小均为Cu2+>Cd2+>Zn2+,此外除了Cu2+(Cu2+-Zn2+)的Qe,exp值(3.34)略高于单组分Cu2+的Qe,exp值(3.32),从而表现出协同吸附以外,其余系统中各离子在共存条件下的吸附量均低于单组分时的吸附量,表现出竞争吸附。单组分时,伪二级动力学模型计算出的初始吸附速率h 和伪二级速率常数K2值均为Cd2+>Cu2+>Zn2+,表明Cd2+的吸附速率快于Cu2+和Zn2+,这与动力学曲线所反映出的规律一致。对于竞争吸附体系,Cu2+(Cu2+-Zn2+)、Zn2+(Cd2+-Zn2+)及Cu2+(Cu2+-Cd2+-Zn2+) 的h 和K2值均高于单组分的值,而 Cu2+(Cu2+-Cd2+) 、Cd2+(Cu2+-Cd2+)及Cd2+(Cd2+-Zn2+)的h 和K2值均低于单组分的值,说明混合离子的存在都不同程度地影响Cu2+、Cd2+、Zn2+在高炉水淬渣上的吸附速率,这主要是因为金属离子之间的竞争效应使得吸附速率发生了改变。
3 结 论
本研究以高炉水淬渣为吸附剂,开展了3 种重金属离子Cu2+、Cd2+、Zn2+的吸附去除效果研究,重点讨论了竞争条件下金属离子之间的相互影响,得出如下结论。

表3 各重金属离子在高炉水淬渣上的动力学参数
(1)单组分体系中,各金属离子的吸附等温线为典型的“H”形等温线,加入竞争离子后,除Cu2+的吸附等温线基本还是维持原来的形状以外,其余各离子的吸附等温线都不符合传统等温线形状。单一组分吸附时,高炉水淬渣吸附的顺序为Cu2+>Cd2+>Zn2+,混合溶液中,各金属离子的吸附量都比单组分的吸附量降低了。
(2)单一组分吸附时,Langmuir 吸附等温模型能更好地拟合实验数据,表明Cu2+、Cd2+、Zn2+在高炉水淬渣上的吸附主要为单分子层的吸附。当有竞争离子存在时,Cu2+的吸附与 Langmuir 和Freundlich 吸附等温模型均比较相符,而Cd2+和Zn2+的吸附用现有等温吸附模型无法很好地拟合等温吸附过程。
(3)单一体系中,3 种金属离子的动力学曲线均为先是一个快速阶段,然后进入慢速阶段。竞争条 件 下, Cd2+(Cu2+-Cd2+) 、 Zn2+(Cd2+-Zn2+) 及Zn2+(Cu2+-Cd2+-Zn2+)的吸附平衡时间发生了改变。
(4)无论是单组分还是竞争条件下,伪二级动力学方程拟合结果较好。
[1] Ortiz N,Pires M A F,Bressiani J C. Use of steel converter slag as nickel adsorber to wastewater treatment[J]. Waste Management,2001,21:631-635.
[2] Kim D H,Shin M C,Choi H D,et al. Removal mechanism of copper using steel-making slag : Adsorption and precipitation[J]. Desalination,2008,223(1-3):283-289.
[3] 王玉军,周东美,孙瑞娟,等. 土壤中铜、铅离子的竞争吸附动力学[J]. 中国环境科学,2006,26(5):555-559.
[4] 洪英,钟泽辉,郭宾. 壳聚糖印迹聚合物对Zn2+的吸附动力学[J]. 化工进展,2011,30(6):1296-1301.
[5] Cutillas-Barreiro L,Ansias-Manso L,Fernandez-Calvino D,Arias-Estevez M,et al. Pine bark as bio-adsorbent for Cd,Cu,Ni,Pb and Zn:Batch-type and stirred flow chamber experiments[J].Journal of Environmental Management,2014,144:258-264.
[6] Duan J M,Su B. Removal characteristics of Cd(Ⅱ) from acidic aqueous solution by modified steel-making slag[J]. Chemical Engineering Journal,2014,246:160-167.
[7] 许鹏举,岳钦艳,张艳娜,等. PDMAAAC 改性高炉渣处理印染废水的研究[J]. 工业水处理,2006,26(5):57-59.
[8] 赵靓洁,刘鸣达,王耀晶. 高炉渣吸附废水中的铅[J]. 环境工程学报,2010,4(7):1473-1477.
[9] Dimitrova S V. Use of granular slag columns for lead removal[J]. Water Res.,2002,36:4001-4010.
[10] Pan S C,Lin C C,Tseng D H. Reusing sewage sludge ash as adsorbent for copper removal from waste water[J]. Resources Conservat Recycling,2003,39:79-87.
[11] 刘晶晶,唐晓武,王艳. Pb(Ⅱ)、Cu(Ⅱ)、Cd(Ⅱ)在黄土上二元竞争吸附特性研究[J]. 岩土工程学报,2014,36(2):327-333.
[12] 周利明,金解云,王一平,等. Cd2+和Ni2+在粉煤灰上的吸附特性[J]. 燃料化学学报,2008,36(5):557-562.
[13] Giles C H,Smith D,Huitson A. A general treatment and classification of the solute sorption isotherms. Ⅰ. Theoretical[J]. Journal of Colloid and Interface Science,1974,47(3):755-765.
[14] 朱丽珺,张金池,姜姜,等. 膨润土对Cu2+的吸附及其它金属离子对Cu2+的竞争吸附[J]. 环境科学与管理,2008,33(12):26-29.
[15] 张金池,姜姜,朱丽珺,等. 黏土矿物中重金属离子的吸附规律及竞争吸附[J]. 生态学报,2007,27(9):3811-3819.
[16] Zhang H,Zhao D,Chen L,et al. Investigation of Cu(Ⅱ) adsorption from aqueous solutions by NKF-6 zeolite[J]. Water. Sci. Technol.,2011,63:395-402.
[17] Sljivic M,Smiciklas I,Pejanovic S,et al. Comparative study of Cu2+adsorption on a zeolite,a clay and a diatomite from Serbia[J]. Appl. Clay Sci.,2009,43:33-40.
[18] Mishra P C,Patel R K. Removal of lead and zinc ions from water by low cost adsorbents[J]. J. Hazard. Mater.,2009,168:319-325.
[19] Wang Yan,Tang Xiaowu,Chen Yunmin,et al. Adsorption behavior and mechanism of Cd(Ⅱ) on loess soil from China[J]. J. Hazard. Mater.,2009,172 :30-37.
[20] 胡文华,吴慧芳,徐明,等. 聚合氯化铝污泥对磷的吸附动力学及热力学[J]. 环境工程学报,2011,5(10):2287-2292.
[21] 王艳. 黄土对典型重金属离子吸附解吸特性及机理研究[D]. 杭州:浙江大学,2012.
[22] 许秀云,蔡玉曼. 改性沸石对重金属离子竞争吸附特性研究[J]. 地质学刊,2010,34(1):92-97.
[23] McBride M B. Environmental Chemistry of Soils[M]. New York:Oxford University Press,1994.
[24] 林青,徐绍辉. 土壤中重金属离子竞争吸附的研究进展[J]. 土壤,2008,40(5):706-711.
[25] 许鹏举. PDMDAAC 改性高炉渣及其性能和应用研究[D]. 济南:山东大学,2006.
[26] 刘盛余,马少健,高谨,等. 钢渣吸附剂吸附机理的研究[J]. 环境工程学报,2008,2(1):115-119.
