负载盐酸阿霉素交联透明质酸的缓释性能
2015-07-24孙小强刘扬陈亮何浩明李正义
孙小强,刘扬,陈亮,何浩明,李正义
(1 常州大学石油化工学院,江苏 常州 213164;2 常州药物研究所有限公司,江苏 常州 213164)
透明质酸(HA),又称玻尿酸,是一种由两个双糖单位(1-β-3)葡糖醛酸及(1-β-3)N-乙酰基-D-氨基葡糖重复连接而成的链状多糖类生物高分子聚合物[1],其相对分子质量可达数百万。HA 因其独特的分子结构、理化性质和生物相容性,已广泛应用于临床医学领域,如润滑关节、调节血管壁的通透性、调节蛋白质、水电解质扩散及运转、促进创伤愈合等[2-6]。研究表明,许多肿瘤和癌细胞表面上存在大量透明质酸受体CD44 和RHAMM[7-8],因此HA 可作为抗肿瘤药物的靶向载体,应用于生物医药领 域[8-11]。先将药物分子通过物理吸附、包裹或化学修饰的方法负载于HA,再通过HA 的靶向作用直达病灶,最后通过HA 的降解释放药物。一方面,可针对肿瘤细胞释放抗癌药物,提高药物的利用率,增大疗效;另一方面,可避免或降低药物对其他非癌细胞的毒副作用[12]。但天然的HA 在人体内易被透明质酸酶降解而导致其停留时间短,实际利用率并不高。近年来,随着高分子交联技术的不断发展,各种高分子量、抗降解的交联HA 不断涌现,进一步提升了HA 的实用价值,同时也拓宽了其应用范围[13-15]。其中,缩水甘油醚交联的HA 具有稳定性高、生物相溶性好的特点,可用于眼睛玻璃体的替代物、术后防粘连、软组织填充以及靶向药物缓 释的载体等[16]。因此,新型交联HA 的开发和应 用已成为当前科研工作者研究的重要方向和热点 之一[17-19]。
阿霉素是一种抗肿瘤抗生素,可抑制RNA 和DNA 的合成,抗瘤谱较广,对各种生长周期的肿瘤细胞都有杀灭作用,临床上用于治疗急性淋巴细胞白血病、急性粒细胞性白血病及各种实体性肿瘤白血病等的治疗,是肿瘤化疗方面最重要的药物之 一[20-21]。目前,临床上阿霉素的给药方式主要是通过静脉或动脉注射,而这会随之带来许多毒副作用,如脱发、口腔溃疡、食欲减退、恶心呕吐、心脏毒性和骨髓抑制毒性等。其中早期心脏毒性表现为暂时性心电图改变,多数可自行缓解,但晚期(慢性)心脏毒性,是不可逆的严重的心肌病变,严重者可致死,因此开发新型的具有靶向作用的阿霉素给药方式具有重要的应用价值[21]。由于HA 可以识别多种肿瘤细胞,可将其作为肿瘤药物的靶向载体用于抗肿瘤治疗[22-25]。因此,本文选用抗肿瘤药盐酸阿霉素为药物模型分子,尝试制备具有适宜降解周期和释药性能的载药交联HA 膜,以期能用于中晚期癌症患者手术后直接贴附于病灶,起到防粘连、降低毒副作用和高效治疗的作用。
1.1 主要仪器和试剂
752 型紫外可见分光光度计,上海棱光技术有限公司;PHS-3C 型酸度计,上海雷磁仪器厂;JSM-6360LA SEM,日本岛津;透析袋,22mm× 34mm,截留相对分子质量为14000,国药集团化学试剂有限公司。
透明质酸钠干粉,常州药物研究所有限公司;盐酸阿霉素(DOX·HCl),上海灏云化工科技有限公司;透明质酸酶(HAase),美国sigma Aldrich 化学品公司;其他试剂均为分析纯化学试剂。
1.2 交联透明质酸的合成
将1g 透明质酸钠干粉分散在由20%的氢氧化钠水溶液和丙酮组成的混合溶液后获得透明质酸钠碱性混悬液,然后向透明质酸钠碱性混悬液中加入1.8g 交联剂 1,4-丁二醇二缩水甘油醚(BDDE),搅拌状态下将反应物料于50℃保温8h,反应结束后用浓盐酸调节固液混合物料的pH 值至7,过滤洗涤后真空干燥得交联透明质酸钠粉末,用规格200 目的粉末过筛后,将过筛的粉末收集,依次用去离子水和 PBS 纯化,再冷冻干燥后得交联HA。
1.3 载药交联透明质酸的制备
配制浓度为0.1mg/mL、0.2mg/mL、0.4mg/mL、0.8mg/mL 的盐酸阿霉素水溶液,分别取3mL 分3次加入至30mg 交联透明质酸中,磁力搅拌至HA充分溶胀4h,-40℃冷冻干燥12h 后得到蓬松的海绵状固体,碾压后制成载药量分别为1%、2%、4%和8%的载药交联HA 膜。
1.4 盐酸阿霉素标准曲线的绘制
精密称取1.125mg 盐酸阿霉素置25mL 容量瓶中,用蒸馏水溶解并定容,配成45μg/mL 的贮备液。再用蒸馏水分别稀释成1μg/mL、6μg/mL、15μg/mL、30μg/mL 的系列浓度溶液。采用荧光分光光度法测定对应的吸光度,绘制标准曲线。
1.5 体外药物释放
将不同载药量(1%、2%、4%和8%)的30mg载药交联HA 膜置于透析袋中,并用5mL 释放介质(pH 值为7.4 的PBS 缓冲溶液)稀释或加入浓度为10U/mL 的透明质酸酶(HAase)溶液3.75mL 和1.25mL 释放介质,密闭透析袋后将其置于50mL 释放介质中。将该药物释放系统置于37℃恒温水浴中,磁力搅拌,间隔一定时间取样3mL,同时补加等量的新鲜释放介质。将所取样液3mL 用10mL 容量瓶定容后用紫外分光光度计测定吸光度,推算出药物累计释放量。
2.1 交联透明质酸的合成
HA 是一种高分子的聚合物,是由单位D-葡萄糖醛酸及N-乙酰葡糖胺组成的高级多糖,而D-葡萄糖醛酸及N-乙酰葡糖胺之间由β-1,3-配糖键相连,双糖单位之间由β-1,4-配糖键相连。如图1 所示,HA 结构中主要的修饰(反应活性)位点是羧基和羟基,因此交联剂1,4-丁二醇二缩水甘油醚(BDDE)与HA 在强碱作用下主要发生羧基、羟基与环氧乙烷之间的开环反应生成对应的酯和醚,此外HA 分子内或分子间的羧基与羟基之间也可发生酯化反应形成内部酯化的衍生物,最终将HA 桥连形成网状的交联HA 高聚物。
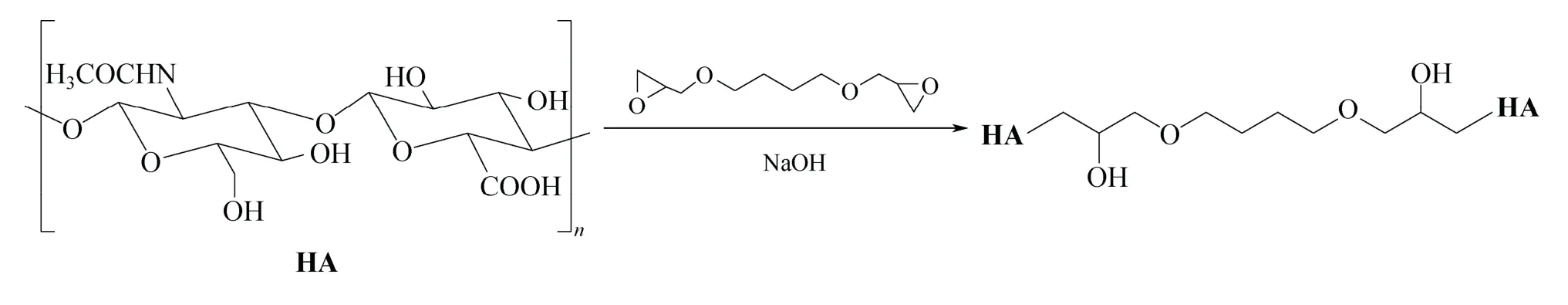
图1 交联HA 的合成
2.2 交联透明质酸的载药性能
将交联HA 固体置于一定浓度的盐酸阿霉素水溶液中充分溶胀形成水凝胶,再用冷冻干燥方法对水凝胶进行干燥、碾压成形,即可得到负载盐酸阿霉素的交联透明质酸膜。如图2(a)和图2(b)所示,载药前交联透明质酸为白色薄膜,载药后变为红色薄膜且颜色分布均匀,表明交联透明质酸与盐酸阿霉素形成了结构均匀的复合物。为进一步探索该复合物的内部结构,采用SEM 观测其截面的形貌。如图2(c)和图2(d)所示,交联HA 载药前表面均匀、光滑、致密,而载药后表面变得稀疏、粗糙不平,这正是吸附盐酸阿霉素的结果。此外,两者均呈现了多孔的三维网络结构,这是由于交联HA 在溶胀形成水凝胶的过程中,如同海绵一样会吸附大量的水,从而在冷冻过程中内部会形成大量的冰结晶,而这些冰晶在干燥过程中被抽走形成孔洞。
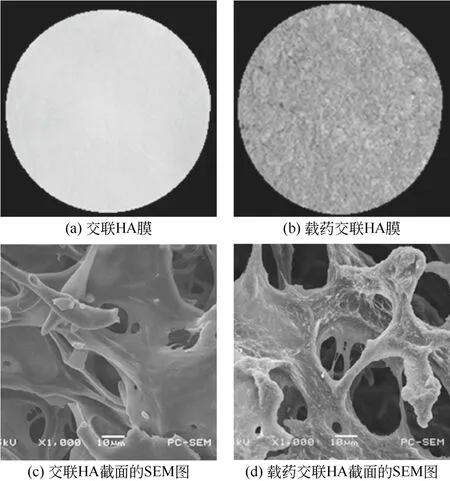
图2 交联HA 载药前后的形貌对比
2.3 盐酸阿霉素的体外释放
2.3.1 盐酸阿霉素的标准曲线
紫外UV-Vis 吸收光谱(图3)表明盐酸阿霉素药液的最大吸收峰在480 nm 处,在此波长下是以质量浓度(mg/L)为横坐标,吸光度为纵坐标绘制标准曲线(图4),将数据进行回归分析得到方程如式(1)。
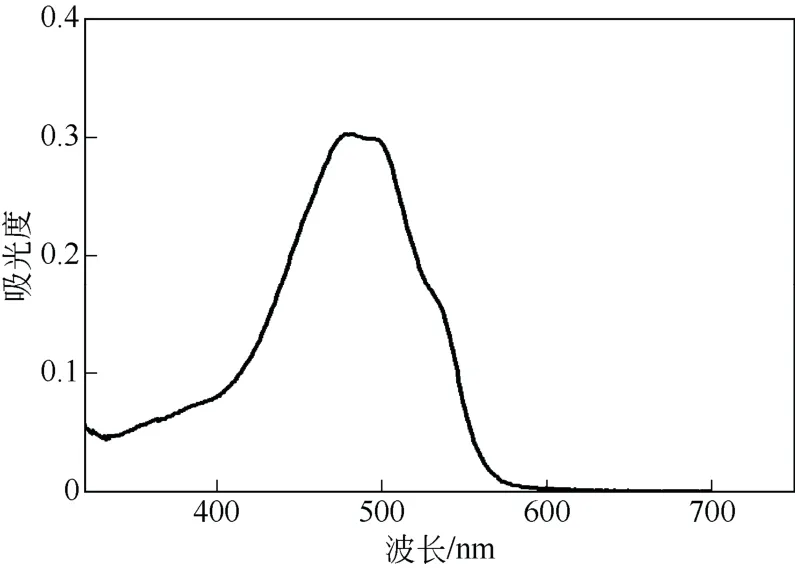
图3 盐酸阿霉素的紫外吸收光谱图
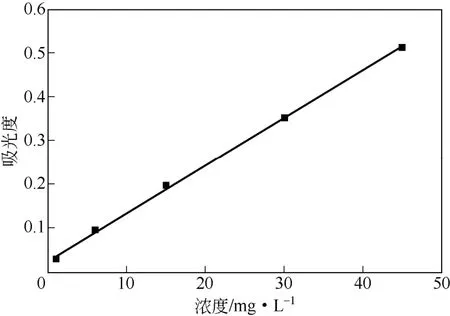
图4 盐酸阿霉素的标准曲线

表明盐酸阿霉素质量浓度在1~45mg/L 范围内与吸光度呈良好的线性关系,可以用来检测盐酸阿霉素含量。
2.3.2 载药交联透明质酸的体外释放
模拟人体环境,将载有盐酸阿霉素的交联HA膜置于释放介质(pH 值为7.4 的PBS 缓冲溶液)中,37℃下考察不同载药量(1%,2%,4%,8%)的交联HA 膜的体外释药性能。图5 为不同载药量的交联HA 膜24h 内的药物累计释放曲线。首先,各组载药交联HA 在12h 内,盐酸阿霉素累积释药速率都随时间急剧上升,随后药物的释放趋于平缓。这是由于在药物释放初期膜表面和浅层的盐酸阿霉素易与释放介质接触,容易扩散到溶液中,但随着交联HA 的不断溶胀形成凝胶,此时凝胶内外的介质交换变得困难,导致膜内部的盐酸阿霉素不易溶出,即药物的释放速度较慢。其次,12h 后药物的释放趋于平缓且载药量和累积释药速率呈反比,这可能是由于随着载药量的增加,载体表面和浅层分布的相对药物量也随之增加,从而增加了前期药物的突释和药物的释放速度,即凝胶外介质中药量相对较高,反而降低了交联HA 凝胶体系内外的浓度差,不利于后期凝胶内部药物向PBS 溶液中的扩散,导致药物的累积释放速度降低。
当交联HA 不断溶胀形成凝胶时,药物的释放速度逐渐变慢,此时药物释放的驱动力主要是凝胶内外的浓度差,因此采用不断更新外部释放介质的方法,以保持较高的内外浓度差,从而达到药物快速释放的效果。图6 为每12h 更换释放介质与保持释放介质不变条件下载药量为4%的交联HA 的药物释放行为对比,实验结果表明,不断更换释放介质时,其药物释放速度相对于不更换释放介质条件时明显加快(72h,累积释放率58% vs 31%)。
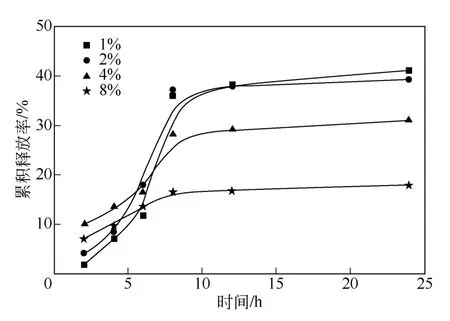
图5 不同载药量的交联HA 药物释放曲线

图6 释放介质对交联HA (4%) 药物释放的影响
2.3.3 交联HA 的降解对药物缓释性能的影响
为了进一步探索交联HA 的降解对药物缓释性能的影响,在上述体外药物释放实验中加入透明质酸酶(HAase)。图7 为载药量为4%的交联HA 膜在有HAase和无HAase的条件下的药物累积释放曲线。结果表明,加入HAase 后载药交联HA 中的药物释放速度比无HAase 时明显加快,12h 内释放药物达61%,而此时无HAase 的载药交联HA 释放药物只有29%。这主要是由于HAase 可降解凝胶中的HA,不断破坏凝胶网状结构,使内部的盐酸阿霉素暴露在释放介质中,从而加快了药物的释放。但12h后,药物释放也趋于平缓,这是由于交联HA 的降解速度也随着反应的进行逐渐变慢。
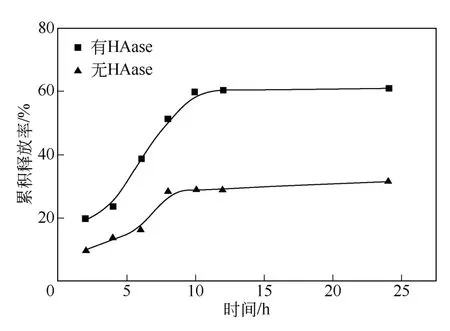
图7 有无HAase 时载药量为4%的交联HA 释药性能对比
3 结 论
以抗癌药物盐酸阿霉素为模型,交联HA 为载体,通过溶胀作用吸附药物分子,再冷冻干燥、碾压成形,制备了一系列具有不同载药量和一定缓释效果的载药交联HA 膜。药物体外释放研究表明,交联HA 膜中的盐酸阿霉素的释放速度同时受到释放时间、载药量和透明质酸酶的影响。12h 内药物释放较快,随后释放平缓,药物累积释放速度与载药量呈反比。加入透明质酸酶后,由于交联HA 的不断降解,药物累积释放速度比无透明质酸酶时快。该研究为交联HA 在药物缓释领域的应用以及抗癌药物盐酸阿霉素的靶向给药提供了新的思路和重要的参考依据。
[1] 凌沛学,贺艳丽,白若婉,等. 玻璃酸钠结构及理化性质的研究进展[J]. 中国生化药物杂志,2000,21(3):152-154.
[2] 陈建英,宋海波,贺艳丽,等. 交联透明质酸凝胶膜的制备及其生物相容性的研究[J]. 生物医学工程研究,2009,28(2):104-107.
[3] 肖荣冬,翁国星.胶原/透明质酸膜与明胶海绵支架材料力学及组织相容性的比较[J]. 中国组织工程研究,2012,16(25):4637-4643.
[4] 范宏斌,胡蕴玉,李旭升,等. 明胶-硫酸软骨素-透明质酸钠作为组织工程软骨支架的实验研究[J]. 中国修复重建外科杂志,2005,19(6):473-477.
[5] Snyder T N,Madhavan K,Intrator M,et al. A fibrin/hyaluronic acid hydrogel for the delivery of mesenchymal stem cells and potential for articular cartilage repair[J]. J. Biol. Eng.,2014,8:10-21.
[6] 黄小忠,管国强. 透明质酸生理功能及其应用研究进展[J]. 畜牧与饲料科学,2015,36(1):21-25.
[7] Platt V M,Szoka F C Jr. Anticancer therapeutics:Targeting macromolecules and nanocarriers to hyaluronan or CD44,a hyaluronan receptor[J]. Mol. Pharm.,2008,5(4):474-486.
[8] Yadav A K,Mishra P,Agrawal G P. An insight on hyaluronic acid in drug targeting and drug delivery[J]. J. Drug Target,2008,16(2):91-107.
[9] Tian H,Lin L,Chen J,et a1. RGD targeting hyaluronic acid coating system for PEI-PBLG polycation gene carriers[J]. J. Controlled Release,2011,155:47-53.
[10] Park S,Bhang S H,La W G,et a1. Dual roles of hyaluronic acids in muhilayer films capturing nanocarriers for drug-eluting coatings[J]. Biomaterials,2012,33:5468-5477.
[11] Picaud L,Thibault B,Mery E,et al. Evaluation of the effects of hyaluronic acid-carboxymethyl cellulose barrier on ovarian tumor progression[J]. J. Ovarian Res.,2014,7:40-52.
[12] Luo Y,Ziebell M R,Prestwich G D.A hyaluronic acid-taxol antitumor bioconjugate targeted to cancer cells[J]. Biomacromolecules,2000,1(2):208-218.
[13] 蒋丽霞,王文斌. 透明质酸及其衍生物在医学上的应用[J]. 中国修复重建外科杂志,2010,14(15):56-61.
[14] 徐新,施丹萍,叶玟希,等. 交联透明质酸衍生物的制备进展[J]. 广东化工,2012,39(5):99-100.
[15] 韩飞,肖雄,谢山青,等. 新型药用辅料——透明质酸的研究进展[J]. 中国实验方剂学杂志,2014,20(17):232-236.
[16] 陈建英,汪敏,刘杰,等. 注射用交联透明质酸钠凝胶的制备及其体外抗酶降解性的研究[J]. 中国生化药物杂志,2008,29(4):262-265.
[17] Vasi A M,Popa M I,Butnaru M,et al. Chemical functionalization of hyaluronic acid for drug delivery applications[J]. Mater. Sci. Eng. C,2014,38:177-185.
[18] 袁玉姣,蒋革,董爽. 透明质酸衍生物在生物药品传递方面的研究进展[J]. 沈阳药科大学学报,2013,30(3):232-238.
[19] Zhang H,Huang S,Yang X,et al. Current research on hyaluronic acid-drug bioconjugates[J]. Eur. J. Med. Chem.,2014,86:310-317.
[20] 邓碧,叶琳,王驰,等. 脂质体阿霉素对人鼻咽癌 HNE-1 细胞株增殖与凋亡作用的研究[J]. 重庆医科大学学报,2009,34(11):1479-1481.
[21] 周平红,秦新裕. 脂质体阿霉素及其靶向治疗研究进展[J]. 中国临床医学,2002,9(4):331-333.
[22] Saravanakumar G, Choi K Y,Yoon H Y. Hydrotropic hyaluronic acid conjugates:Synthesis,characterization,and implications as a carrier of paclitaxel[J]. Int. J. Pharm.,2010,394:154-161.
[23] Cho H J,Yoon I S,Yoon H Y. Polythylene glycol-conjugated hyaluronic acid-ceramide self-assembled nanoparticles for targeted delivery of doxorubicin[J]. Biomaterials,2012,33:1190-1200.
[24] Goodarzi N,Ghahremani M H,Amini M,et al. CD44-targeted docetaxel conjugate for cancer cells and cancer stem-like cells:A novel hyaluronic acid-based drug delivery system[J]. Chem. Biol. Drug Des.,2014,83:741-752.
[25] 邱丽筠,黄丽丽,俞淑文. 透明质酸在肿瘤治疗药物新型给药系统中的应用[J]. 中国实用医药,2014,9(16):238-241.
