2010年-2014年广东高考化学常规考点之“离子共存”解题思路分析
2015-07-21罗秀霞衷明华
罗秀霞 衷明华
(韩山师范学院化学系,广东 潮州 521041)
2010年-2014年广东高考化学常规考点之“离子共存”解题思路分析
罗秀霞 衷明华
(韩山师范学院化学系,广东 潮州 521041)
离子共存是近几年广东高考试题中常考的一个内容,是每年高考的常规,高频考点,其考察形式一般为选择题,该题考查考生对离子反应的概念,氧化还原反应概念,离子反应发生条件的了解情况,对中学常见离子的性质的掌握程度。现对“离子共存”解题思路作如下分析。
高考 离子共存 考点例析 解题研究
1、考情分析
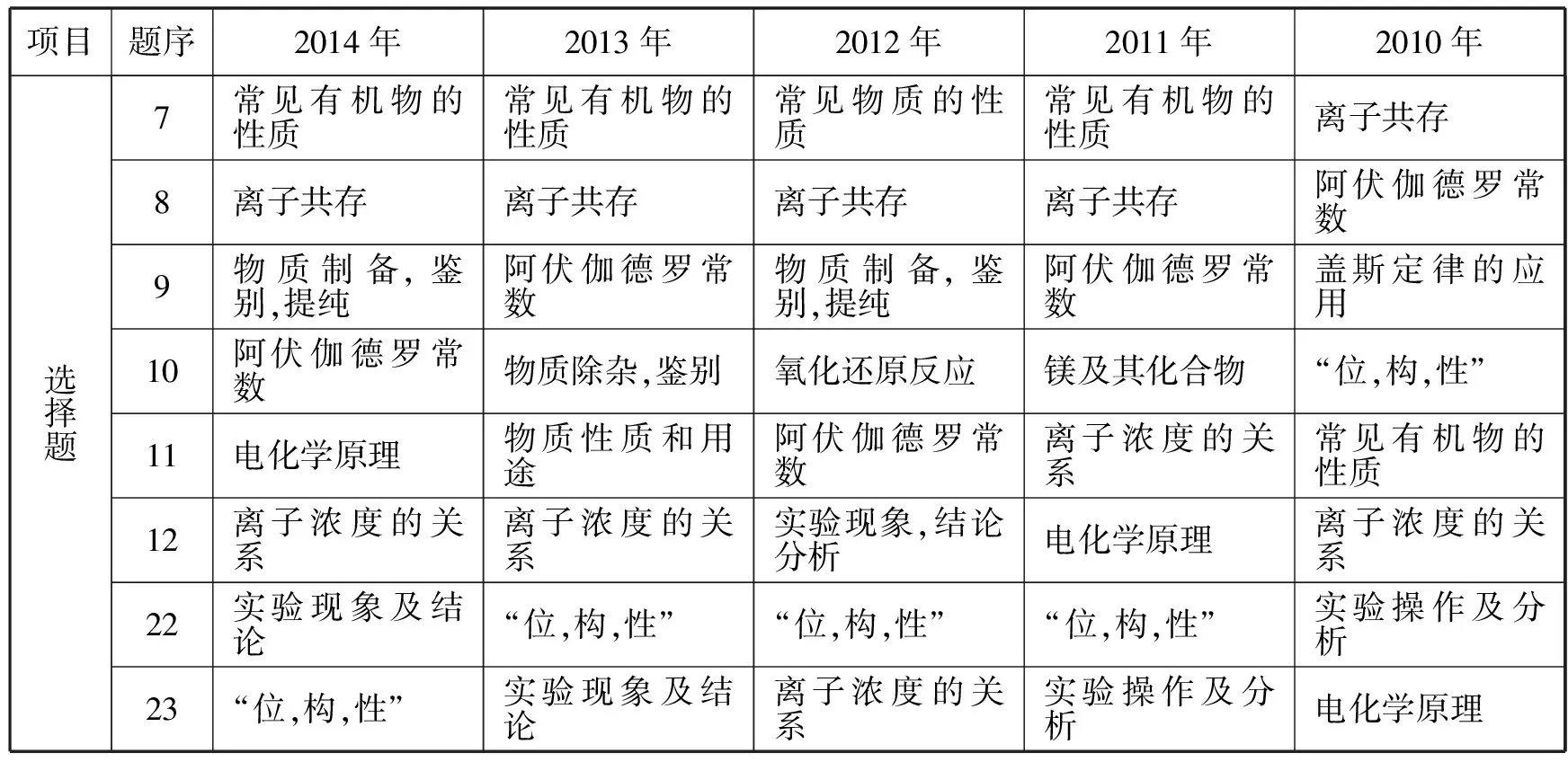
表 近五年广东高考选择题考点对比
从上表可以看出,近五年选择题中,“离子共存”为常考点,高频点,重复出现率100%,主要考查考生对学生对离子反应的概念,氧化还原反应概念,离子反应发生条件的掌握。这就要求学生对中学常见离子的性质有充分的了解和具备化学学科基本知识和技能并能灵活应用到解题中。
2、考点剖析
离子共存是指在同一溶液中,各离子间不会发生反应产生沉淀、气体、水、难电离的物质等,则这些离子可以共存。
对此,在解答此类题目时,首先抓好题干:审清题干所涉及到的“明示条件”和“隐含条件”等,审题时还应看清“能大量共存,还是不能大量共存”。
其次认真分析离子组:一“色”;二“性”;三“特”;四“反应”。
3、考点例析
(1)一“色”,即溶液颜色。
例一:下列溶液中有关离子一定能大量共存的是( )。
A.能使石蕊显蓝色的溶液中:Na+、Cl-、I-、NO3-
B.能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO-
C.能使pH试纸变红色的溶液中:Fe3+、NO3-、Ag(NH3)2+
D.无色溶液中:K+、Cl-、PO43-、SO32-
解析:B中甲基橙的变色范围为3.1~4.4,能使甲基橙呈黄色时,溶液为酸性,溶液中SO42-和ClO-不能大量共存,C中能使pH试纸变红色的溶液为酸性,溶液中Ag(NH3)2+不能大量存在。
答案:AD。
解题思路:解答此种类型题,必须熟练掌握并牢记常见的指示剂变色的范围及对应溶液的酸碱性,如:石蕊,甲基橙,酚酞等,以及一些离子的特殊颜色和特征反应,如:Cu2+、Fe2+、Fe3+等。同时认真看清题干要求,是“能使”还是“不能使”,切忌粗心马虎,导致不必要的失分。
(2)二“性”,即溶液的酸性和碱性。
例二:下列各组离子,在指定的条件下能大量共存的是( )。
A.滴加甲基橙试剂呈红色的溶液:NH4+、Cl-、Fe2+、ClO-
B.水电离出来的c(H+)=10-13mol/L的溶液:K+、HSO3-、Br-、Ca2+
C.pH为11的溶液:S2-、SO32-、S2O32-、Na+
D.在中性溶液中:K+、S2-、NO3-、Al3+
解析:A中加甲基橙试剂呈红色的溶液是酸性溶液,ClO-具有强氧化性不能与还原性离子Fe2+共存,B中溶液呈强酸性或强碱性都不能与HSO3-共存,D中Al3+与S2-因发生双水解反应而不能共存。
答案:C。
解题思路:这种题通常给一些条件,如溶液的pH,或是以水电离为背景以及某些指示剂的显色反应等来考察,要准确地解答此种题,首先得了解溶液酸碱性的判断情况,如常温常压下,pH<7为酸性,pH>7为碱性,还有水电离出来的c(H+),c(OH-)的计算以及一些比较常见的指示剂的显色反应所对应的溶液酸碱性等。再把题目所给的每个选项仔细认真分析,不漏看,不错看,结合已有的知识逐一解答、比较、选出正确答案。
(3)三“特”,指三种特殊情况。
例三:水溶液中能大量共存的一组离子是( )。
A.Na+、AlO2-、Cl-、HCO3-
B.H+、Na+、Fe2+、NO3-
C.K+、Ca2+、H2PO4-、PO43-
D.K+、NH4+、CO32-、SO42-
解析:A中AlO2-与HCO3-不能大量共存:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-;B中NO3-与H+结合,生成具有强氧化性的HNO3,能与Fe2+发生反应,故NO3-、Fe2+、H+在水溶液中不能大量共存;C中H2PO4-与PO43-不能大量共存,二者相遇是反应生成HPO42-;D中NH4+与CO32-,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,因此它们在溶液中能大量共存。
答案:D。
解题思路:对于一些特殊的离子,应熟记其特殊反应情况,熟记并掌握以下三种特殊情况:
①AlO2-与HCO3-不能大量共存;H2PO4-与PO43-不能大量共存;
②“NO3-+H+”组合具有强氧化性,能与S2-、Fe2+、I-等发生反应,而这一组合常常较为隐蔽,不易被察觉;
③NH4+与CH3COO-、CO32-,Mg2+与HCO3-等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中能大量共存(如果加热就不同了)。
(4)四“反应”,指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
例四:下列离子,在水溶液中能大量共存的是( )。
A.Fe3+、HCO3-、Ca2+、SO42-
B.H+、Fe2+、SO32-、ClO-
C.Mg2+、NH4+、Cl-、SO42-
D.Fe3+、K+、NO3-、SCN-
解析:A项,Ca2+与SO42-生成CaSO4,CaSO4微溶不可大量共存,Fe3+与HCO3-发生双水解反应,所以不能共存;B项,ClO能-氧化Fe2+、SO32-、D项,Fe3+与SCN-不可共存。
解题思路:此道题考查了离子间通常发生的四种类型的反应,即复分解反应,氧化还原反应,双水解反应,络合反应。而这四种反应类型,我们需要理解熟记其各自的反应特点。如以下所示。
①复分解反应(有难溶性物质、易挥发物质、弱电解质生成);
②氧化还原反应(强还原性离子和强氧化性离子因发生氧化还原反应而不能大量共存)要特别注意H++NO3-的组合,具有强氧化性;
③双水解反应,如Al3+与CO32-、Al3+与AlO2-等;如下列组合都可以发生双水解:
Al3+与S2-、AlO2-、HCO3-、CO32-、HSO3-、SO32-反应。
Fe2+与SO32、AlO2-、HCO3-、CO32-、HSO3-反应。
AlO2-与Fe3+、Al3+、NH4+反应。
NH4+与AlO2-、SiO32-反应。
离子共存是近几年广东高考化学的常规,高频考点,同时也是高考化学复习的重难点,但其考察形式比较稳定,多以选择题形式出现,在解答此类问题时,认真分析离子组:一“色”;二“性”;三“特”;四“反应”,并灵活应用这四种解题思路,秒杀高考离子共存题不在话下。
