热诱导表达的水稻OsBBX30基因克隆和表达分析
2015-07-20饶力群等
饶力群等


摘要:生物信息学分析表明:OsBBX30基因启动子含有与逆境相关的作用元件HSE.为进一步了解OsBBX30基因在生物体内受热诱导,通过OsBBX30基因克隆构建原核表达和实时定量PCR分析,证实OsBBX30基因表达受热胁迫诱导,能增强大肠杆菌的耐热能力,为深入了解该家族基因和挖掘水稻耐热基因奠定基础.
关键词:克隆;水稻BBX基因;热胁迫;实时定量PCR
中图分类号:S511 文献标识码:A
Abstract:Bioinformatics analysis indicates that the promoter of OsBBX30 contains function element HSE, which is related with adversity. In this study, it is found that OsBBX30 gene expression is induced by heat stress, which enhances the E. coli heat resistant ability through bioinformatics,Gene clone prokaryotic expression and realtime quantitative PCR analysis. The results are helpful in understanding the family genes and rice heat resistant genes.
Key words:clone; OsBBX; heat stress; QPCR
水稻是我国重要粮食作物,高温是制约水稻生产和产量的重要因素,培育耐热水稻品种是保证水稻稳产的重要手段[1],而利用基因工程技术是获得水稻耐热新品种的重要途径[1],因此筛选和克隆水稻耐热相关的基因受到人们关注.
锌指蛋白是一类具有手指状结构域的转录因子,在基因表达、细胞分化、胚胎发育、增强抗逆性等方面具有重要的调控作用[2],对植物的生物发育和胁迫的响应是至关重要的[3],在光调节植物生长发育中也是不可替代的[4-5].BBX是一类含有Bbox结构域的锌指蛋白,通过生物信息学分析发现,在水稻中有30个BBX基因,拟南芥中有32个BBX基因[6-8].其中Bbox家族中有一类只在N端具有多个Bbox结构域,在C端不具有CCT结构的锌指蛋白,称为DBB (Double Bbox)蛋白亚族基因.拟南芥DBB亚家族中有8个编码基因,通过比对发现水稻中有10个OsDBB同源基因[6].拟南芥中该亚家族基因参与调控拟南芥光形态建成、光周期调控开花时间,花的发育、耐热,而在水稻中关于该亚家族基因的功能还未有报道[7].
本研究对OsDBB亚家族中的OsBBX30进行耐热相关的生物信息学分析和运用实时定量PCR技术检测其在不同水稻品种中响应热胁迫的表达特征,并通过构建含OsBBX30蛋白的大肠杆菌菌株和分析其对大肠杆菌耐热能力的影响,明确OsBBX30基因响应热胁迫的表达特征,为深入了解其在生物响应热胁迫信号途径中的作用奠定基础.
1材料与方法
1.1材料与试剂
1.1.1材料
水稻材料为国家杂交水稻中心提供的水稻品种日本晴( Oryz asativa L ssp.),9311,N22,种植于湖南农业大学人工气候室,水稻生长至幼穗分化期(6期末7期初),分别以0 h,3 h,6 h和12 h在42 ℃进行热处理.
1.1.2菌株、质粒与试剂
大肠杆菌菌株DH5αpGEMT vector,Taq酶和Marker 以及DNA快速纯化回收试剂盒,购于天根生化材料(北京)有限公司,质粒PET30a由本实验室保存所得,DNA限制性内切酶,反转录试剂盒(RevertAidTM First Strand cDNA Synthesis Kit)购于长沙海洋生物技术有限公司(Fermentas公司代理), RNA Simple Total RNA Kit购于北京天根生化科技有限公司,荧光定量PCR试剂盒[UltraSYBR Mixture(with ROX)]购于康为世纪.
1.2方法
1.2.1生物信息学网站介绍
RMAP(http://www.ricemap.org/index.jsp)——a newgeneration rice genome browser,即RMAP数据库,该数据库收录了全稻属基因组图谱,且从该网站中可以查找目的基因的全长基因组序列、CDS以及潜在的启动子序列.
PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)——Cis-Acting Regulatory Element,植物顺式作用元件数据库,从该网站中可以分析植物中已知基因的启动子区含有的顺式作用元件.
String (http://www.string-db.org/)——functional protein association networks,蛋白相互作用数据库,通过已知的蛋白序列查找同源蛋白和相互作用分析.
1.2.2生物信息学分析
通过NCBI(http://www. ncbi. nlm. nih. gov/)网站搜寻到其核酸序列,再利用Rice-map(http://www.ricemap.org/index.jsp)对水稻OsBBX30基因的结构特征进行分析,并对其启动子区域在PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站上进行顺式作用元件分析.通过String (http://www.string-db.org/)网站进行蛋白同源性和相互作用分析,最后在ROAD (http://ricearray.org/index.shtml)网站对水稻OsBBX30基因进行基因生物芯片分析.
1.2.3载体克隆
采用天根生化科技(北京)有限公司RNA提取试剂盒的方法提取水稻日本晴叶片的RNA.利用GenBank中水稻基因组序列获得OsBBX30基因的CDS序列,并利用Primer Premier5.0设计特异的克隆引物:F(5′to3′): TCCTTGTAGTCCCGCGGATGAGGATCCAGTGCGACG,R(5′to3′): AGGATCCCGGGTACCTCATCCAAGATCAGAACG AT在正向引物和反向引物的5'分别引入EcoRI 和HindIII酶切位点.50 μL的反应体系为:1 μL EasyTaq;5 μL 10*buffer;前后引物各1 μL;5 μL cDNA;33 μL ddH2O;4 μL dNTP;PCR反应体系为:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,30个循环;最后72 ℃延伸5 min.PCR产物用质量分数为1%琼脂糖凝胶电泳进行检测.
利用DNA纯化试剂盒切胶回收目的片段,将目的片段与T载体链接,通过热激法将连接产物转化到大肠杆菌DH5α感受态细胞中.37 ℃过夜培养后,挑取单菌落进行PCR,并提取阳性克隆的重组质粒进行酶切验证.阳性克隆由铂尚生物技术有限公司测序.
将目的片段从T载体上经EcoRI 和HindIII切下回收后,与用内切酶EcoRI 和HindIII酶切纯化后的PET30a载体,去磷酸化后进行连接,用热激法转化到大肠杆菌DH5α感受态细胞中,经验证为重组的表达载体.
1.2.4大肠杆菌耐热性分析
融合蛋白诱导表达:先挑BL21/30aOsBBX301,2,3单克隆于5 mL LB培养基中,37 ℃震荡培养至OD600=0.6~0.8,然后加6 μL IPTG,23 ℃震荡培养过夜,离心收集菌体备用.SDSPAGE检测:配置凝胶质量分数为12.6%的分离胶,在烧杯中依次加入下列试剂:30%丙烯酰胺1.5 mL,pH 8.8,1 mol/L TrisHCl 1.2 5 mL,蒸馏水7.05 mL,10%SDS 100 μL,10%过硫酸100 μL,TEMED 10 μL.将所收集菌体用PBS磷酸缓冲液重悬,超声波破碎10 min后离心弃上清,加10 μL loading buffer充分混匀后沸水浴10 min,冷却后上样.
分别挑BL21/pET30a,BL21/30aOsBBX30单克隆于5 mL LB培养基中,37 ℃震荡培养至OD600=0.6~0.8;加6 μL IPTG,23 ℃震荡培养过夜;将培养物置于50 ℃下分别震荡培养0 h,1 h,1.5 h,2 h,2.5 h和3 h;将菌液稀释100倍后涂布于LB平板,37 ℃倒置培养过夜;拍照、计数.
1.2.5OsBBX30基因表达水平的定量PCR(qRTPCR) 验证
水稻幼穗分化至6~7期的整片剑叶进行了42 ℃高温热处理0 h,3 h ,6 h,12 h后利用QPCR对OsBBX30基因表达水平进行了验证.首先,利用Primer Premier 5.0设计序列特异的QPCR引物(表1),actin为内参基因.采用Trizol 法抽提水稻叶片总RNA,利用反转录试剂盒转录成cDNA,再利用UltraSYBR Mixture(with ROX)试剂盒配制20 μL体系: 13.2 μL ddH2O,5 μL mix,前后引物各0.4 μL,1 μLcDNA.在ABI7300上进行qRTPCR反应,反应程序:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃ 32 s,40个循环.通过溶解曲线来确定QPCR反应的特异性.再利用相对定量(2-△△Ct)[8]分析目标基因表达水平的变化[9].
2结果与分析
2.1芯片数据分析
2.1.1启动子作用元件分析
通过RMAP软件分析表明水稻基因OsBBX30(LOC_Os12g10660)位于12号染色体中,长度为2537 bp,通过将其启动子序列放入PLANTCARE里面进行启动子元件分析.发现除了含有多个 TATABox 和 CAATBox 等基本转录元件外,还有多个与逆境相关的元件.其中高温响应元件有HSE,circadian,Gbox,Skn1_motif,ACE,干旱低温响应元件有 MBS,ARE元件.此外,还含有大量与光响应的元件,如 GAmotif,chsCMA1a,ERE,MRE 等.
2.1.2OsBBX30蛋白同源性分析
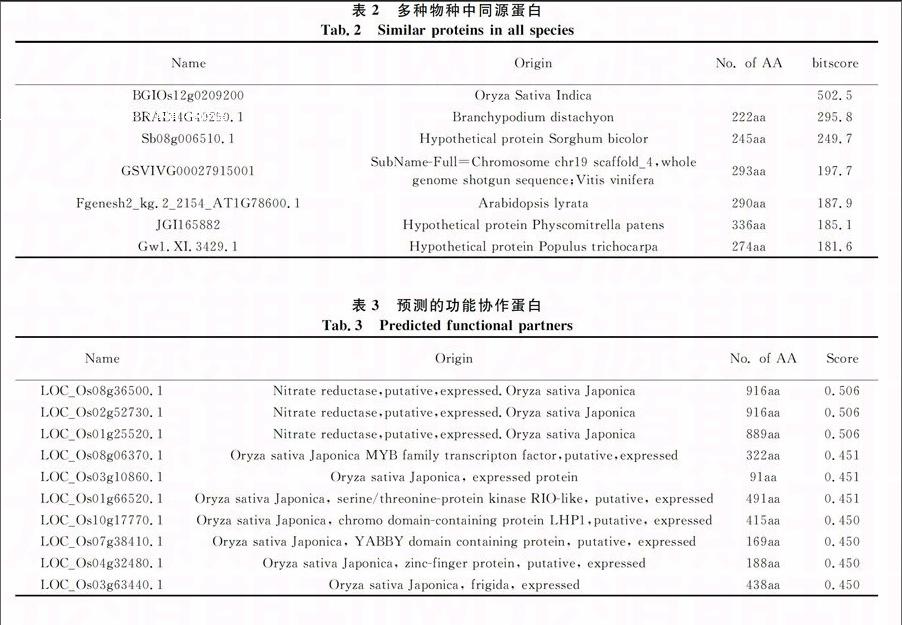
通过NCBI搜索到OsBBX30的蛋白序列,将其蛋白序列放入STRING网站搜索结果发现LOC_Os12g10660在粳稻中发现的同源性较高的蛋白都为DBB亚家族中的蛋白.在其他物种如水稻籼稻,二穗短柄草,高粱,葡萄,拟南芥,苔藓,毛果杨这7种(见表2)也发现同源性较高的蛋白.同时也发现了10种与OsBBX30蛋白功能协作的蛋白质,其中相互作用最强的3种蛋白质都来自粳稻品种(表3).
2.1.3水稻芯片分析
因为OsBBX30基因中含有HSE元件,因此将其在ROAD网站中进行了分析.在OsBBX30基因响应热胁迫中,结果表明(图1(a))OsBBX30基因的2个探针在根部的表达量都较高,经过 42 ℃的热胁迫处理,该基因的表达量升高很多,表明该基因对热胁迫逆境有正响应作用.图1(b)结果则表明OsBBX30基因的2个探针在籼稻干旱胁迫敏感型和籼稻干旱胁迫耐受型中其表达量都很低.经过干旱胁迫后,其表达量上调明显,表明该基因在同种材料不同类型中对干旱胁迫起到相同的正调控作用.
2.2原核表达载体构建
为进一步研究水稻OsBBX30基因的功能,本实验构建了一个原核表达载体PET30a,用于体外表达OsBBX锌指蛋白.以水稻基因组cDNA为模板,PCR扩增得到目的片段(图2(a)).将该目的片段进行纯化回收链接到pGEMT上,并转化至大肠杆菌DH5α中,获得带有目的片段的重组载体.将获得的重组载体的阳性菌落进行扩大培养,提取质粒.经过HindⅢ与EcoRⅠ酶切,胶回收,去磷酸化,连接,转化4个步骤将目的片段连接到PET-30a上,获得重组载体(图2(b)).
2.3大肠杆菌耐热性分析
将构建好的30aOsBBX30载体转化大肠杆菌BL21,确定诱导条件后批量摇菌,超声波破碎后离心收集沉淀,加样品稀释液后点样.在电压150 V下电泳1 h,电泳图见图3,图中Ⅰ为空载未经IPTG诱导;Ⅱ为空载经IPTG诱导;Ⅲ为30aOsBBX30未经IPTG诱导:Ⅳ为30aOsBBX30经IPTG诱导.由图3中可发现,与负对照相比在14~20 KD处出现一条额外条带,即OsBBX30与His Tag的融合蛋白.
生物信息学分析表明OsBBX30含有HSE顺式作用元件,受高温诱导.本实验对转入了OsBBX30的大肠杆菌菌株进行了耐热性分析,热处理温度为50 ℃,并以含pET30a空载体的大肠杆菌做负对照,通过MTT法测定大肠杆菌活数[10],结果发现含OsBBX30的转基因大肠杆菌的存活率较含pET30a空载体的大肠杆菌有明显提高.说明OsBBX30融合蛋白可能与细菌耐热相关蛋白相互作用,使其对热胁迫的耐受有所提高(图4).
融合蛋白SDSPAGE检测
2.4水稻热胁迫分析
为了证实OsBBX30基因在水稻中受热胁迫诱导,笔者选用日本晴,9311,N22,3种水稻品种在0 h,3 h,6 h,12 h进行42 ℃热处理,以0 h处理作为对照组,采用荧光定量PCR检测OsBBX30基因的表达水平,结果表明(图5),在不同的水稻品种中,OsBBX30基因表达各异.日本晴品种中OsBBX30基因表达量较低,在12 h处理后,OsBBX30基因的相对表达量又有所增加.9311品种中OsBBX30基因表达量也低,并且其相对表达量降低,而N22品种中,OsBBX30基因表达呈明显增加,且随热处理时间延长,其相对表达量呈现明显增加趋势.日本晴为粳稻常规水稻,9311为籼稻常规水稻,N22为籼稻耐高温品种.在上述结果我们证明了,OsBBX30基因在N22中经过热处理后,影响其表达量,推测OsBBX30为耐热基因.
3结论
通过PLANTCARE分析发现,OsBBX30的启动子区域含有多个的逆境响应顺式作用元件,如HSE,Gbox和ABREs等,结合芯片分析结果发现OsBBX30的表达受高温诱导.通过实时定量PCR验证发现该基因在耐热水稻品种N22中的表达明显受热胁迫诱导,由此表明含有逆境响应顺式作用元件的启动子在植物逆境胁迫响应过程中可能起到至关重要的作用.研究发现,水稻N22品种是最耐热的籼型常规稻,其在38 ℃高温下的生产率仍达到64%~86%[11].9311作为籼型常规稻,其品质优、产量高[12-13].日本晴属粳亚种,对温度和日照长度无特殊响应[14].此外,本研究发现OsBBX30蛋白提高了大肠杆菌对高温的耐受性,进一步证明OsBBX30与生物耐受热胁迫存在联系.OsBBX30表达受热胁迫诱导的特征为深入了解水稻的耐热分子信号传导途径提供了新的思路,为水稻抗逆分子育种提供了新的参考,为全面了解水稻抗逆的分子机制奠定了基础.
参考文献
[1]申秋硕,陈信波,张先文,等.三个逆境相关的水稻启动子克隆与瞬时表达分析[J].中国生物工程杂志,2012,32( 11) :29-34.
[2]黎毛毛,廖家槐,张晓宁,等,江西省早稻品种抽穗扬花期耐热性鉴定评价研究[J]. 植物遗传资源学报,2014,15(5) :919-925.
LI Maomao, LIAO Jiahuai, ZHANG Xiaoning, et al. Evaluationof heat toleranceat the headingflowering stages for earlyseason rice varietiesin jiangxi province[J]. Journal of Plant Genetic Resources,2014,15(5) :919-925.(In Chinese)
[3]RIECHMANN J L, HEARD J, MARTIN G,et al. Arabidopsis transcription factors: genomewide comparative analysis among eukaryotes [J]. Science, 2000, 290(12): 2105-2110.
[4]KUMAGAI T,ITO S,NAKAMICHI N,et al. The common function of a novel subfamily of Bbox zinc finger proteins with reference to circadianassociated events in Arabidopsis thaliana[J]. Biosci Biotechnol Biochem, 2008, 72(6): 1539-1549.
[5]张桂莲,陈立云,雷东阳,等,水稻耐热性研究进展[J].杂交水稻,2005,20( 1) :1-5.
[6]汤日圣,张大栋,郑建初,等.高温对不同水稻品种花粉活力及籽粒结实的影响[J].江苏农业学报,2014,15(5) :919-925.
TANG Risheng, ZHANG Dadong, ZHENG Jianchu, et al. Effects of high temperature on pollen vitality and seed setting of different rice varieties[J].Jiangsu Agricultuer Sciences,2014,15(5) :919-925.(In Chinese)
[7]KHANNA R, KRONMILLER B, MASZLE D R, et al. The arabidopsis Bbox zinc finger family[J]. Plant Cell, 2009, 21: 3416-3420.
[8]CHANG C S, LI Y H, CHEN L T, et al. LZF1, a HY5regulated transcript tional factor, functions in Arabidopsis deetiolation[J]. Plant Journal, 2008, 54: 205-219.
[9]申秋硕,陈信波,张先文.三个逆境相关的水稻启动子克隆与瞬时表达分析[J].中国生物工程杂志,2012,32( 11) :29-34.
[10]高琼,马传鑫,李燕妮,等.MTT法测定大肠杆菌活菌数实验研究[J].环境科学学报.2011,31(12):2642-2650.
GAO Qiong, MA Chuanxin, LI Yanni, et al. Experimental study on the application of MTT colorimetric method in counting live escherichia coli[J]. Acta Scientiae Circumstantiae,2011,31(12):2642-2650.(In Chinese)
[11]JAGADISH S V K, CRAUFURD P Q,WHEELER T R. Phenotyping parents of mapping populations of rice for heat tolerance during anthesis[J]. Crop Science,2008 48:1140-1146.
[12]吕川根. 江苏省两系法杂交稻研究与生产[J]. 江苏农业学报, 2010,26(3): 649-657.
LV Chuangen. Status and countermeasures for research and production of twoline hybrid rice in Jiangsu province[J]. Jiangsu Journal of Agriculture Sciences,2010,26(3): 649-657.(In Chinese)
[13]戴正元, 刘广清, 李爱宏, 等. 两系杂交稻扬两优6 号的选育及栽培特性研究[J]. 中国农学通报, 2005,21(11): 114-116.
DAI Zhengyuan, LIU Guangqing, LI Aihong, et al. Breeding of twoline indica hybrid rice combination, “Yangliangyou 6” and studying on its culture characteristics[J].Chinese Agriculutural Science Bulletin,2005,21(11): 114-116.(In Chinese)
[14]李传国, 仲维功, 缪炳良. 优质杂交籼稻新组合粤优938的选育与利用[J]. 杂交水稻, 2001, 16(3): 9-12.
