二甲双胍对MCF-7肿瘤细胞系SP细胞的抑制作用
2015-07-19周恩相
刘 畅,周恩相
(福建省肿瘤医院,福州350014)
二甲双胍对MCF-7肿瘤细胞系SP细胞的抑制作用
刘 畅,周恩相
(福建省肿瘤医院,福州350014)
目的 研究二甲双胍、紫杉醇脂质体、他莫昔芬对人乳腺癌MCF-7肿瘤细胞系SP细胞的杀伤作用及相互的协同效应。方法 将二甲双胍(0.3 mmol/L)、紫杉醇脂质体(60.0 μg/L)、他莫昔芬(10.0 μmol/L)分别对MCF-7肿瘤细胞进行单一或联合干预,并应用流式细胞仪分析SP细胞比例。结果 空白对照组、二甲双胍组、紫杉醇脂质体组、他莫昔芬组、二甲双胍联合紫杉醇脂质体组、二甲双胍联合他莫昔芬组MCF-7肿瘤细胞系SP细胞比例各不相同,二甲双胍干预各组MCF-7肿瘤细胞系SP细胞比例分别较其余各组下降,差异均有统计学意义 (P<0.01);二甲双胍干预各组MCF-7肿瘤细胞系SP细胞比例两两比较及非二甲双胍干预各组MCF-7肿瘤细胞系SP细胞比例两两比较,差异均无统计学意义(P>0.05)。结论 0.3 mmol/L二甲双胍可有效杀灭人乳腺癌MCF-7肿瘤细胞系SP细胞;二甲双胍与紫杉醇脂质体或他莫昔芬联用未表现出协同效应。
乳腺,人; 乳腺肿瘤; 细胞系,肿瘤; 二甲双胍; 他莫昔芬; SP细胞; 紫杉醇脂质体
作为临床治疗2型糖尿病最常用的药物之一,二甲双胍(metformin,Met)可降低多种恶性肿瘤的患病风险和死亡率[1]。有研究证实,Met抑制乳腺癌细胞增殖的通路为激活磷酸化腺苷酸活化蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK),对雌激素受体阳性和阴性的乳腺癌细胞均有生长抑制和细胞周期停滞作用[2-3],并可缩小荷瘤裸鼠肿瘤体积及延长缓解期[4-5]。流行病学调查也表明,长期服用Met可降低乳腺癌发生率并改善患者预后[6-7]。本研究测定了SP细胞在人乳腺癌MCF-7肿瘤细胞系中的比例,旨在探讨Met、紫杉醇脂质体(paclitaxel liposome,Taxol)、他莫昔芬(tamoxifen,TAM)对人乳腺癌MCF-7肿瘤细胞系SP细胞的杀伤作用及相互的协同效应,现报道如下。
1 材料与方法
1.1 材料 人乳腺癌MCF-7肿瘤细胞系为云南大学昆明医学院提供,杜氏改良Eagle培养基(Dulbecco′s modified Eagle medium,DMEM)/F12复合培养基、胎牛血清购自GIBCO公司,L-谷氨酰胺、赫希司特33342染料(Hoechst33342)、碘化丙啶(propidium iodide,PI)、维拉帕米(Verapamil)、TAM原药粉剂购自Sigma公司,0.25%胰蛋白酶、二甲基亚砜购自鼎国生物技术有限公司,Met原药粉剂购自湘雅制药有限公司,Taxol原药粉剂购自思科药业有限公司,EPICS ALTRA流式细胞仪购自Beckman Coulter公司。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清的DMEM/F12复合培养基培养MCF-7肿瘤细胞(37℃、5%二氧化碳、饱和湿度)。
1.2.2 实验分组 取对数生长期MCF-7肿瘤细胞,分别加入Met、Taxol、TAM,使三者分别达0.3mmol/L、60.0μg/L、10.0 μmol/L。分为空白对照组、Met组、Taxol组、TAM组、Met联合Taxol组、Met联合TAM组。
1.2.3 细胞染色 将经药物干预24h的细胞以0.1mmol/L磷酸盐缓冲液(phosphate buffer solution,PBS)离心洗涤2次(1 000 r/min离心5 min);用DMEM/F12复合培养基重悬细胞;将细胞悬液分为两组,一组加入5 μg/mL Hoechst33342,一组加入 5 μg/mL Hoechst33342和50 μg/mL Verapamil;水浴90 min(37℃恒温),摇匀;加入PBS终止反应,离心2次(1 000 r/min离心5 min),加入含2%胎牛血清PBS混匀;各组细胞加入PI(2μg/mL)。
1.2.4 SP分析 用流式细胞仪分析各组SP细胞比例,以355 nm波长激发Hoechst33342,用610 nm数字信号处理系统分色,450/40 nm带通收集蓝光,655 nm长通收集红光;以488 nm波长激发PI,575/26 nm带通收集红光。
1.3 统计学处理 应用SPSS19.0统计软件进行数据分析,计量资料以±s表表示,采用最小显著差数法两两比较分析。P<0.05为差异有统计学意义。
2 结 果
2.1 MCF-7肿瘤细胞系SP细胞比例 空白对照组无VerapamilMCF-7肿瘤细胞系SP细胞比例为(4.62±0.39)%。空白对照组有Verapamil MCF-7肿瘤细胞系SP细胞比例为(0.97±0.10)%,二者比较,差异有统计学意义(P<0.05)。扣除空白对照组有Verapamil显示的失活或死亡细胞比例即为MCF-7肿瘤细胞系SP细胞比例 [(3.65± 0.42)%],见图1。
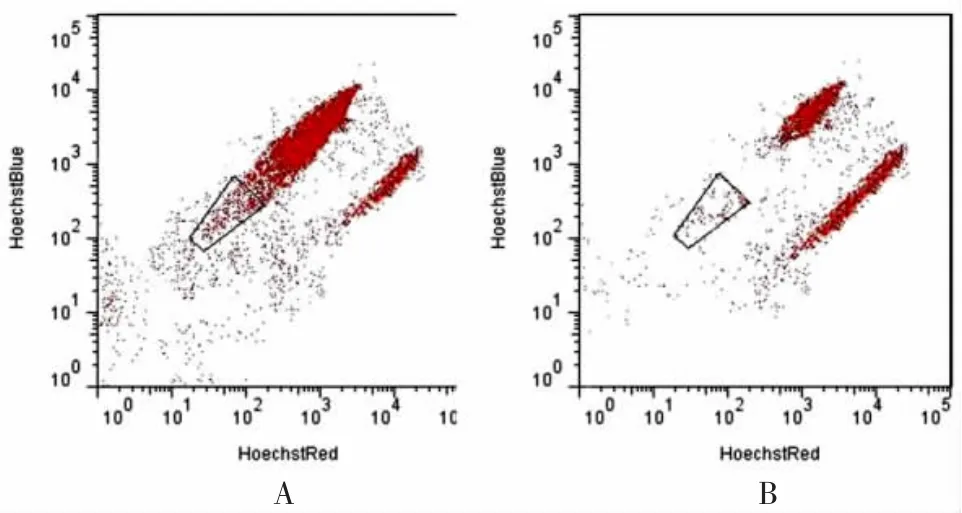
图1 人乳腺癌MCF-7肿瘤细胞系SP细胞比例
2.2 各组MCF-7肿瘤细胞系SP细胞比例比较 各组有、无Verapamil MCF-7肿瘤细胞系SP细胞比例比较,差异均有统计学意义(P<0.05),见表1。扣除各组有Ve rapamil显示的失活或死亡细胞比例,获得各组MCF-7肿瘤细胞系SP细胞比例,各组MCF-7肿瘤细胞系SP细胞比例比较,差异均有统计学意义(P<0.05),见表2。
表1 各组MCF-7肿瘤细胞系SP细胞比例比较(±s表,%)

表1 各组MCF-7肿瘤细胞系SP细胞比例比较(±s表,%)
注:与同组无Verapamil比较,aP<0.05。
组别空白对照组M e t组T a x o l组T A M组M e t联合T a x o l组M e t联合T A M组无V e r a p a m i l 有V e r a p a m i l 4 . 6 2 ± 0 . 3 9 1 . 6 0 ± 0 . 1 0 4 . 4 6 ± 0 . 1 8 4 . 6 7 ± 0 . 3 9 1 . 7 5 ± 0 . 1 3 1 . 7 3 ± 0 . 2 1 0 . 9 7 ± 0 . 1 0a0 . 8 8 ± 0 . 0 8a1 . 0 1 ± 0 . 1 7a1 . 1 2 ± 0 . 2 3a0 . 9 4 ± 0 . 1 0a0 . 8 5 ± 0 . 1 4a
表2 各组MCF-7肿瘤细胞系SP细胞比例比较(±s表,%)

表2 各组MCF-7肿瘤细胞系SP细胞比例比较(±s表,%)
注:各组间两两比较,aP<0.05;与非Met干预各组比较,bP<0.05。
试剂5%葡萄糖Met PBS Taxol TAM P 3.65±0.42a0.72±0.13ab3.45±0.32a0.74±0.16ab3.56±0.51a0.87±0.12ab>0.05>0.05
3 讨 论
SP细胞具有自我更新、多项分化、少量成瘤的干细胞特性,可通过腺苷三磷酸结合转运蛋白G超家族成员2(ATP-binding cassette superfamily G member 2,ABCG2)/乳腺癌耐药相关蛋白1的表达特异性地泵出某些染料,在荧光显微镜和流式细胞仪下表现为拒染或淡染[8-9]。本研究通过加入ABCG2抑制剂——Verapamil阻断SP细胞的外排染料功能,甄选出由于细胞活性降低、死亡导致的低染及拒染细胞,从而得到较为准确的MCF-7肿瘤细胞系SP细胞比例。本研究使用的355 nm紫外光位于 Hoechst33342的最佳激发波长范围之内(350~366 nm),相较于其他研究所使用的408 nm紫光所得的SP细胞比例较低,接近于国外相关研究结果[10-11]。
作为经实践证明可有效抑制MCF-7肿瘤细胞增殖的乳腺癌治疗常用药物的Taxol和TAM在本研究选取的小于半数有效剂量浓度并不能有效杀灭SP细胞。选用的0.3 mmol/L Met可抑制乳腺癌细胞生长,但对非转化乳腺上皮细胞无抑制作用[12-13],结果显示,该浓度Met可有效杀灭MCF-7肿瘤细胞系SP细胞,较之目前临床常用的乳腺癌治疗药物,Met具有新的特点和优势,对抑制乳腺癌干细胞药物的研究具有重要意义。
本研究设置了Met分别与Taxol、TAM联合干预组,且两组均可有效杀灭SP细胞。但未得出上述药物联用可产生协同作用的结果。Met与各药物联用能否在常规疗程内提高乳腺癌疗效、药物改性或合理搭配是否能进一步提高抗肿瘤作用尚有待于更深入的研究。
Met治疗糖尿病时的血药浓度一般维持于0.0028~0.015 0 mmol/L[14],而本研究浓度远高于正常治疗值。有研究发现,低浓度Met并不能影响AMPK的表达水平[4],亦有研究显示,只有长期持续应用Met的乳腺癌患者才可显现益处,多数患者用药时间达 5~10年[7]。由此可见,现有有效研究结果与临床安全用药范围存在较大差距,综合考虑疗效及不良反应,Met尚未达到治疗乳腺癌的临床应用标准。
同时作者注意到作为经济而简便的研究肿瘤干细胞的方法,SP法也具有一定的局限性,有研究表明,干细胞特性并不会体现在所有SP细胞中,SP表型也不会出现在所有肿瘤干细胞中[15-16]。SP法对实验条件要求十分严格,所使用的荧光染料Hoechst33342对许多细胞具有毒性作用,在实验中需根据研究对象的不同选择影响最小的染料浓度和适当的实验环境,以期获得更加准确的结果。
参考文献
[1]Zhang P,Li H,Tan X,et al.Association of metformin use with cancer incidence and mortality:a meta-analysis[J].Cancer Epidemiol,2013,37(3):207-218.
[2]Queiroz EA,Puukila S,Eichler R,et al.Metformin induces apoptosis and cell cycle arrest mediated by oxidative stress,AMPK and FOXO3a in MCF-7 breast cancer cells[J].PLoS One,2014,9(5):e98207.
[3]Hadad SM,Hardie DG,Appleyard V,et al.Effects of metformin on breast cancer cell proliferation,the AMPK pathway and the cell cycle[J].Clin Transl Oncol,2014,16(8):746-752.
[4]Rocha GZ,Dias MM,Ropelle ER,et al.Metformin amplifies chemotherapyinduced AMPK activation and antitumoral growth[J].Clin Cancer Res,2011,17(12):3993-4005.
[5]Hirsch HA,Iliopoulos D,Tsichlis PN,et al.Metformin selectively targets cancer stem cells,and acts together with chemotherapy to block tumor growth and prolong remission[J].Cancer Res,2009,69(19):7507-7511.
[6]Bosco JL,Antonsen S,Sorensen HT,et al.Metformin and incident breast cancer among diabetic women:a population-based case-control study in Denmark[J].Cancer Epidemiol Biomarkers Prev,2011,20(1):101-111.
[7]Bodmer M,Meier C Krähenbühl S,et al.Long-term metformin use is associated with decreased risk of breast cancer[J].Diabetes Care,2010,33(6):1304-1308.
[8]Wu CP,Zhou L,Xie M,et al.Identification of cancer stem-like side population cells in purified primary cultured human laryngeal squamous cell carcinoma epithelia[J].PLoS One,2013,8(6):e65750.
[9]Teshima K,Nara M,Watanabe A,et al.Dysregulation of BMI1 and micro-RNA-16 collaborate to enhance an anti-apoptotic potential in the side population of refractory mantle cell lymphoma[J].Oncogene,2014,33(17):2191-2203.
[10]Britton KM,Meyre R,Harvey IJ,et al.Breast cancer,side population cells and ABCG2 expression[J].Cancer Lett,2012,323(1):97-105.
[11]Patrawala L,Calhoun T,Schneider-Broussard R,et al.Side population is enriched in tumorigenic,stem-like cancer cells,whereas ABCG2+and ABCG2-cancer cells are similarly tumorigenic[J].Cancer Res,2005,65(14):6207-6219.
[12]Liu B,Fan Z,Edgerton SM,et al.Metformin induces unique biological and molecular responses in triple negative breast cancer cells[J].Cell Cycle,2009,8(13):2031-2040.
[13]Alimova IN,Liu B,Fan Z,et al.Metformin inhibits breast cancer cell growth,colony formation and induces cell cycle arrest in vitro[J].Cell Cycle,2009,8(6):909-915.
[14]Rizos CV,Elisaf MS.Metformin and cancer[J].Eur J Pharmacol,2013,705(1/2/3):96-108.
[15]Singh S,Bora-Singhal N,Kroeger J,et al.βArrestin-1 and Mcl-1 Modulate Self-Renewal Growth of Cancer Stem-Like Side-Population Cells in Non-Small Cell Lung Cancer[J].PLoS One,2013,8(2):e55982.
[16]Golebiewska A,Bougnaud S,Stieber D,et al.Side population in human glioblastoma is non-tumorigenic and characterizes brain endothelial cells[J]. Brain,2013,136(Pt 5):1462-1475.
Inhibitory effect of metformin on SP cells in tumor cell line MCF-7
Liu Chang,Zhou Enxiang
(Fujian Provincial Tumor Hospital,Fuzhou 350014,China)
ObjectiveTo investigate the killing effect of metformin,paclitaxel liposome and tamoxifen on SP cells in tumor cell line MCF-7 and their mutual synergistic effects.MethodsThe MCF-7 cells were performed the single or combined intervention with metformin(0.3 mmol/L),paclitaxel liposome(60.0 μg/L)and tamoxifen(10.0 μmol/L)respectively.The proportion of SP cells was tested by flow cytometry.ResultsThe proportions of SP cells in tumor cell line MCF-7 were different among the blank control group,metformin group,paclitaxel liposome group,tamoxifen group,metformin combined with paclitaxel liposome group and metformin combined with tamoxifen group,which in the metformin intervention groups was decreased compared with other groups,the differences were statistically significant(P<0.01);the proportion of SP cells had no statistical differences in the pairwise comparisons among the metformin intervention groups and the non-metformin intervention groups(P>0.05).Conclusion0.3 mmol/L metformin can effectively kill SP cells in tumor cell line MCF-7;the combined use of metformin with paclitaxil liposome or tamoxifen has no synergistic effects.
Mammary glands,human; Breast neoplasms; Cell line,tumor; Metformin; Tamoxifen; SP cells;Paclitaxil liposomen
10.3969/j.issn.1009-5519.2015.24.008
A
1009-5519(2015)24-3709-03
2015-10-30)
刘畅(1984-),男,福建南平人,硕士研究生,主要从事肿瘤外科临床工作;E-mail:darcyliu1984@live.com。
