花生栽培品种转录因子基因DREB1的克隆及表达载体构建
2015-07-18李文刘风珍万勇善等
李文 刘风珍 万勇善等
摘要:本研究从33个花生栽培品种中克隆获得干旱胁迫响应转录因子基因PNDREB1,经序列分析发现,33个栽培品种PNDREB1的核苷酸序列同源性为100%,并构建了植物表达载体pGBDREB1,为进一步研究该基因的功能奠定了基础。
关键词:花生;DREB1;植物表达载体
中图分类号:S565.2:Q785 文献标识号:A 文章编号:1001-4942(2015)01-0006-04
Abstract In this research, drought stress responsive transcription factor gene PNDREB1 were cloned from 33 peanut cultivars. Sequence analysis showed that the nucleotide sequence homology of PNDREB1 from 33 peanut cultivars was 100%. The plant expression vector pGBDREB1 was also constructed, which laid foundations for further research of the gene.
Key words Peanut; DREB1; Plant expression vector
花生(Arachis hypogaea L.)是我国重要的经济作物和油料作物,在国民经济中占重要地位。我国花生产区主要分布于干旱半干旱的丘陵地区,花生生长期间常受到不同程度的干旱胁迫,严重影响其生长发育和产量[1],是花生生产的首要限制因子。
干旱应答元件结合蛋白(dehydration responsive element binding protein,DREB)属于AP2/EREBP(乙烯应答元件结合蛋白)家族,含有高度保守的AP2区域,该区域特异性地与启动子中的DRE/CRT顺式作用元件结合,激活逆境相关基因的表达,提高作物的抗性。自Liu等[2]从拟南芥中分离到转录因子基因DREB1A和DREB2A,并发现该类基因的过表达可以有效提高转基因植物的抗逆性以来,DREB基因已经成为植物抗逆基因工程的研究热点。在水稻[3]、小麦[4]、玉米[5]、高粱[6]、白菜[7]、棉花[8]等作物中陆续有多个DREB基因被分离鉴定。Wang等[4]将DREB基因转化到小麦中,转基因小麦抗旱性明显升高,脯氨酸含量是对照的2倍。王晓飞[9]将大豆DREB基因转化到拟南芥中,发现干旱胁迫下转基因植株抗旱性增强,其脯氨酸含量、可溶性糖含量升高,丙二醛含量降低。
张梅等[10]从花生栽培品种鲁花14未成熟种子的cDNA文库中分离到一个DREB类基因——PNDREB1(FM955403)。该基因序列长度为687 bp,推测编码蛋白含有229个氨基酸残基,其AP2结构域具有和DRE元件特异性结合的能力,其C-末端片段具有转录激活活性,利用半定量RT-PCR技术进行基因表达模式分析显示,PNDREB1为组成型表达,能够被低温强烈、迅速诱导表达,对干旱胁迫也有一定程度的响应,但不能响应高盐和ABA信号。本研究克隆了33个花生栽培品种的DREB1基因,对其进行了序列多态性分析,并构建PNDREB1超表达的植物表达载体,为今后通过遗传转化进一步了解花生DREB1在响应干旱胁迫中的功能提供材料依据。
1 材料与方法
1.1 材料和试剂
供试材料为33个花生栽培品种(表1),由山东农业大学花生研究所提供。
植物表达载体pGBVE质粒和农杆菌菌株LBA4404由本实验室保存。限制性内切酶BamH Ⅰ购自Fermentas公司;限制性内切酶NotⅠ和T4 DNA连接酶购自Thermo公司。TIANgel胶回收试剂盒、TIAN prep质粒小提试剂盒、RNA prep pure植物总RNA提取试剂盒、Fast Quant RT Kit(with gDNase)购自天根生化科技有限公司;pEASY-T1 Vector、大肠杆菌菌株Trans1-T1、Eazy Taq高保真酶购自北京全式金生物技术有限公司;DL2000和DL5000 DNA Maker购自大连宝生物生物工程有限公司;其他试剂均为进口或国产分析纯。引物由上海生物工程有限公司合成,测序由北京六合华大基因科技有限公司进行。
1.2 试验方法
1.2.1 花生叶片总DNA提取 采用CTAB法提取花生幼嫩叶片的基因组DNA。
1.2.2 花生叶片总RNA提取 按照天根植物总RNA提取试剂盒的说明书并加以优化提取花生叶片总RNA,并用试剂盒反转录成cDNA。
1.2.3 花生DREB1基因的扩增 根据花生PNDREB1(FM955403)序列设计引物[9]DREBF:5′-ATGGACGTGGACCCG C-3′,DREBR:5′-GTTAGTAGGGAACTGACT CC-3′;以33个栽培品种基因组DNA和cDNA为模板,扩增PNDREB1的基因序列。PCR程序为94℃ 5 min;94℃ 30 s,57℃ 30 s,72℃ 50 min,35个循环;72℃ 10 min。
1.2.4 PCR产物的克隆测序 PCR扩增产物经1.0%琼脂糖凝胶电泳后,按照DNA胶回收试剂盒说明书回收,与pEASY-T1克隆载体连接,转化至大肠杆菌DH5α中进行抗卡那霉素筛选。挑选阳性单菌落,PCR检测鉴定后送北京六合华大基因科技有限公司测序,每个栽培品种选6~7个克隆。
1.2.5 PNDREB1植物表达载体的构建 以植物表达载体pGBVE为基础,用限制性内切酶BamH Ⅰ和NotⅠ进行双酶切,以PNDREB1基因片段代替γ-TMT(γ-维生素E甲基转移酶基因)构建由组成型启动子35S驱动PNDREB1表达的重组质粒。将重组质粒转入到农杆菌LBA4404感受态细胞中,筛选鉴定得到阳性克隆。植物表达载体构建路线图见图1。endprint
2 结果与分析
2.1 PNDREB1基因的克隆
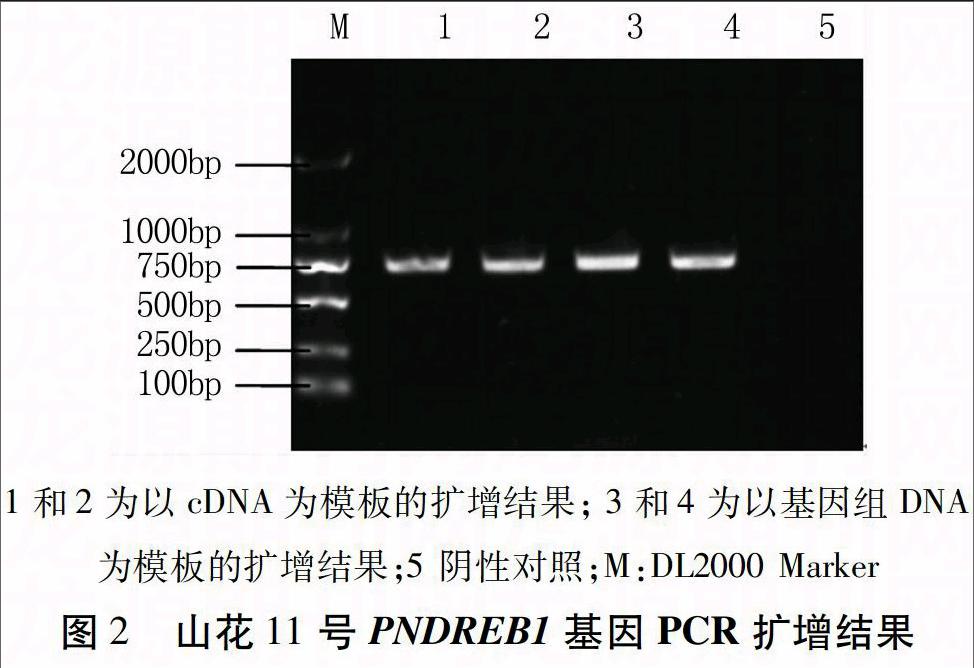
用引物DREBF和DREBR分别对山花11号基因组DNA和cDNA进行PCR扩增,琼脂糖凝胶电泳检测均获得约700 bp的特异性条带(图2),经克隆、测序获得PNDREB1的序列,PNDREB1基因全长687 bp,无内含子,编码蛋白包括229个氨基酸。
分别以33个花生栽培品种的基因组DNA和cDNA为模板进行PCR扩增,经克隆、测序检测,每个栽培品种均得到一条PNDREB1 DNA序列,序列一致性为100%。
2.2 PNDREB1基因植物表达载体的构建及检测
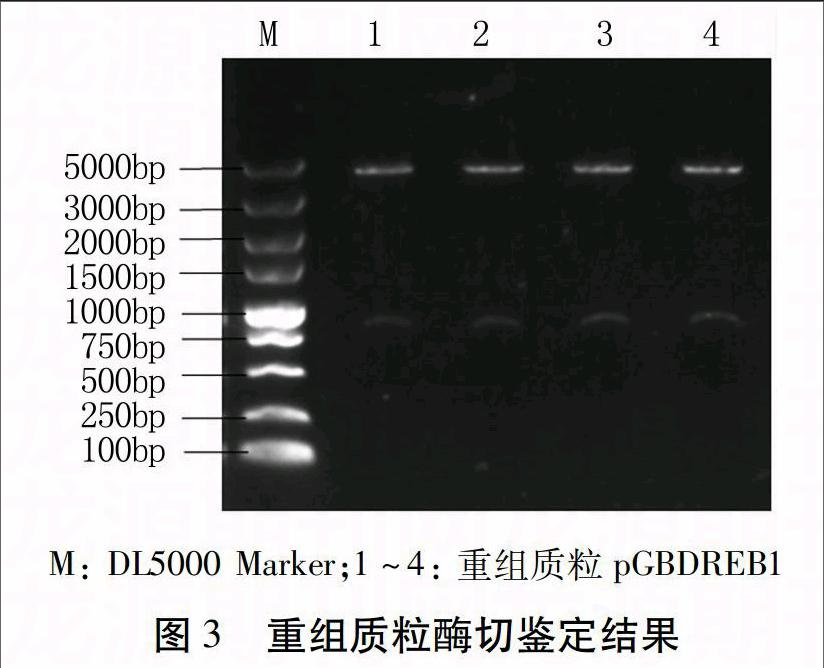
根据PNDREB1基因片段和pGBVE质粒序列特征以及pEASY-T1克隆载体所携带的限制性内切酶的种类,选择BamHⅠ和NotⅠ作为双酶切的限制性内切酶。酶切后pEASY-T1片段大小分别约为700 bp和3.9 kb,pGBVE分别为5 kb和2 kb,大小与预期相符。
将目的基因片段和质粒大片段分别回收、纯化,用T4 DNA连接酶连接,重组质粒转化大肠杆菌感受态细胞,筛选阳性克隆。对阳性克隆提取质粒,用限制性内切酶BamHⅠ和NotⅠ进行双酶切鉴定和测序验证,结果显示PNDREB1基因的正向序列已经替换了pGBVE质粒上的γ-TMT基因(图3),花生DREB1的过表达载体构建成功,命名为pGBDREB1。
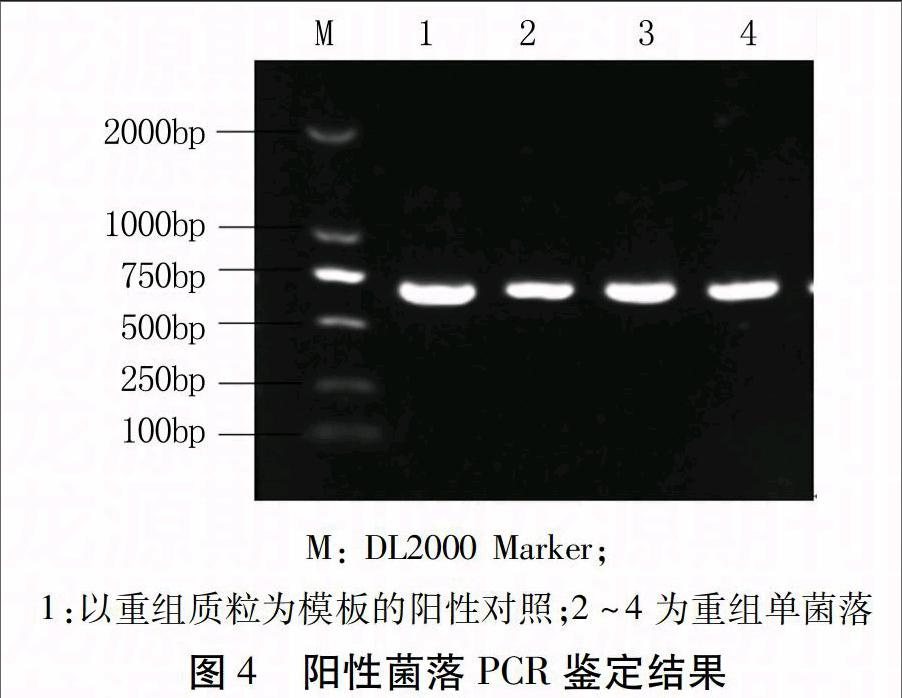
重组质粒pGBDREB1以冻融法转入农杆菌LBA4404感受态细胞中,筛选出阳性克隆。用引物DREBF/R对阳性单菌落进行PCR检测,得到700 bp左右的特异性条带(图4),表明重组质粒转化成功。
3 讨论
本研究克隆到的PNDREB1基因,全长687 bp,无内含子,编码229个氨基酸,与参考序列PNDREB1(FM955403)完全一致。花生栽培种是异源四倍体(AABB),由两个具有不同染色体组的二倍体野生种通过自然杂交,再经一次性加倍事件进化形成[14]。本研究在每个栽培种花生中只分离到一条PNDREB1序列,且33个栽培品种序列高度保守,推测该转录因子在植物中行使着非常重要的功能。
根据PNDREB1基因片段和pGBVE质粒序列特征以及pEASY-T1克隆载体所携带的限制性内切酶的种类,本研究选用BamHⅠ和NotⅠ进行双酶切,将γ-TMT基因切除,成功构建了带有Bar基因、由组成型启动子35S驱动的PNDREB1的植物表达载体pGBDREB1,并将重组载体导入根癌农杆菌LBA4404中,获得了阳性菌株,可用于花生遗传转化试验,为下一步研究PNDREB1基因的功能奠定了基础,为花生的抗旱育种提供了材料。
参 考 文 献:
[1]Nakashima K, Takasaki H, Mizoi J, et al. NAC transcription factors in plant abiotic stress responses[J]. Biochimica Biophys. Acta, 2012, 1819(2): 97-103.
[2]Liu Q, Kasuga M, Sakuma Y, et al. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought and low-temperature responsive gene expression, respectively, in Arabidopsis[J]. The Plant Cell, 1998, 10(8): 1391-1406.
[3]Chen J Q, Meng X P, Zhang Y, et al. Over-expression of OsDREB genes lead to enhanced drought tolerance in rice[J]. Biotechnol. Lett., 2008, 30(12): 2191-2198.
[4]Wang J W, Yang F P, Chen X Q. Induced expression of DREB transcriptional factor and study on its physiologycal effects of drought tolerance in transgenic wheat[J]. Acta Genetica Sinica, 2006, 33(5):468-476.
[5]Qin F, Sakuma Y, Li J, et al. Cloning and functional analysis of a novel DREB1/CBF transcription factor involved in cold-responsive gene expression in Zea mays L.[J]. Plant Cell Physiol., 2004, 45(8): 1042-1052.
[6]谢登雷, 崔江慧, 常金华. 高粱中SbDREB2基因的克隆与表达分析[J]. 作物学报, 2013, 39(8): 1352-1359.
[7]刘晓颖, 陈丽媛, 张竞秋, 等. 白菜脱水应答转录因子BpDREB1基因的克隆及功能研究[J]. 作物学报, 2013, 39(2): 230-237.
[8]李付振, 邱新棉, 刘传亮. 棉花中一个新的类DREB转录因子(GhDREB2B)的克隆、序列特征及表达分析[J]. 浙江农业学报, 2010, 22(5):564-569.
[9]王晓飞. 大豆GmDREB转录因子基因的功能与作用机制分析[D]. 北京:中国农业科学院, 2008.
[10]张梅, 刘炜, 毕玉平, 等. 花生中DREB类转录因子PNDREB1的克隆及鉴定[J]. 作物学报, 2009, 35(11): 1973-1980.
[11]厉广辉, 万勇善, 刘风珍, 等. 不同抗旱性花生品种根系形态及生理特性[J].作物学报, 2014, 40(3):531-541.
[12]厉广辉, 张昆, 刘风珍, 等. 不同抗旱性花生品种的叶片形态及生理特性[J]. 中国农业科学, 2014, 47(4): 644-654.
[13]张秀荣. 花生Cu/Zn-SOD基因分子特征及其表达差异分析[D]. 泰安:山东农业大学, 2013.
[14]Moretzsohn M C, Gouvea E G, Inglis P W, et al. A study of the relationships of cultivated peanut (Arachis hypogaea) and its most closely related wild species using intron sequences and microsatellite markers[J]. Annals of Botany, 2013, 111: 113-126.endprint
