拟南芥IAA7 的原核表达及稳定性分析
2015-07-13刘会珍罗为桂谢伟民胡月清苏益萧浪涛蔺万煌
刘会珍,罗为桂,谢伟民,胡月清,苏益,萧浪涛,蔺万煌
(湖南农业大学植物激素与生长发育湖南省重点实验室,湖南 长沙 410128)
植物生长素是最早被发现的一类植物激素,其中IAA(indole–3–acetic acid)是主要的活性物质[1]。作为信号分子,IAA 在植物胚胎中轴建立[2]、侧生器官形成[3]、叶序排列[4]、维管束发育[5]、向光反应[6]以及根向重力[7]等方面都发挥着重要的调节作用。近年来,有关生长素生物合成和信号转导途径的研究取得了巨大的进展,生长素信号转导级联反应的基本轮廓已经形成[8]。在生长素信号转导途径中包含一类重要的转录抑制因子AUX/IAAs[9–12],它能与生长素受体TIR1(transport inhibitor response 1)形成共受体[13–15]。Aux/IAA 蛋白具有4个结构域(DI、DII、DIII 和DⅣ),在低浓度IAA 环境中,Aux/IAA 与多个生长素响应因子(ARFs)形成复合物,可阻碍响应IAA 的相关基因的转录[16–18];Aux/IAA 又是一种短命的核蛋白,在高浓度IAA 环境中,IAA 就像分子胶一样可促使 SCFTIR1与Aux/IAA 相互结合,诱发Aux/IAA 蛋白的泛素化降解,从而解除对生长素应答基因的阻遏作用[19–20]。
目前,模式植物拟南芥的IAA1[21]、IAA4[22]、IAA7[23]、IAA9[24]和IAA28[25]等Aux/IAA 蛋白质家族成员的重要功能已经有了较详细的解析。Aux/IAA 蛋白与AtTIR1、AFB1 和AFB3 等蛋白具有较强的相互作用[19],并且这种结合与生长素信号紧密相关,这就预示着Aux/IAA 蛋白可能具有重要的实际应用价值。据此,本研究中构建IAA7 的原核表达载体,在大肠杆菌中表达IAA7 蛋白,通过GST 亲和树脂获得纯化的IAA7 蛋白,旨在为后续对IAA7 的应用研究提供依据。
1 材料和方法
1.1 材料
拟南芥(Arabidopsis thaliana L.) 野生型Columbia(Col–0);大肠杆菌(Escherichia coli)克隆菌株 DH5α;大肠杆菌表达菌株 Tuner(DE3)、Rosetta(DE3) 、 BL21(DE3) 及 原 核 表 达 载 体pGEX–KG。以上材料均由湖南农业大学植物激素与生长发育湖南省重点实验室保存。
Trizol 试剂购自Life Technologies 公司;反转录酶、DNA 限制性内切酶和T4DNA 连接酶等系TaKaRa(大连)公司产品;Pfu DNA 聚合酶、蛋白质分子量标准(marker protein rulerⅡ)及其他分子生物学相关试剂盒均购自北京全式金生物技术有限公司;GST SefiroseTMresin 亲和树脂购自上海生物工程有限公司;凝血酶购自Sigma 公司;引物合成及DNA 测序由华大基因公司完成。
1.2 方法
1.2.1 引物的合成及原核表达载体的构建
根据TAIR(http://www.arabidopsis.org/)数据库中公布的AtIAA7 序列以及质粒pGEX–KG 图谱设计PCR引物: 5′–ggatccATGCAGAAGCGAATAGCCTT G–3′ 和 5′–gaattcTTATAATCCGTTAGTAGTAATG– 3′,其中酶切位点BamHI 和EcoRI 用小写字母表示。
采用Trizol 法提取野生型拟南芥总RNA,反转录获得cDNA,以cDNA 为模板扩增IAA7 基因。用限制性内切酶BamHI 和EcoRI 对PCR 产物及载体质粒pGEX–KG 分别进行双酶切,琼脂糖凝胶回收目的DNA,用T4DNA 连接酶将IAA7 连接入pGEX–KG 载体,筛选并测序正确后,利用热激法将重组质粒PGEX–KG/GST–IAA7 分别转化入3 种大肠杆菌表达菌株Rosetta、BL21 和Tuner 中。
1.2.2 融合蛋白的诱导表达
取37℃过夜培养的含重组质粒的菌液,按1∶500 接种于新的LB 培养液(含100mg/L 的氨苄青霉素)中,37℃、200 r/min 振荡培养至菌液OD600nm约为0.6。于不同温度(16、25、37℃)和不同IPTG诱导浓度(0.2、0.4、0.6 mmol/L)条件下,200 r/min振荡培养至菌液OD600nm约为1.0,即可诱导蛋白质表达。
1.2.3 融合蛋白的纯化
收集菌液,离心弃上清,用PBS(pH7.4)缓冲液清洗沉淀3次,按0.1g 沉淀加1mL PBS(pH7.4)缓冲液的比例重悬菌体,超声波破碎细胞,4℃、13 000g、5min 离心后取上清,按上清体积的1/20 加入GST SefiroseTMresin 树脂,4℃孵育1 h,使GST–IAA7 与树脂充分结合,离心取沉淀并用等体积的PBS(pH7.4)缓冲液清洗5次,GST SefiroseTMresin 树脂中即包含了纯化后的GST–IAA7 融合蛋白。
1.2.4 GST 标签的切除
取结合有 GST–IAA7 融合蛋白的 GST SefiroseTMresin 树脂,按每1mL GST SefiroseTMresin 树脂加入10 U 的凝血酶和 3mL PBS(pH7.4)缓冲液的比例进行蛋白质酶切反应,反应温度为22℃,反应时间为6 h[26],离心收集反应容器中的上清,即为切除GST 标签后的IAA7 蛋白质溶液。
2 结果与分析
2.1 IAA7 基因原核表达载体的鉴定
用限制性内切酶BamHI 和EcoRI 双酶切鉴定pGEX–KG/GST–IAA7 重组质粒,酶切片段符合预期设想(图1)。将酶切阳性的重组质粒送华大基因公司测序,基因序列与GenBank 中公布序列完全匹 配,证明pGEX–KG/GST–IAA7 重组表达载体构建成功。最后成功转入Rosetta、BL21 和Tuner 3 种原核表达菌株中。

表1 表达载体的双酶切鉴定结果 Fig.1 Detection result of construction through double digestion
2.2 GST–IAA7 融合蛋白的诱导表达及纯化
2.2.1 温度对GST–IAA7 融合蛋白表达的影响
参照以往的蛋白质原核表达经验,以pGEX–KG载体为基础骨架构建的表达载体,重组蛋白一般在约0.4 mmol/L 的IPTG 诱导下可大量表达[27–28],故本研究中首先固定IPTG 浓度为0.4 mmol/L,在不同温度(16、25、37℃),不同大肠杆菌表达菌株(Tuner、Rosetta、BL21)中诱导GST–IAA7 的表达,其中,GST 相对质量约26 000,IAA7 相对质量约26 400,因此,GST–IAA7 融合蛋白约为52 400。由图2 可知,无论在何种诱导温度下,GST–IAA7 在3 种菌株中都能高效表达,但在Rosetta 中的表达比在Tuner和BL21 中的好,能满足后续纯化的需要,因此,选择Rosetta 菌株为GST–IAA7 的最适表达菌株。另外,在16、25 和37℃条件下,GST–IAA7 在Rosetta 中均能较好表达,鉴于温度越高蛋白质活性越低,一般应避免在30℃以上表达蛋白,温度太低又会导致细菌生长缓慢,降低蛋白总产量,故选择16 ~25℃为GST–IAA7 的诱导温度。

图2 不同温度下GST–IAA7 的诱导表达 Fig.2 Expression of GST–IAA7 at different temperatures
2.2.2 诱导剂IPTG 对GST–IAA7 融合蛋白表达的影响
诱导剂IPTG 是影响蛋白质表达的另一种重要因素,因此,确定了诱导GST–IAA7 表达的温度条件后,进一步讨论诱导剂IPTG 对GST–IAA7 融合蛋白表达的影响。为了便于条件控制,固定诱导温度为25℃,设置0.2、0.4、0.6 mmol/L 3个不同IPTG浓度诱导GST–IAA7 表达。由图3 可以看出,在25℃诱导条件下,GST–IAA7 在Rosetta 中表达较好,其中0.4 mmol/L IPTG 诱导条件下GST–IAA7 表达量最多。

图3 不同IPTG 浓度下GST–IAA7 的诱导表达 Fig.3 Expression of GST–IAA7 at different concentrations of IPTG
综合上述结论,后续研究选用Rosetta 菌株表达 GST–IAA7 融合蛋白,最佳诱导条件为 0.4 mmol/L IPTG、16 ~25℃。在此诱导条件下,对所表达的融合蛋白进行定量分析,如图4 所示。0.1g Rosetta 菌体在1mL PBS(pH 7.4)缓冲液中经超声波破碎后,取10 µL 上清与10 µL 上样缓冲液充分混合, 取10 µL 混合液点样,GST–IAA7 蛋白质含量与0.4mg/mL 的BSA 标准样品的相当,经折算,GST–IAA7 蛋白质总含量可达1.6mg,占菌体总质量的1.6%,能满足后续大量纯化的要求。
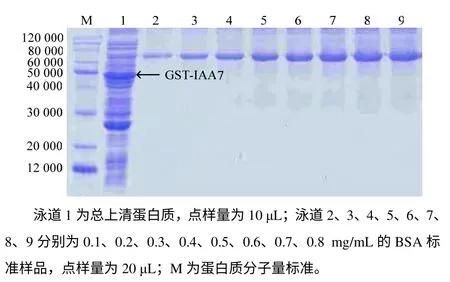
图4 GST–IAA7 定量分析结果 Fig.4 Quantitative analysis of GST–IAA7
2.3 苯甲基磺酰氟(PMSF)对GST–IAA7 融合蛋白降解的影响
IAA7 作为一种短命的核蛋白,在植物体内容易通过泛素化途径降解。前期研究发现,IAA7 在PBS(pH 7.4)缓冲液中随保存时间的增加而快速降解,严重阻碍了后续对IAA7 的应用研究。为了解决这一问题,本试验中在纯化出的GST–IAA7 蛋白中加入蛋白酶抑制剂——苯甲基磺酰氟(终浓度为1 mm/L),于4℃放置,每12 h 取样1次,分析PMSF溶液对GST–IAA7 蛋白降解的影响。由图5–A 和图5–B 可以看出,加有PMSF 的GST–IAA7 融合蛋白在2 d 内几乎没有降解,在5 d 内降解一半;由图5–C和图5–D 可以看出,不加PMSF 的GST–IAA7 融合蛋白在2 d 内即可降解一半,在4 d 内几乎完全降解,因此,苯甲基磺酰氟(PMSF)可大大延长GST–IAA7 融合蛋白体外(温度为4℃)保存的时间。但是,由于蛋白质随着时间的延长和温度的升高,其活性和稳定性会降低,因此,应该在4℃短时(暂时)保存GST–IAA7 融合蛋白和IAA7 蛋白,而在–80℃长期保存。

图5 PMSF 对GST–IAA7 蛋白稳定性的影响 Fig.5 Impact of PMSF on the stability of GST–IAA7 protein
2.4 GST 标签的切除
用GST SefiroseTMresin 树脂可对表达菌株中产生的GST–IAA7 进行分离纯化,GST–IAA7 可特异地结合在亲和树脂上。为了得到单一的IAA7 蛋白溶液用于后续研究,还需将IAA7 从柱床中分离开 来,因此,本研究在体外用凝血酶切除了GST 标签,如图6 所示。酶切后,上清中蛋白质的相对质量近似于IAA7 相对质量的大小(26 400),GST 树脂的相对质量近似于GST 蛋白标签相对质量的大小(26 000),这与预期结果一致,证明酶切成功。

图6 IAA7 蛋白分离 Fig.6 Isolation of IAA7 protein
3 结论与讨论
随着蛋白质组学的快速发展,以微生物(如大肠杆菌、酵母等)、昆虫细胞系(如果蝇胚胎细胞系、蛾胚胎细胞)以及哺乳动物细胞系为载体的蛋白质重组技术已经日趋成熟,其亦成为了蛋白质功能研究及其应用的基本手段[29–30]。通常情况下,在大肠杆菌表达菌株中表达异源重组蛋白是首选方案,因为利用E.coli 表达重组蛋白具有培养要求低、生长速度快、蛋白质产量高、试剂耗材价格低廉的优点,这保证了研究中能快速获得大量活性重组蛋白,既提高了效率,又可节省成本。另外,蛋白质标签的发现和应用,进一步为重组蛋白的鉴定及快速、高效纯化提供了便利。目前,常用的蛋白质标签有
His–tag、Flag–tag、HSV–tag、S–tag、MBP–tag、GST–tag 等,其中,具有亲和性高、技术成熟、操作快捷的GST 融合表达目的蛋白质的方式被普遍使用。由于pGEX 系列和pIEx 系列表达载体本身已经含有GST 标签序列,并且还包括了thrombin (Tb) 和enterokinase (Ek) 等蛋白质酶切位点,可以一步完成标签的切除,因此,本研究中以pGEX–KG为基础构架构建表达载体,选用常用的大肠杆菌表达菌株Tuner、Rosetta、BL21 表达重组蛋白,用GST 的亲和树脂纯化融合蛋白,并利用thrombin 切除GST 标签获得目的蛋白。
影响重组蛋白原核表达的因素很多,客观条件主要包括诱导剂浓度、诱导温度、表达菌株基因型及培养基等。过低浓度的IPTG 对细菌的刺激不够,从而导致重组蛋白表达量较少;过高浓度的IPTG对细胞具有毒性,同样会降低重组蛋白产量。前人的研究[27–28]表明,在大肠杆菌中表达重组蛋白质时,诱导剂IPTG 浓度一般都在0.4 mmol/L 左右,本研究的结果与前人的研究结果基本一致。诱导温度主要通过影响细菌的生长速度来影响蛋白质表达,对于异源重组蛋白质的原核表达,一般选择较低的诱导温度,这可以较好的保证蛋白质的生物活性[31]。如果温度过高,细胞快速生长,蛋白质的快速产生,还可能使更多的重组蛋白沉积于包涵体中,不利于蛋白质分离纯化。培养基成分也可能影响蛋白质表达,如在配制用于原核表达的LB 培养基时,必须用peptone 代替tryptone。当然,不同基因型的大肠杆菌株系对某种异源蛋白质的生产能力也可能有差别。另外,目的蛋白本身的肽链长度、毒性强弱以及类别也会影响其表达,对于毒性蛋白和膜蛋白,通常情况下不宜做原核表达,而改用真核系统。本研究中的IAA7 蛋白质为核蛋白,分子量较小,对细胞没有毒害作用,因此选用原核表达系统比较经济适用。
Aux/IAAs家族蛋白是生长素信号转导中调节基因表达的核心因子之一,其功能的研究对于解析整个生长素信号转导过程至关重要[32]。Aux/IAAs在植物体内存在的时间很短,在较高的生长素浓度条件下,其与TIR1 结合,从而通过泛素化途径快速降解[18]。为了能在体外进一步研究Aux/IAAs 的一些功能和特性,本研究中对IAA7 进行了原核表达,同时对其在PBS(pH 7.4)缓冲液中的稳定性进行了分析,发现蛋白酶抑制剂PMSF 可显著增加IAA7在体外的稳定性。
[1] Bargmann B O R,Estelle M.Auxin perception:In the IAA of the beholder[J].Physiol Plantarum,2014,151(1):52–61.
[2] Friml J.Auxin transport-shaping the plant[J].Curr Opin Plant Biol,2003,6(1):7–12.
[3] Benková E,Michniewicz M,Sauer M,et al.Local,efflux-dependent auxingradients as a common module for plant organ formation[J].Cell,2003,115(5):591–602.
[4] Reinhardt D,Pesce E R,Stieger P,et al.Regulation of phyllotaxis by polar auxin transport[J].Nature,2003,426(6964):255–260.
[5] Mattsson J,Ckurshumova W,Berleth T.Auxin signaling in Arabidopsis leaf vascular development[J].Plant Physiol,2003,131(3):1327–1339.
[6] Blakeslee J J,Peer W A,Murphy A S.Auxin transport[J].Curr Opin Plant Biol,2005,8(5):494–500.
[7] Takahashi H,Miyazawa Y,Fujii N.Hormonal interactions during root tropicgrowth:hydrotropism versusgravitropism[J].Plant Mol Biol,2009,69(4):489–502.
[8] Nakayama N,Smith R S,Mandel T,et al.Mechanical regulation of auxin-mediatedgrowth[J].Curr Biol,2012,22(16):1468–1476.
[9] Mockaitis K,Estelle M.Auxin receptors and plant development:A new signaling paradigm[J].Annu Rev Cell Dev Bi,2008,24:55–80.
[10] Dreher K A,Brown J,Saw R E,et al.The Arabidopsis Aux/IAA protein family has diversified in degradation and auxin responsiveness[J].Plant Cell,2006,18(3):699–714.
[11] Gray W M,Kepinski S,Rouse D,et al.Auxin regulates SCFTIR1-dependent degradation of AUX/IAA proteins[J]. Nature,2001,414(6861):271–276.
[12] Goh T,Kasahara H,Mimura T,et al.Multiple AUX/IAA–ARF modules regulate lateral root formation:the role of Arabidopsis SHY2/IAA3–mediated auxin signaling[J].Phil Trans R Soc B,2012,367(1595):1461–1468.
[13] Villalobos L I A C,Lee S,De Oliveira C,et al.A combinatorial TIR1/AFB–Aux/IAA co-receptor system for differential sensing of auxin[J].Nat Chem Biol,2012,8(5):477–485.
[14] Shimizu-Mitao Y,Kakimoto T.Auxin sensitivities of all Arabidopsis Aux/IAAs for degradation in the presence of every TIR1/AFB[J].Plant Cell Physiol,2014,55(8):1450–1459.
[15] Lee S,Sundaram S,Armitage L,et al.Defining binding efficiency and specificity of auxins for SCFTIR1/AFB– Aux/IAA co-receptor complex formation[J]. ACS Chem Biol,2013,9(3):673–682.
[16] Dos Santos Maraschin F,Memelink J,Offringa R. Auxin-induced,SCFTIR1-mediated poly-ubiquitination marks AUX/IAA proteins for degradation[J].Plant J,2009,59(1):100–109.
[17] Rosquete M R,Barbez E,Kleine-Vehn J.Cellular auxin homeostasis:Gatekeeping is housekeeping[J].Mol Plant,2012,5(4):772–786.
[18] Tan X,Calderon-Villalobos L I A,Sharon M,et al. Mechanism of auxin perception by the TIR1 ubiquitin ligase[J].Nature,2007,446(7136):640–645.
[19] Hayashi K I.The interaction and integration of auxin signaling components[J].Plant Cell Physiol,2012,53(6):965–975.
[20] Causier B,Ashworth M,Guo W,et al.The TOPLESS interactome:A framework forgene repression in Arabidopsis[J].Plant Physiol,2012,158(1):423–438.
[21] Shi H,Wang Y,Li Z,et al.Pear IAA1gene encoding an auxin-responsive Aux/IAA protein is involved in fruit development and response to salicylic acid[J].Can J Plant Sci,2014,94(2):263–271.
[22] Song Y,Xu Z F.Ectopic overexpression of an AUXIN/INDOLE–3–ACETIC ACID (Aux/IAA)gene OsIAA4 in rice induces morphological changes and reduces responsiveness to Auxin[J].Int J Mol Sci,2013,14(7):13645–13656.
[23] Belin C,Megies C,Hauserová E,et al.Abscisic acid repressesgrowth of the Arabidopsis embryonic axis aftergermination by enhancing auxin signaling[J].Plant Cell,2009,21(8):2253–2268.
[24] Wang H,Jones B,Li Z,et al.The tomato Aux/IAA transcription factor IAA9 is involved in fruit development and leaf morphogenesis[J].Plant Cell,2005,17(10):2676–2692.
[25] Rogg L E,Lasswell J,Bartel B.Again-of-function mutation in IAA28 suppresses lateral root development[J]. Plant Cell,2001,13(3):465–480.
[26] Chaubey N,Ghosh S S.Molecular cloning,purification and functional implications of recombinant GST tagged hGMCSF cytokine[J].Appl Biochem Biotechnol,2013,169(5):1713–1726.
[27] Wang C,Yoon S H,Jang H J,et al.Metabolic engineering of Escherichia coli for α-farnesene production[J].Metab Eng,2011,13(6):648–655.
[28] 赵欣,刘会珍,罗为桂,等.生长素结合蛋白AtTIR1和IAA28 的原核表达及纯化[J].湖南农业大学学报:自然科学版,2013,39(6):609–614.
[29] Mena J A,Aucoin M G,Montes J,et al.Improving adeno-associated vector yield in high density insect cell cultures[J].J Gene Med,2010,12(2):157–167.
[30] Pina A S,Lowe C R,Roque A C A.Challenges and opportunities in the purification of recombinant tagged proteins[J].Biotechnol Adv,2014,32(2):366–381.
[31] 张毅,屈贤铭,杨胜利.乳糖作为诱导剂对重组目的蛋白表达的影响[J].生物工程学报,2000,16(4):464–468.
[32] Calderon-Villalobos L I,Tan X,Zheng N,et al.Auxin perception: Structural insights[J].CSH Perspectives,2010,2(7):a005546.
