p16、p53、Ki-67和血清SCC-Ag在宫颈鳞癌中的表达及意义
2015-07-12冯砯锦钱春妹王锦波成佳景
吕 嘉, 冯砯锦, 钱春妹, 王锦波, 曹 梅, 成佳景
(1. 同济大学附属第十人民医院妇产科,上海 200072; 2. 同济大学附属第十人民医院病理科,上海 200072)
·基础研究·
p16、p53、Ki-67和血清SCC-Ag在宫颈鳞癌中的表达及意义
吕 嘉1, 冯砯锦2, 钱春妹1, 王锦波1, 曹 梅1, 成佳景1
(1. 同济大学附属第十人民医院妇产科,上海 200072; 2. 同济大学附属第十人民医院病理科,上海 200072)
目的 探讨p16、p53、Ki-67和血清鳞状细胞癌抗原(squamous cell carcinoma antigen, SCC-Ag)在宫颈鳞癌患者中的表达及意义。方法 采用免疫组织化学法检测31例宫颈鳞癌与31例宫颈炎组织中p16、p53、Ki-67的表达,同时采用化学发光微粒子免疫法检测治疗前的血清SCC-Ag水平。结果 (1) 宫颈炎和宫颈鳞癌中p16、p53、Ki-67、SCC-Ag的阳性率分别为0%、0%、12.9%、0%和96.8%、48.4%、100%、71%,两组比较有显著差异(P<0.05)。(2) p53高表达与淋巴结或脉管转移有关,Ki-67表达随组织学分级升高而升高,血清SCC-Ag水平随临床分期升高而升高(P<0.05)。(3) 经Spearman等级相关分析,p16染色强度与血清SCC-Ag水平呈正相关(r=0.467,P<0.05),在临床Ⅰ期宫颈鳞癌中,两者间正相关更显著(r=0.59,P<0.05)。结论 P53、Ki-67、血清SCC-Ag与宫颈鳞癌发展的恶性程度相关,其在表达上的差异与肿瘤生物学行为有一定关系,宫颈鳞癌在发生发展过程中,尤其是早期阶段,p16与血清SCC-Ag可能有协同作用。
宫颈鳞肿瘤; p16; p53; Ki-67; SCC-Ag
宫颈癌是我国女性最常见的妇科恶性肿瘤,由于筛查技术的普及和提高,诊断时多为早期,约80%为鳞状细胞癌[1]。宫颈癌的形成发展和侵袭转移是一个多环节多步骤的复杂过程,与抑癌基因突变、肿瘤抑制蛋白功能异常、细胞增殖凋亡失调、细胞产生的蛋白酶类水平等关系密切。p16、p53是细胞周期调控的关键蛋白,可维持基因稳定、诱导细胞增殖或凋亡;Ki-67作为细胞增殖核抗原,是反映细胞增殖状态的重要指标;鳞状细胞癌抗原(squamous cell carcinoma antigen, SCC-Ag)是一类具有丝氨酸蛋白酶抑制作用的糖蛋白,可抑制炎症反应、保护上皮细胞、抗凋亡。本研究通过联合分析p16、p53、Ki-67和血清SCC-Ag在宫颈鳞癌患者中的表达特点及相关性,探讨其间的可能机制及临床意义。
1 材料与方法
1.1 一般资料
选择2011年1月至2014年12月经宫颈组织病理学检查诊断为宫颈鳞癌而入我院首次接受宫颈癌根治手术的患者31例为研究对象,全部患者术前无放、化疗病史,年龄37~68岁,中位年龄50岁。依据2009年国际妇产科联盟临床分期,Ⅰ期18例、Ⅱ期13例;高分化4例、中分化20例、低分化7例;最终病理诊断累及淋巴结或脉管8例,无累及23例。取同时间段组织病理诊断为宫颈炎的患者31例作为对照,年龄33~71岁,中位年龄52岁。
1.2 方法
组织标本经常规中性福尔马林固定,石蜡包埋后制成4μm厚切片,H-E染色镜检。p16、p53和Ki-67单克隆抗体购自DAKO公司。采用免疫组织化学SP法染色,具体步骤按说明书进行,抗体工作浓度为1∶100,用磷酸盐缓冲液代替一抗作阴性对照。
p16染色阳性信号主要位于肿瘤细胞的胞核与胞浆,p53及Ki-67的染色阳性信号主要位于肿瘤细胞的胞核,均呈棕褐色颗粒。在显微镜高倍视野下,每种免疫染色选择10个有代表性的视野,每个视野计数100个肿瘤细胞,根据Ki-67阳性细胞数的比例可分为以下几个级别: (-)瘤细胞染色阴性或<5%的瘤细胞有少量着色,(+)5%~25%瘤细胞呈阳性,(++)26%~75%瘤细胞阳性,(+++)>75%瘤细胞阳性且着色程度较强。根据p16和p53的阳性细胞数比例可分为以下几个级别: (-)瘤细胞染色阴性或<10%的瘤细胞有少量着色,(+)10%~50%瘤细胞呈阳性,(++)>50%瘤细胞阳性且着色程度较强。
血清标本采自患者治疗前的肘静脉血,SCC-Ag试剂盒购自Abbott公司,采用化学发光微粒子免疫法定量测定血清SCC-Ag,其正常上限为1.5ng/mL。
1.3 统计学分析
采用Fisher’s精确检验与Spearman等级相关分析,显著性水平α=0.05,统计分析应用SPSS20软件。
2 结 果
2.1 p16的免疫组化结果
p16蛋白在宫颈鳞癌组织中主要位于肿瘤细胞的胞核与胞浆(图1A),其表达情况见表1。在宫颈鳞癌中p16的阳性率为96.8%,宫颈炎中为0%,两者差异显著(P<0.05)。在宫颈鳞癌各临床病理因素之间,p16的表达差异无显著性(P>0.05)。
2.2 p53的免疫组化结果
p53蛋白在宫颈鳞癌组织中位于肿瘤细胞的胞核(图1B),其表达情况,见表2。在宫颈鳞癌和宫颈炎中,p53的阳性率分别为48.4%和0%,两者差异显著(P<0.05)。在宫颈鳞癌各临床病理因素之间,p53的表达差异无显著性(P>0.05),但是p53染色++,即强阳性的比率在淋巴结脉管转移阳性组为50%,而淋巴结脉管转移阴性组为8.7%,两组差异显著(P=0.01)。

图1 宫颈鳞癌的免疫组织化学染色(×200)Fig.1 Immunohistochemical staining for cervical squamous cell carcinoma(×200)A: p16阳性;B: p53阳性;C: Ki-67阳性
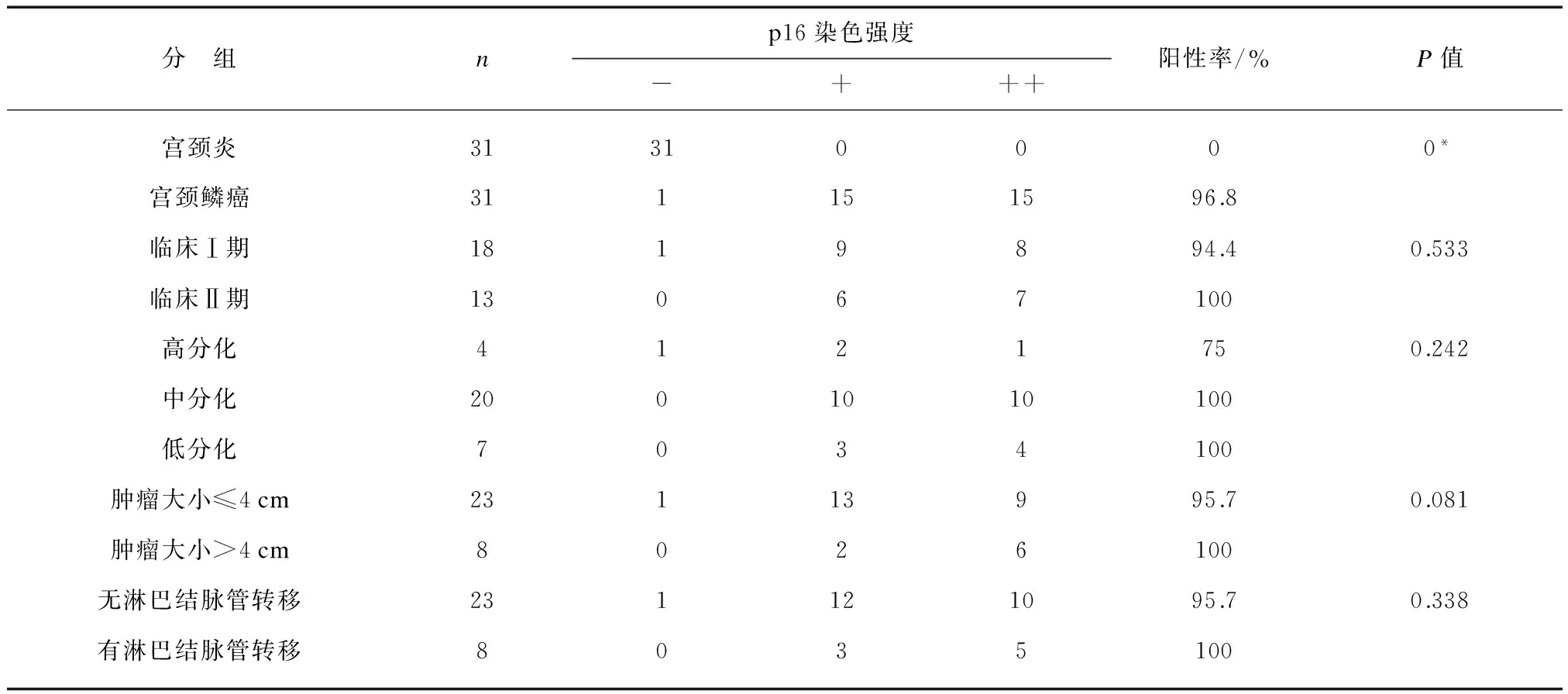
分 组np16染色强度-+++阳性率/%P值宫颈炎31310000*宫颈鳞癌311151596.8临床Ⅰ期1819894.40.533临床Ⅱ期13067100高分化4121750.242中分化2001010100低分化7034100肿瘤大小≤4cm23113995.70.081肿瘤大小>4cm8026100无淋巴结脉管转移231121095.70.338有淋巴结脉管转移8035100
P值经Spearman等级相关分析,*P<0.05

表2 p53在宫颈鳞癌和宫颈炎组织中的表达及其与各病理因素的关系
P值经Spearman等级相关分析,*P<0.05
2.3 Ki-67的免疫组化结果
Ki-67阳性信号主要位于肿瘤细胞的胞核(图1C),其表达情况见表3。Ki-67在宫颈炎、宫颈鳞癌中的阳性率分别为12.9%和100%,宫颈鳞癌中的表达水平显著高于对照组(P<0.05)。经Spearman等级相关分析,Ki-67与组织学分级显著相关(r=0.501,P=0.004);但ki-67在其他临床病理因素之间的表达差异无显著性(P>0.05)。
2.4 SCC-Ag的化学发光微粒子免疫结果
血清SCC-Ag的表达情况见表4。在宫颈鳞癌中,血清SCC-Ag的阳性率显著高于对照组(P<0.05)。经Spearman等级相关分析,血清SCC-Ag与临床分期呈正相关(r=0.4,P=0.026),即临床分期越晚,血清SCC-Ag水平越高;但血清SCC-Ag阳性率在其他临床病理因素之间无显著性差异(P>0.05)。
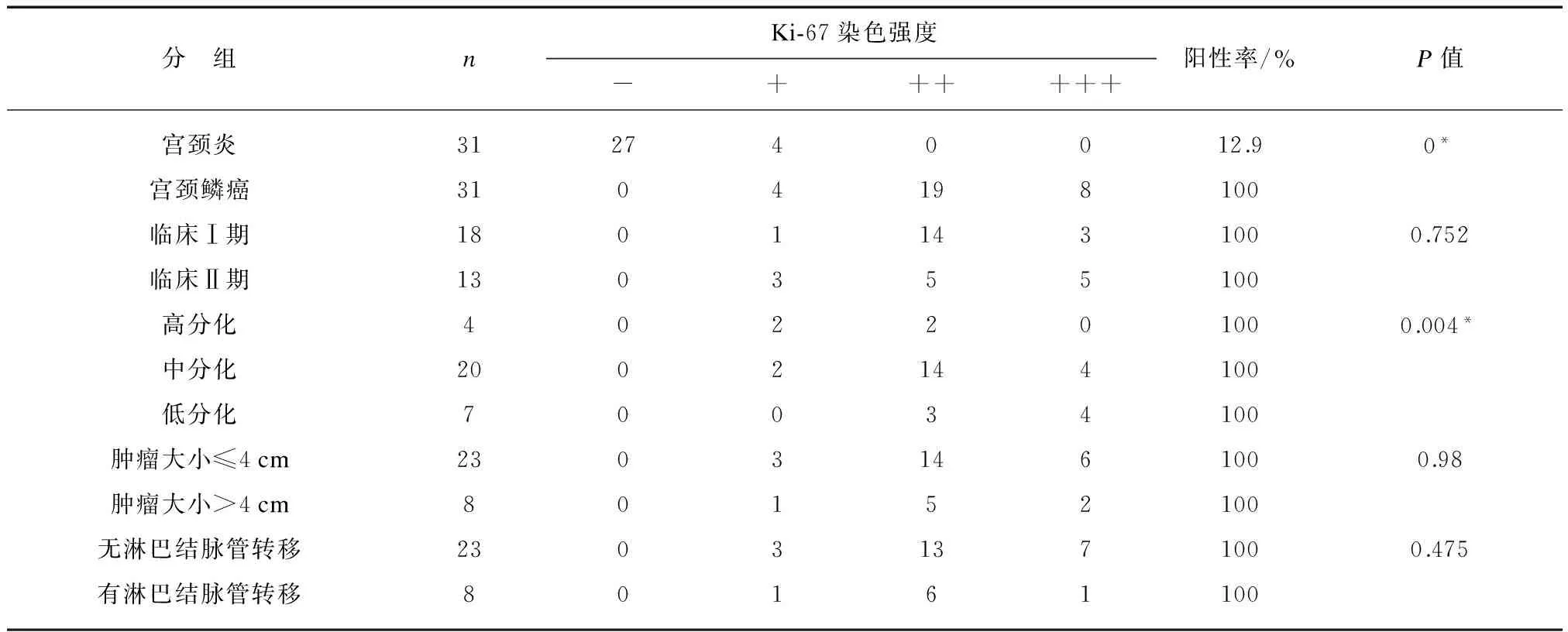
表3 Ki-67在宫颈鳞癌和宫颈炎组织中的表达及其与各病理因素的关系
P值经Spearman等级相关分析,*P<0.05

表4 宫颈鳞癌和宫颈炎患者中的血清SCC-Ag水平及其与各病理因素的关系
P值经Fisher’s精确检验,*P<0.05
2.5 四项指标之间的相关性
本研究中的四项指标p16、p53、Ki67和SCC-Ag经Spearman等级相关分析,p16染色强度与血清SCC-Ag水平呈正相关(r=0.467,P<0.05),在临床Ⅰ期患者中,两者间正相关更为显著(r=0.59,P<0.05)。而其余指标间的相关关系无显著性。
3 讨 论
宫颈癌是女性生殖道最常见的恶性肿瘤之一,高危型人乳头瘤病毒(human papillomavirus, HPV)的隐匿性持续性感染是引起宫颈癌的重要原因,致病过程涉及病毒癌蛋白E6、E7,两者可分别与肿瘤抑制蛋白p53、Rb结合并使之失活,改变与细胞转化和肿瘤发生相关的信号通路,最终使p16表达水平增加和细胞异常增殖[2]。
p16在细胞G1/S期的调控中起重要作用,其编码基因定位于人染色体9p21,是周期素依赖激酶抑制剂INK4家族成员。在宫颈癌中,E7可与Rb结合并使其失活,破坏Rb/E2F与p16之间正常的负反馈平衡,进而引起p16过度表达。许多研究表明,p16表达水平在宫颈鳞癌中异常升高,p16功能障碍有助于肿瘤形成[3-4]。本研究结果显示,p16在宫颈鳞癌中阳性表达率为96.8%,而在宫颈良性病变中则呈阴性,两者差异显著,这有助于宫颈良恶性疾病的鉴别;而在肿瘤分期、淋巴结脉管转移、组织学分级等临床病理因素之间,p16的表达差异无显著性,这与Cai等[5]的研究结果一致,提示p16表达可能发生在肿瘤形成发展、侵袭转移、恶性程度增加的全过程。
p53的编码基因定位于人染色体17p13.1,是一种细胞核磷蛋白,在激活DNA修复、调控细胞周期停滞及凋亡中起关键作用,被称作“基因组守卫”。正常细胞中p53半衰期短,不易检出,然而在基因突变、缺失、重排或与E6结合等情况下,p53结构发生改变,形成稳定的蛋白复合物,半衰期延长,可通过免疫组化技术检出,此时p53是突变和失活的,失去生长抑制作用,可引起细胞增殖失控和恶性转化[6]。本研究在31例宫颈鳞癌中检测到15例p53阳性表达,而对照组则全为阴性表达,两者差异显著,表明p53与宫颈癌的发生关系密切,这与之前的报道一致[7]。同时本研究还显示,p53强阳性的比率在淋巴结脉管转移阳性组为50%,而转移阴性组为8.7%,两者差异显著,推测随p53蛋白的失活加剧,恶性转化细胞更容易发生迁移,出现淋巴结或脉管转移。
Ki-67是一种细胞增殖核抗原,可在除G0期以外的所有细胞周期中表达,由于细胞的异常增殖、生长失控是肿瘤的重要生物学特性,Ki-67在肿瘤中呈高表达[8]。已有研究显示Ki-67与宫颈鳞癌的进展、预后密切相关,可作为肿瘤诊断、疗效监测和预后判断的指标[9]。本研究显示Ki-67在宫颈鳞癌中的表达显著高于宫颈良性疾病,表明在宫颈鳞状上皮细胞的恶性转化过程中,细胞增殖活性明显增强;此外,Ki-67的表达水平随宫颈鳞癌组织学分级的增高而增高,说明肿瘤细胞增殖越活跃,组织分化越差,恶性度越高,这与临床上低分化宫颈癌肿瘤病灶生长迅速的特点一致。
SCC-Ag是从宫颈鳞癌组织中分离出的肿瘤抗原TA-4的一个亚片段,分子量约45kDa,存在于鳞状细胞的细胞质溶质中,主要通过被动释放的形式进入血液循环,在血清中表达。其半衰期长达24h,可来源于不同器官的鳞癌,是血清检测常用的肿瘤标志物[10]。之前的研究表明,宫颈鳞癌血清SCC-Ag水平与许多危险因素及肿瘤特性相关,SCC-Ag释放入血取决于肿瘤的大小及浸润生长程度[11]。Shimura等[12]报道,宫颈癌治疗前血清SCC-Ag水平升高与分期提高、淋巴结转移、预后不良相关。本研究中宫颈鳞癌治疗前的血清SCC-Ag水平与临床分期之间呈正相关,SCC-Ag越高,分期越晚,提示血清SCC-Ag水平升高可能与肿瘤的生物学行为有一定关系,是肿瘤病灶发生发展过程中某些重要分子事件在血清中的反映。但本研究未发现SCC-Ag与淋巴结转移、肿瘤大小等因素之间有相关性,这可能是由研究对象的选择标准、SCC-Ag的检测方法或临界值的不同造成的,表现为SCC-Ag在检测敏感性上存在较大变异。文献报道,28%~88%的宫颈鳞癌患者可检出血清SCC-Ag水平升高,而本研究中SCC-Ag检测宫颈鳞癌的阳性检出率为71%,与近期报道相符。此外,本研究经Spearman相关分析,p16染色强度与血清SCC-Ag水平呈正相关,且在临床Ⅰ期患者中,两者间正相关更明显。据此推测,在宫颈鳞癌的发生发展过程中,尤其是早期阶段,p16可能与血清SCC-Ag有协同作用。但由于本研究样本较少,相关结论仍有待进一步证实。
综上所述,p16、p53、Ki-67及血清SCC-Ag的表达与宫颈鳞癌的发生关系密切,其在表达上的差异与肿瘤的生物学行为有一定关系。p53、Ki-67及血清SCC-Ag与宫颈鳞癌发展的恶性程度相关。宫颈鳞癌在发生发展过程,尤其是早期阶段,p16与血清SCC-Ag可能有协同作用。但是,相关结论仍需大样本前瞻性研究进一步证实。
[1] Chen W, Zheng R, Zeng H,et al. Annual report on status of cancer in China, 2011[J]. Chin J Cancer Res, 2015,27(1): 2-12.
[2] Portari EA, Russomano FB, de Camargo MJ, et al. Immunohistochemical expression of cyclin D1, p16Ink4a, p21WAF1, and Ki-67 correlates with the severity of cervical neoplasia[J]. Int J Gynecol Pathol, 2013,32(5): 501-508.
[3] Zhou WQ, Sheng QY, Sheng YH, et al. Expressions of survivin, p16(INK4a), COX-2, and Ki-67 in cervical cancer progression reveal the potential clinical application[J]. Eur J Gynaecol Oncol, 2015,36(1): 62-68.
[4] Von Knebel DM, Reuschenbach M, Schmidt D, et al. Biomarkers for cervical cancer screening: the role of p16(INK4a) to highlight transforming HPV infections[J]. Expert Rev Proteomics, 2012,9(2): 149-163.
[5] Cai S, Han K. Research on expression and importance of p53, p16 and VEGF-C in cervical cancer[J]. J Gynecol Obstet Biol Reprod(Paris), 2014,4(14): 198.
[6] 郭长峰,彭沪,陈远卓,等.Foxp3与突变型p53在食道鳞癌中的表达及意义[J].同济大学学报: 医学版,2015,36(1): 29-32.
[7] Shamanna RA, Hoque M, Pe’ery T, et al. Induction of p53, p21 and apoptosis by silencing the NF90/NF45 complex in human papilloma virus-transformed cervical carcinoma cells[J]. Oncogene, 2013,32(43): 5176-5185.
[8] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011,144(5): 646-674.
[9] Pan D, Wei K, Ling Y, et al. The prognostic role of Ki-67/MIB-1 in cervical cancer: a systematic review with meta-analysis[J]. Med Sci Monit, 2015,21: 882-889.
[10] 高月清,翁雷,孙静.TCT联合血清SCC-Ag在宫颈病变筛查中的价值[J].同济大学学报: 医学版,2012,33(5): 101-104.
[11] Kawaguchi R, Furukawa N, Kobayashi H,et al.Posttreatment cut-off levels of squamous cell carcinoma antigen as a prognostic factor in patients with locally advanced cervical cancer treated with radiotherapy[J]. J Gynecol Oncol, 2013,24(4): 313-320.
[12] Shimura K, Mabuchi S, Yokoi T, et al. Utility of serum squamous cell carcinoma antigen levels at the time of recurrent cervical cancer diagnosis in determining the optimal treatment choice[J]. J Gynecl Oncol, 2013,24(4): 321-329.
Expression of p16, p53, Ki-67 and serum SCC-Ag levels in cervical squamous cell carcinoma
LVJia1,FENGPing-jin2,QIANChun-mei1,WANGJin-bo1,CAOMei1,CHENGJia-jing1
(1. Dept. Of Obstetrics and Gynecology, Tenth People’s Hospital, Tongji University, Shanghai 200072, China; 2. Dept. of Pathology, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
Objective To investigate the expression of p16, p53, Ki-67 and the serum level of squamous cell carcinoma antigen SCC-Ag in cervical squamous cell carcinoma and its significance. Methods The tissue expression of p16, p53, Ki-67 was detected by immunohistochemistry, and serum SCC-Ag level was measured by chemiluinescent microparticle immunoassay in 31 cases of cervical squamous cell carcinoma and 31 cases of cervicitis. Results The positive rates of p16, p53, Ki-67, SCC-Ag in cervicitis and cervical squamous cell carcinoma were 0%, 0%, 12.9%, 0% and 96.8%, 48.4%, 100%, 71%, respectively; tere were significant differences between two groups(P<0.05). The strong expression of p53 was correlated with lymph node or vasculature metastasis. The expression of Ki-67 was increased with raising of histologic grades. The serum SCC-Ag level was increased with increasing of FIGO stages(P<0.05). Spearman correlation analysis showed that p16 expression was positively correlated with serum SCC-Ag level in cervical squamous cell carcinoma(r=0.467,P<0.05); and the Spearman correlation coefficient was higher(r=0.59,P<0.05) in FIGO stage I. Conclusion p53, Ki-67 and serum SCC-Ag may be associated with the malignant degree and biological behavior of cervical squamous cell carcinoma.
cervical squamous cell carcinoma; p16; p53; Ki-67; SCC-Ag
10.16118/j.1008-0392.2015.06.010
2015-06-18
吕 嘉(1982—),男,主治医师,硕士.E-mail: lvjia2013@163.com
成佳景.E-mail: chengjiajing1963@sina.com
R 1737
A
1008-0392(2015)06-0050-06
