m型硫氧还蛋白对马铃薯Y病毒侵染烟草的影响
2015-07-12贾蒙骜张荣春商胜华陈兴江郭玉双王仁刚
贾蒙骜,张荣春,商胜华,陈兴江,郭玉双,王仁刚*
1.贵州省烟草科学研究院烟草行业分子遗传重点实验室,贵阳市观山湖区龙滩坝路29号 550081 2.毕节市烟草公司威宁县分公司,贵州省毕节市威宁县 553100
m型硫氧还蛋白对马铃薯Y病毒侵染烟草的影响
贾蒙骜1,张荣春2,商胜华1,陈兴江1,郭玉双1,王仁刚*1
1.贵州省烟草科学研究院烟草行业分子遗传重点实验室,贵阳市观山湖区龙滩坝路29号 550081 2.毕节市烟草公司威宁县分公司,贵州省毕节市威宁县 553100
为进一步明确病毒与寄主间的相互作用关系,通过同源比对在烟草细胞中克隆到具有m型硫氧还蛋白(m-type thioredoxin)特征的基因,暂命名为NtTrm。利用原生质体瞬时转化技术、病毒诱导的基因沉默技术(VIGS)、半定量-PCR以及Northern blot检测技术研究NtTrm的表达以及NtTrm表达与PVY积累的关系。结果表明,在PVY接种10 d后红花大金元叶片中NtTrm表达明显上调;在本氏烟草叶片中NtTrm下调显著促进了PVY在烟草叶片中的积累;而在烟草原生质体中NtTrm过量表达则会明显抑制病毒RNA的积累。初步说明烟草细胞内编码m型硫氧还蛋白的基因受PVY侵染而被诱导表达,这类基因的上调表达可能影响PVY在烟草细胞中的侵染。
烟草;m型硫氧还蛋白;马铃薯Y病毒;侵染
在病毒侵染植物过程中,无论是病毒基因组的复制还是病毒在细胞间的迁移,都依赖于寄主植物[1]。这个过程中病毒的存在会造成许多寄主的基因表达量发生变化,其中以物质代谢过程相关基因、信号转导相关基因和防卫应答相关基因最为常见[2-4]。因此,研究病毒侵染后寄主植物中表达量发生变化的基因有助于解释病毒和寄主特定基因间的作用关系。Potyvirus是植物病毒中最大的一个属,而马铃薯Y病毒(PVY)是其中的典型代表。在实际生产中,PVY引起的病害可严重影响烟草等茄科作物的产量性状和品质性状。已有研究发现[5],Potyvirus的侵染可以引起寄主植物中多个基因表达量发生变化,其中以硫氧蛋白家族基因受到的诱导更为明显。目前硫氧还蛋白有f、m、x和y型,而以f和m型为典型代表[6]。在真核生物中,硫氧蛋白参与了大量的细胞生命过程,包括酶活性调控、活性氧应答、基因的转录和翻译等。其中m型硫氧还蛋白(m-Thioredoxin)影响葡萄糖-6磷酸脱氢酶(Glucose-6-phosphate dehydrogenase,G6PDH)的活性[7],而G6PDH在植物体中参与植物对生物胁迫的应答。在马铃薯花叶病毒侵染烟草后,随着侵染时间的延长,烟草细胞内的G6PDH酶活性呈线性增长趋势,因此硫氧蛋白在寄主对病毒侵染的应答中发挥了一定作用。本试验中通过对烟草中编码m型硫氧还蛋白的NtTrm基因的克隆,进而揭示NtTrm基因的功能,旨在为进一步明确病毒与寄主间的相互作用关系、筛选抗病靶标和制定防治策略奠定基础。
1 材料与方法
1.1 供试植物与病毒接种取样
供试植物为普通烟草(Nicotiana tabacum)品种红花大金元和本氏烟草(Nicotiana benthamiana),培养条件为24h,16 h光照,8 h黑暗,光暗交替。
供试毒源为PVY贵州分离物,采用金刚砂摩擦接种。红花大金元品种烟苗在第4片真叶完全展开后接种,本氏烟草在第5片真叶完全展开后2~3 d接种。采集第一片系统叶(如第4片真叶为接种叶,则第5片真叶即为第一片系统叶,以此类推)用于检测病毒积累量。
1.2 试验方法
1.2.1 NtTrm的电子克隆
参考林世峰等[8-9]的方法,以玉米硫氧还蛋白基因ZmTrm2的全长cDNA序列(NCBI序列登录号:NM_001157280)为探针,在GenBank中的EST others数据库对指定物种烟草(Nicotiana tabacum)进行BLAST检索,并参考公开发表的烟草基因组测序数据,将检索到的普通烟草的全部序列表达标签(EST)进行拼接,形成重叠群,再以重叠群为探针进行再次检索,直至无EST检出,然后以此片段为参考序列,与中国烟草基因组数据库信息进行比对,检索出同源性最高的序列信息。
1.2.2 NtTrm全长cDNA的获得
采用RNA纯化试剂盒(DP412,中国Tiangen公司)提取总RNA,以电子克隆获得的序列为参考设计反转录引物P2(表1),并根据cDNA合成试剂盒(A5001,美国Promega公司)说明书进行第一链cDNA的合成,再以cDNA为模板进行PCR扩增,获得的产物经连接后测序。
1.2.3 NtTrm的半定量RT-PCR检测
收集PVY接种后5,10和15 d的普通烟草红花大金元品种第1片系统叶提取总RNA;根据NtTrm基因的CDS序列设计半定量检测引物P5和P6(表1);以烟草Actin基因为内参基因,设计引物P7和P8(表1)。以1.2.2节所述方法获得的cDNA为模板,测定不同处理NtTrm基因在叶片中的表达量。1.2.4VIGS载体的构建和农杆菌的转化

表1 引物序列
根据NtTrm全长CDS序列,选取其中250 bp左右的区域,作为RNAi沉默的靶标片段。设计沉默载体构建引物P3和P4时引入Bam H I和Sal I酶切位点(表1),通过双酶切和连接的方法将靶标片段构建到pgR106植物瞬时沉默载体中。
pgR106载体的最适合农杆菌菌株为GV3101,将构建好的载体通过热激法转化到农杆菌感受态细胞中,挑取活性高的菌落摇菌,在吸光值1.0左右收获菌液,离心(6 000 r/min)10 min后以乙酰丁香酮的缓冲液重悬,静置2~3 h后浸润本氏烟草完全展开的第5片真叶。
在本氏烟草上分别设置农杆菌浸润接种NtTrm-PVX沉默载体、PVX空载体和无PVX载体接种3组处理,浸润3 d后再接种PVY,接种7 d后检测各组处理PVY量的变化。
1.2.5 PVY病毒粒子粗提纯与病毒RNA的提取
参照周雪平等[10]的方法进行PVY病毒粒子的粗提纯。参照Dijkstra等[11]的方法进行病毒RNA提取并作改进:100 μL病毒中加入160 μL焦碳酸二乙酯(DEPC)处理的ddH2O,再加入200 μL RNA抽提缓冲液(20 mmol/L Tris-HCl pH8.0;200 mmol/L NaCl;5 mmol/L EDTA),然后加入40 μL 10%SDS,混匀,室温保持5 min;之后用酚仿抽提,最后用1 mL 70%乙醇洗涤沉淀,室温干燥;所得RNA溶于30 μL DEPC处理的dH2O中,-20℃保存备用。
1.2.6 NtTrm瞬时表达载体的构建和烟草原生质体的转化
利用P1和P2引物中引入的Sal I和Sac I双酶切位点(表1),采用双酶切和连接的方法,将NtTrm CDS全长克隆到pGFP植物瞬时表达载体中[5]。烟草原生质体的制备、质粒DNA和病毒RNA的共转染参考哈佛大学Jen Sheen实验室总结的操作方法(http://molbio.mgh.harvard.edu/ sheenweb/jen_archive.html),以PEG介导,按10 μg质粒DNA和10 μg PVY病毒粒子RNA转染2×105个原生质体细胞的比例完成转染,空白对照只转染10 μg PVY病毒粒子RNA。转染完成后,原生质体在25℃条件下,黑暗放置12 h,之后进行RNA分析。
1.2.7 地高辛探针标记和Northern blot检测
配制10×dNTP×DIG(1 μL 10 mmol/L dATP,1 μL 10 mmol/L dGTP,1 μL 10 mmol/L dCTP,0.65 μL 10 mmol/L dTTP,3.5 μL DIG-11-dUTP,补水至10 μL);以PVY检测引物(P9/P10)扩增到的部分病毒序列为模板,采用PCR标记的方法标记地高辛探针。反应体系与常规25 μL PCR反应相同。标记模板需经切胶回收纯化,然后以1∶1 000稀释。
用于Northern杂交的总RNA经过甲醛变性的琼脂糖凝胶电泳后,采用虹吸法转膜,转膜后采用紫外交联加高温处理方法固定。杂交使用Thermo分子杂交炉,采用地高辛探针杂交,地高辛检测抗体使用Roche的Anti-Digoxigenin-AP和Fab fragments,最后加入CSPD,通过暗室X-光片曝光显示结果。
2 结果与分析
2.1 NtTrm基因CDS序列的获得
以电子克隆获得的序列信息为基础设计引物(表1),以红花大金元总RNA的反转录产物为模板,可以扩增到与预期分子量相近的特异条带。对扩增产物测序发现,这段DNA共有549 bp(图1),按照其序列推测的蛋白为182个氨基酸,功能结构域分析发现其C端具有硫氧还蛋白超家族保守结构域(图2)。将该氨基酸序列与已报道的玉米ZmTrm2氨基酸序列进行Blastp比对,功能结构域完全吻合。

图1 NtTrm CDS序列

图2 由NtTrm CDS推导的氨基酸序列
2.2 PVY侵染诱导NtTrm的表达
通过半定量RT-PCR方法对PVY侵染的烟苗进行检测,结果(图3)显示,与未接种PVY的烟苗相比,红花大金元在病毒接种5 d后,NtTrm表达量较少,但在10 d时表达量明显上调,而15 d又有明显下调。由于PVY侵染普通烟一般7~10 d开始显现茎脉坏死症状,因此推测NtTrm在PVY侵染开始显现典型症状时被诱导表达。
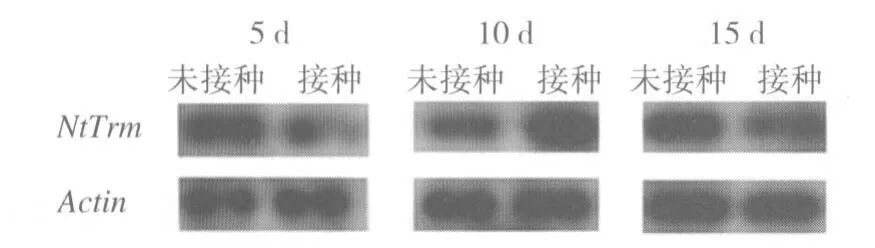
图3 PVY侵染对NtTrm表达的影响
2.3 沉默NtTrm对PVY积累的影响
利用Northern blot方法对各处理组的第1片系统叶中PVY的积累量进行检测,结果(图4B)显示,与无PVX载体预接种相比,PVX空载体接种的烟株第1片系统叶中PVY的积累量略有增加,NtTrm-PVX沉默载体预接种的烟株第1片系统叶中PVY的积累量升高非常明显。这说明NtTrm的下调表达有利于PVY在烟草细胞中积累。
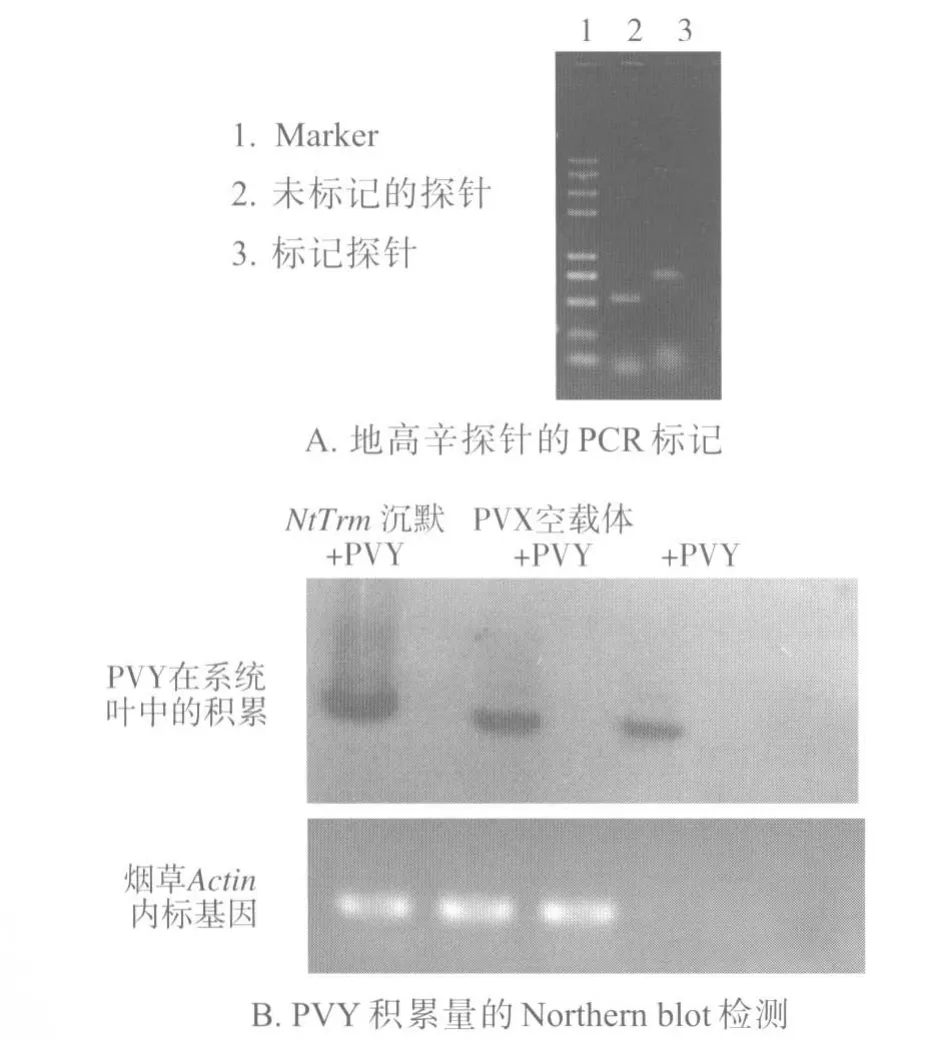
图4 沉默NtTrm对PVY在本氏烟草中积累的影响
2.4 瞬时表达NtTrm抑制PVY RNA的积累
将pGFP-NtTrm载体和PVY病毒RNA共转染到烟草原生质体内。转染12 h后,通过Northern Blot的方法检测PVY RNA的积累量。PVY RNA的积累检测结果(图5)表明,只转染PVY RNA的原生质体和共转染pGFP空载体/PVY RNA的原生质体中,PVY RNA积累量没有差异;在共转染pGFP NtTrm载体/PVY RNA的原生质体中,PVY RNA积累量明显下调。说明NtTrm超量表达对于PVY RNA的积累有抑制作用,而且抑制作用可能作用于复制相关途径中。

图5 瞬时表达NtTrm对PVY RNA积累量的影响
3 结论与讨论
通过同源克隆方法在烟草中克隆到了编码m型硫氧还蛋白的基因NtTrm。该基因的表达受到PVY的侵染诱导,沉默和过表达试验表明下调NtTrm会促进病毒积累,反之则抑制病毒RNA的积累。说明烟草中编码m型硫氧还蛋白的基因与PVY侵染关系密切。
值得注意的是,在PVY侵染后NtTrm基因表达变化方向并不是单一的,这说明调控其表达的未知寄主因子在病毒侵染的不同时期发挥着不同作用,值得进一步深入研究。另外,病毒RNA积累受抑制有可能源自胞间移动的影响,也有可能是受复制影响,而在原生质体中上调表达NtTrm抑制病毒RNA的积累则说明这种抑制可能是发生在病毒复制过程中。但这种抑制的作用机理仍不清楚,尚需要进一步试验。
[1]Hull R.Matthews’plant virology[M].4th ed.San Diego:Academic Press,2002.
[2]Golem S,Culver J N.Tobacco mosaic virus induced alterations in the gene expression profile of Arabidopsis thaliana[J].Mol Plant-Microbe Interact,2003,16(8):681-688.
[3]Marathe R,Guan Z,Anandalakshmi R,et al.Study of Arabidopsis thaliana resistome in response to cucumber mosaic virus infection using whole genome microarray[J]. Plant Mol Biol,2004,55(4):501-520.
[4]Senthil G,Liu H,Puram V G,et al.Specific and common changesinNicotianabenthamianageneexpressionin response to infection by enveloped viruses[J].J Gen Virol,2005,86:2615-2625.
[5]Shi Y,Qin Y,Cao Y,et al.Influence of m-type thioredoxin in maize on potyviral infection[J].Eur J Plant Pathol,2011,131(2):317-326.
[6]Sanz-Barrio R,Millan A F,Carballeda J.Chaperonelike properties of tobacco plastid thioredoxins f and m[J]. J Exp Botany,2012,63(1):365-379.
[7]Wenderoth I,Scheibe R,von Schaewen A.Identification of the cysteine residues involved in redox modification of plant plastidic glucose-6-phosphate dehydrogenase[J].J Biol Chem,1997,272(43):26985-26990.
[8]林世峰,任学良,王轶,等.三个烟草防御素基因的克隆及序列分析[J].中国烟草科学,2012,33(5):19-24.
[9]林世峰,任学良,王东茂,等.GASA基因超级组新成员-烟草抗菌肽基因的克隆及序列分析[J].中国烟草学报,2012,18(3):97-102.
[10]周雪平,陈集双,李德葆,等.马铃薯Y病毒组病毒高产量提取方法的建立[J].微生物学通报,1994,21(3):184-186.
[11]Dijkstra J,de Jager C.Practical plant virology:protocol and exercises[M].Berlin:Springer,1998.
责任编辑 董志坚
Effects of m-Type Thioredoxin onPotato Virus Y(PVY)Infected Tobacco
JIA Mengao1,ZHANG Rongchun2,SHANG Shenghua1,CHEN Xingjiang1,GUO Yushuang1, and WANG Rengang*1
1.Guizhou Academy of Tobacco Science,Key Laboratory of Molecular Genetics of China Tobacco,Guiyang 550081, China
2.Weining Branch of Bijie Tobacco Company,Weinig 553100,Guizhou,China
In order to further confirm the interactive relationships between virus and its host,a gene featured the characters of m-type thioredoxin in tobacco cell was cloned by homologous alignment and named as NtTrm.The expression of NtTrm and its relationship with PVY accumulation were studied by protoplast transient transformation,virus-induced gene silencing(VIGS),semi-quantitative RT-PCR and Northern blot test technologies.The results showed that the expression of NtTrm in leaves of cv. Honghuadajinyuan was obviously up-regulated 10 days after PVY inoculation;the down-regulation of NtTrm significantly promoted the accumulation of PVY in leaves of Nicotiana benthamiana;while the overexpression of NtTrm in tobacco protoplast obviously inhibited the accumulation of PVY viral RNA.It preliminarily indicated that NTtrm could be induced by PVY infection and its up-regulated expression might affect the PVY infection in tobacco cells.
Tobacco;m-Type thioredoxin;Potato virus Y(PVY);Infection
S43
A
1002-0861(2015)11-0011-05
10.16135/j.issn1002-0861.20151103
2015-01-19
2015-05-06
贵州省科学技术基金资助项目“贵州烟草马铃薯Y病毒分子变异和重组研究”(黔科合J字[2013]2194);中国烟草总公司贵州省公司资助项目“贵州烟草有害生物调查研究”(2010-22)和“烟草抗性快速鉴定体系在抗病育种中的应用研究”(2009-11)。
贾蒙骜(1983─),博士,副研究员,主要从事烟草病毒学研究。E-mail:jiamengao@126.com;*
王仁刚,E-mail:rengangwang@126.com
贾蒙骜,张荣春,商胜华,等.m型硫氧还蛋白对马铃薯Y病毒侵染烟草的影响[J].烟草科技,2015,48(11):11-15. JIA Mengao,ZHANG Rongchun,SHANG Shenghua,et al.Effects of m-type thioredoxin on Potato virus Y(PVY) infected tobacco[J].Tobacco Science&Technology,2015,48(11):11-15.
