国外种猪繁殖技术进展
2015-07-12陈志林张常明吴俊辉陈预明卫恒习张守全华南农业大学动物科学学院广东广州5064广东华农温氏畜牧股份有限公司广东新兴57400广东广三保养猪有限公司广东广州5060
陈志林 张常明 叶 超 吴俊辉 陈预明 卫恒习 李 莉 张守全*(华南农业大学动物科学学院,广东广州5064;广东华农温氏畜牧股份有限公司,广东新兴57400;广东广三保养猪有限公司,广东广州5060)
品种繁育Genetic Breeding
国外种猪繁殖技术进展
陈志林1张常明2叶超1吴俊辉1陈预明3卫恒习1李莉1张守全1*
(1华南农业大学动物科学学院,广东广州510642;2广东华农温氏畜牧股份有限公司,广东新兴527400;3广东广三保养猪有限公司,广东广州510630)
摘要:本文主要介绍了两项新发展的繁殖技术——母猪定时输精技术和精子微胶囊技术。定时输精技术是以GnRH为基础,结合PMSG、HCG、FSH、LH等激素的作用,使母猪卵泡发育和排卵同步化,进而实施定时输精;精子微胶囊技术则是在保持精子正常生理代谢和受精能力的同时,应用高分子聚合材料将原精液进行包裹,并通过常规的输精方式对母猪实施单次输精的一种技术。本文分别对此两项技术的研究背景、技术原理、生产上的应用及其前景等方面进行了概述,为相关研究人员和养猪企业提供参考。
关键词:种猪;繁殖技术;定时输精;精子微胶囊
1 母猪定时输精技术
1.1母猪定时输精技术的研究背景
目前,国内外大多数猪场都是通过观察母猪排卵规律、发情症状来确定授精时间,具有一定的盲目性。在养猪生产中,发情配种后的母猪产仔数差异较大,有的六七头,有的十多头。除品种、精液质量等原因外,授精技术也是重要的影响因素。母猪定时输精技术能够有效地把握最佳输精时间,在一定程度减少母猪在每胎产仔数上的差异,同时也可以促进猪场批次化生产管理的实施。早在1974年,德国人Hunter在东欧开始采用这项技术作为管理措施,至今应用生产已超过40年。然而,该技术在美洲和亚洲的养猪场中推广不够广泛,使用仍很少。在我国奶牛生产上,已经成功使用促性腺激素释放激素(GnRH)和氯前列烯醇(PG)诱导母牛卵巢排卵并实施定时输精[1],在养羊生产中也取得了良好效果[2];然而,在我国养猪生产中鲜有应用。
1.2定时输精的原理
发情排卵是输精的必要前提。母畜的发情排卵由体内GnRH、卵泡刺激素(FSH)、促黄体生成素(LH)等激素水平逐步升高引起。对于后备母猪,随着动物的出生,下丘脑就释放GnRH,但GnRH、FSH和LH的合成与释放对性腺类固醇类激素的负反馈极为敏感,结果达成一种维持性器官发育的低激素水平。随着母畜的体成熟和性成熟,GnRH、FSH和LH的合成和释放对性腺类固醇类激素的负反馈敏感性逐渐降低,同时垂体对GnRH的敏感性逐步提高,形成高水平的激素平衡,即形成后备母畜的初情期。对于经产母猪,哺乳期间高浓度的催乳素抑制了下丘脑GnRH的释放,哺乳期间不发情,断奶后,由于没有了仔猪对乳头及乳房的强烈刺激,催乳素浓度迅速下降,解除了对下丘脑GnRH释放的抑制作用,下丘脑开始有节律地释放GnRH,GnRH促进垂体前叶释放FSH—卵泡发育—成熟—产生的雌激素形成发情现象,同时雌激素促进GnRH-LH峰的形成,产生发情排卵现象(图1)。
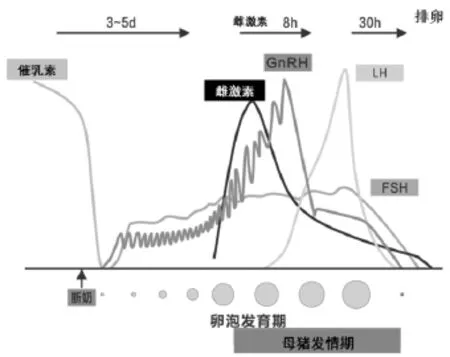
图1 经产母猪断奶后体内激素分泌及卵泡发育情况
综上所述,若要实施定时输精,那么就需要同时释放GnRH等关键激素。换言之,定时输精技术就必须以GnRH为基础,结合孕马血清促性腺激素(PMSG)、人绒毛膜促性腺激素(HCG)、卵泡刺激素(FSH)、促黄体生成素(LH)等激素共同作用,最终使母猪卵泡发育同步化和排卵同步化,进而实施定时输精。PMSG、HCG、GnRH等激素可促进母畜内源促性腺激素的释放,使所有母猪发情周期调整到相同的阶段。它是通过控制卵泡的生长发育和黄体期的长短来达到卵泡发育同步化的目的[3]。在断奶母猪中,在母猪断奶后24小时内注射PMSG使母猪卵泡发育同步化,经72小时后再注射GnRH促使卵巢同步排卵,排卵时间为38~42小时。至于后备母猪,由于其性周期不一致或隐形发情,因此需要先饲喂四烯雌酮来达到延长黄体期使性周期同步的目的;随后再注射PMSG促进卵泡发育同步化,72小时后再注射GnRH,使其排卵时间控制在40~46小时。虽然使用HCG、LH等激素也能使母猪发情,但实际上,使用GnRH促进母畜体内LH分泌更具有正常的生物学特性。通过GnRH促进FSH和LH协同分泌,具有促进卵泡最后成熟和排卵的作用,对提高排卵数、调整排卵时间以及排卵同步化具有决定性的作用。
1.3定时输精技术在母猪上的应用
早在1990年,前东德110万头母猪中,86%的母猪采用定时输精技术。他们利用HCG/GnRH处理母猪,同期发情后24~40小时对母猪进行定时输精,结果母猪的妊娠率、窝均产仔数等指标和常规人工授精的母猪相比,差异不显著,但省去了鉴定母猪发情的过程[4]。
对于断奶母猪,加拿大规模化猪场研究表明,断奶当天注射600 IU PMSG,80小时后再注射5 mg LH,然后分别在36小时和44小时各输精1次,母猪的分娩率可从之前的69%提高到86%。在断奶母猪中,GnRH必须在PMSG用药后72小时进行处理,排卵时间在38~42小时之间,可在此时进行定时输精(图2)。对于后备母猪,相关研究结果表明,用GnRH处理后24小时和48小时各输精1次,母猪的妊娠率可达到92% ~96%。但由于后备母猪的性周期不一致,因此需要先饲喂四烯雌酮来延长黄体期。此外,用1 000 IU的PMSG诱导180~210日龄的后备母猪发情是一种有效的技术方法,经过处理的小母猪75%~90%会显著发情,90%~100%会排卵。处理后前3天发情的很少,第4天是发情高峰,大多数后备母猪在处理后4~6天发情。85%~100%后备母猪在处理后的第96~144小时排卵。另外,据温氏集团内部资料显示,后备母猪在配种前发情的次数越多,其子宫的体积越大。因此,这是一种有效同步性周期的方法,同时能促进子宫发育,增加子宫体积,提高第1~2胎的产仔数。
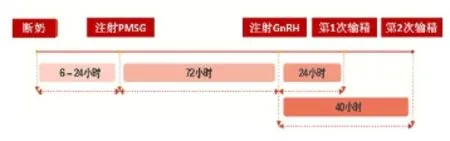
图2 母猪定时输精程序示意图
1.4定时输精技术在母猪批次化管理上的应用
一般来说母猪断奶几天后,就会出现发情现象,但由于母猪体内的激素水平不同,所以发情时间也不一致。使用人工注射性激素的方法让母猪激素达到基本一致的水平,同时启动发情周期,以实现定时输精,达到母猪批次化生产的目的。由于哺乳天数不同,断奶后母猪发情至排卵的间隔时间也会有所不同,所以在注射时要注意区分哺乳天数长于28天的断奶母猪和哺乳天数少于28天的断奶母猪(图3)。
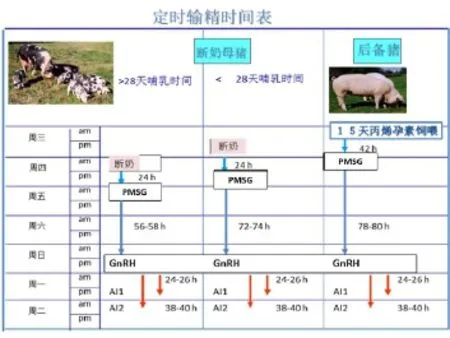
图3 不同阶段母猪定时输精的操作程序
1.5定时输精技术的应用前景
定时输精技术显著缩短了母猪的非生产天数(NPD),大大提高了母猪的利用率,是一个有效的繁殖管理办法,它不仅大幅降低了配种员对查情和适时配种技术的素质要求,而且不会因为人员变动导致生产水平大幅起伏。如果能够将母猪发情鉴定与定时输精结合起来,将会在更大程度上提高母猪的配种率。同期发情和定时输精技术处理后虽然排卵率增加,但是产仔数增加不多,可能是由子宫体积限制和早期胚胎死亡造成的。目前,我国定时输精技术还不成熟,对利用不同剂量的PMSG和GnRH进行定时输精来提高母猪的受胎率和产仔数的研究还不够深入,但毫无疑问的是,该技术是简单有效的繁殖管理方法,有利于规模化猪场组织生产。
2 精子微胶囊技术
2.1精子微囊技术的研究背景
最近几十年,由于以人工授精为代表的繁殖技术在世界范围内广泛应用,母畜的生产力和繁殖力达到了较高水平。然而,猪人工授精技术仍然面临诸多问题和困难,其中包括以下两个方面:第一,因母猪生殖易受各方面不确定因素的影响(如季节、胎次),所以单次输精的结果并不令人满意[5];第二,精子细胞膜在15℃以下时对冷冻低温的抵抗力非常脆弱,同时标准的精液稀释过程会使精液中精子的保护蛋白浓度、抗氧化分子浓度及细胞内分子浓度降低,产生“精子稀释休克”反应[6]。鉴于以上问题,能够减少输精剂量、可以实施单次人工输精的精子微胶囊技术应运而生。
精子微胶囊技术是在保持精子正常生理代谢和授精能力的同时,应用高分子聚合材料将原精液进行包裹,通过常规输精方式对母猪实施单次输精的一种技术,简单地说就是把精子作为一个整体,外面包裹一层柔软、可降解的聚合物膜,减少精子进入稀释液。胶囊的柔软度和直径允许胶囊可通过普通的海绵导管,避免了常规人工授精一次性用品的使用,同时胶囊壁允许营养物质的进入和精子代谢废物的排除,但精子表面的免疫活性分子却不能通过胶囊壁;另外微胶囊材料的高分子聚合膜在不引起子宫黏膜副作用的情况下能够黏附子宫膜,防止精液倒流,并可调节精子适时释放。该技术不仅节约了大量的一次性输精耗材,而且只需要对母猪进行单次输精,减少了操作次数。目前,该项技术在控释领域中已十分成熟。
2.2精子微胶囊技术的原理及研究结果
在1985年,Nobel研究团队最早提出精子微胶囊化的设想,他们运用多聚赖氨酸将牛精液进行微胶囊化,而后观察发现微胶囊化的精子顶体完整性及精子活力令人满意[7]。随后的试验结果表明,将猪的精子进行微胶囊化后,其具有较高比例的完整顶体,但在体外孵化8小时后仅有7%的精子具有活力,24小时后则几乎完全丧失活力。
随后,一种无支链多糖的藻酸盐替代多聚赖氨酸成为猪精液微囊化的生物聚合材料。该藻酸盐是由古罗糖醛酸(G)和甘露糖醛酸(M)两种酸缩合而成,有两种存在形式,分别为均聚物(如-GGGG-或-MMMM-)和杂聚物(如-GMGMGMGM-)。古罗糖醛酸组成G单位,在轴向方向上聚合,构成硅酸盐分子的囊结构,而这些囊结构通常会被二价或者三价离子(如Ca2+, Sr2+, Ba2+, Al3+)补充,构成了一个三维网络水凝胶。水凝胶的机械特性由G/M比率(G单位相对强度大)和离子强度决定。Torre等人采用藻酸钙作为包裹材料,对猪精子进行微胶囊化试验[8]。具体步骤如下:向一份原精液(一次授精量,不稀释)中逐滴加入5~25 mmol/L饱和氯化钙溶液,再逐滴加入藻酸钠并不断搅拌。钙离子立刻与藻酸钠反应,导致藻酸钙囊膜的形成。囊膜内部的钙离子在藻酸膜中逐渐扩散,强化和加厚囊膜,形成一道囊膜墙。其结果表明,胶囊结构非常好,但精子活力受到较大影响[8]。随后,Zhang等人提出用钡离子取代钙离子(图4),以避免由钙离子引起的精子细胞膜超极化过程,从而避免了精子过早衰竭[9]。
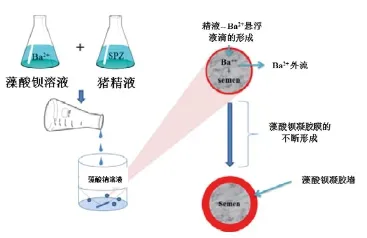
图4 精子微胶囊的原理及步骤
Vigo等人在2002年研究发现,使用藻酸钡胶囊化后1小时内的活精比例较高,其中试验组胶囊内的活精比例为(86±12)%,参照组稀释精液的活精比例为(97±6)%;胶囊化精子的结构完整性和受精能力均很好[10]。其试验结果也证明了藻酸钡胶囊能够避免精子过早发生顶体反应。随后,Faustini等人在2004年时发现藻酸钡胶囊化4小时后,保持在18℃下的胶囊内未发生顶体反应的精子显著高于参照组(稀释精液)(96% VS 85%),胶囊化72小时后同样显著高于参照组(77% VS 55%);此外,在比较精子内关键抗氧化酶和膜维持酶的活性时,胶囊化72小时后精子内细胞色素氧化酶活性极显著高于参照组[(14.9±1.6)VS(5.3±1.1)],比较六磷酸葡萄糖脱氢酶和乳酸脱氢酶活性与细胞色素氧化酶时,结论也同上[11]。Faustini等人结果也证明将精清维持在一个封闭的微胶囊化生理环境中,不仅可以防止精清里的营养成分浓度降低,也可以更好地保存精子[12]。
在生产应用方面,Torre等人首先使用5 mmol/L藻酸钡进行试验,但母猪分娩率仅有25%(12头母猪分娩4头),显著低于传统人工授精68.6%的分娩率(13头母猪分娩9头),但在产仔数上没有明显的差异[(微胶囊化产仔数为(8.3±3.1)头,传统人工授精产仔数为(11.6±2.6头)][13]。随后,Huang等人报道通过藻酸钙微胶囊精子后,在37℃保存条件下于8~32小时进行授精试验,其结果显示精子微胶囊授精试验组猪的分娩率是75%(4头母猪分娩3头),参照组传统人工授精的分娩率则为100%(4头猪全部分娩)[14]。Vigo等人于2009年进行大规模试验(试验母猪超过4 200头),试验组用藻酸钡对精子进行微胶囊化,精子剂量50亿,仅授精1次;参照组常规人工授精,授精剂量50亿精子,授精3次,最后结果显示试验组分娩率为96.5%,产仔数为(11.61±3)头,参照组分娩率为93.1%,产仔数为(11.89±3)头[15]。目前,精子微胶囊技术已经成功应用到犬类动物身上,并能保持精子正常的受精能力达7天之久。
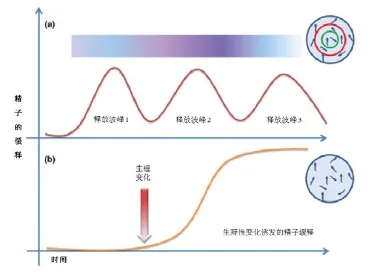
图5 精子微胶囊技术与其他技术的结合
2.3精子微胶囊技术的应用前景
精子的微胶囊技术是一项非常有前景的技术,它有助于实现对母猪单次人工授精并受孕的目的。精子的微胶囊化可以保证精子的完整性,减少精清营养成分的散失,防止精子过早发生超活化反应和顶体反应。未来该技术的研究主要是针对胶囊精子定时释放、冷冻保存、胶囊化后的最小授精量及优化设计。Anal等人在2007年时提出精子多重包裹法,应用多层胶囊对精子进行包裹以达到各时段释放等量精子的效果[16](图5a)。Kemmer等人在2011年报道他们设计促黄体生成素(LH)诱发的精子微胶囊生化电路技术,该胶囊主要根据母猪发情状况时所产生的LH浓度定时释放精子[17]。他们将能够表达LH受体的细胞与精子细胞混合进行微胶囊化,LH受体能够激活纤维素酶的表达并溶解胶囊壁(图5b)。此外,Maxwell等人提出精子微胶囊与猪性别控制技术的联用,通过单次输精以减少输精量并达到养猪生产上的性别控制[18]。Corcini等人最近针对该技术也提出一种新的处理精子方案,即向精液内添加明胶,用明胶包裹精子并提高精液内精子的完整性以及运动能力。试验表明在明胶处理后96小时精液内正常精子比例显著提高,此外明胶包裹的精液可以减慢人工授精后的精液回流[19]。
总之,精子微胶囊技术可以优化猪的人工授精技术,最终达到人工授精单次操作,其未来将是猪繁殖技术新的转折点。
参考文献
[1]傅春泉,王争光,黄攀.奶牛定时排卵、输精技术试验初报[J].黑龙江畜牧兽医, 2010(1):74-75.
[2]高志英,霍飞,艾尼阿木提,等.多浪羊同期发情、定时输精效果探讨[J].中国草食动物科学, 2014, 34(4):80-81.
[3]王杏龙,戴荣亮,周俊波,等.母猪的同期发情配种试验[J].繁殖与生理, 2006, 42(13):18-19.
[4] HühnU, J?chleW, BrüssowKP. Techniques developed for the control of estrus, ovulationand parturition in the East German pig industry: a review [J]. Theriogenology, 1996, 46(6): 11-24.
[5] Belstra BA, Flowers WL, See MT. Factors affecting temporal relationships between estrus and ovulation in commercial sow farms[J]. Anim Reprod Sci, 2004(84):377-394.
[6] Johnson LA, Weitze KF, Fiser P, et al. Storage of boar semen[J]. Anim Reprod Sci, 2000(62):143-172.
[7] Nebel RL, Bame JH, Saacke RG, et al. Microencapsulation of bovine spermatozoa[J]. J Anim Sci, 1985(60):1631-1639.
[8] Torre ML, Maggi L, Vigo D, et al. Controlled release of swine semen encapsulated in calcium alginate beads [J]. Biomaterials, 2000(21):1439-1498.
[9] Zhang D, Gopalakrishnan M. Sperm ion channels: molecular target for the next generation of contraceptive medicines?[J]. J Androl, 2005(26):643-653.
[10] Vigo D, Faustini M, Torre ML, et al. Boar semen controlleddelivery system: morphological investigation and in vitro fertilization test[J]. Reprod Fertil Dev, 2002(14):307-314.
[11] Faustini M, Torre ML, Stacchezzini S, et al. Boar spermatozoa encapsulated in bariumalginate membranes: a microdensitometric evaluation of some enzymatic activities during storage at 18_C[J]. Theriogenology, 2004(61):173-184.
[12] Faustini M, Bucco M, Galeati G, et al. Boar sperm encapsulation reduces in vitro polyspermy[J]. Reprod Domest Anim, 2010(45)359-362.
[13] Torre ML, Faustini M, Maggi L, et al. In-field evaluation of barium alginate sperm delivery system in swine. Proceedings 4th World Meeting ADRITELF?APGI?APV, Florence, Italy. 2002. 889-890.
[14] Huang SY, Tu CF, Liu SH, et al. Motility and fertility of alginate encapsulated boar spermatozoa [J]. Anim Reprod Sci, 2005(87):111-120.
[15] Vigo D, Faustini M, Villani S, et al. Semen controlledrelease capsules allow a single artificial insemination in sows[J]. Theriogenology, 2009(72):439-444.
[16] Anal AK. Time-controlled pulsatile delivery systems for bioactive compounds [J]. Recent Pat Drug Deliv Formul, 2007(1): 73-79.
[17] Kemmer C, Fluri DA, Witschi U, et al. A designer network coordinating bovine artificial insemination by ovulation-triggered release of implanted sperms [J]. J Control Release, 2011(150): 23-29.
[18] Maxwell WMC, Johnson LA. Chlortetracycline analysis of boar spermatozoa after incubation, flow cytometric sorting, cooling, or cryopreservation[J]. Mol Reprod Dev, 1997(46):408-418.
[19] Corcini CD, Moreira F, Pigozzo R, et al. Semen quality and reproductive performance after artificial insemination with boar sperm stored in a gelatin-supplemented extender[J]. Livest Sci, 2011(138):289-292.
中图分类号:S828.5;S814
文献标识码:B
文章编号:1673-4645(2015)03-0037-05
收稿日期:2015-01-13
基金项目:国家科技支撑计划项目(2011BAD19B03)、广东省现代农业产业体系生猪创新团队育种与繁殖岗位专家[粤农(2009)380号]及东莞市科技计划项目(2012108102049)
作者简介:陈志林(1989-),男,广东新兴人,在读硕士研究生,研究方向:动物遗传与繁育,E-mail:qq505878698@sina.com
*通讯作者:张守全,教授,博士生导师,研究方向:动物遗传与繁育,E-mail:sqzhang@scau.edu.cn
